Химические свойства
1. Оксид азота (IV) реагирует с водой с образованием двух кислот — азотной и азотистой:
Если растворение NO2 в воде проводить в избытке кислорода , то образуется только азотная кислота:
Поскольку азотистая кислота неустойчива, то при растворении NO2 в теплой воде образуются HNO3 и NO:
При нагревании выделяется кислород:
2. При растворении оксида азота (IV) в щелочах образуются нитраты и нитриты:
В присутствии кислорода образуются только нитраты:
3. Оксид азота (IV) – сильный окислитель. В атмосфере оксида азота (IV) горят фосфор , уголь , сера , оксид серы (IV) окисляется до оксида серы (VI):
4. Оксид азота (IV) димеризуется :
Источник
Азот N2
Простое вещество. Состоит из неполярных молекул с очень устойчивой ˚σππ-связью N≡N, этим объясняется химическая инертность элемента при обычных условиях.
Бесцветный газ без вкуса и запаха, конденсируется в бесцветную жидкость (в отличие от O2).
Главная составная часть воздуха 78,09% по объему, 75,52 по массе. Из жидкого воздуха азот выкипает раньше, чем кислород. Малорастворим в воде (15,4 мл/1 л H2O при 20 ˚C), растворимость азота меньше, чем у кислорода.
При комнатной температуре N2, реагирует с фтором и в очень малой степени – с кислородом:
Обратимая реакция получения аммиака протекает при температуре 200˚C, под давлением до 350 атм и обязательно в присутствии катализатора (Fe, F2O3, FeO, в лаборатории при Pt )
В соответствии с принципом Ле-Шателье увеличение выхода аммиака должно происходить при повышении давления и понижении температуры. Однако скорость реакции при низких температурах очень мала, поэтому процесс ведут при 450-500 ˚C, достигая 15%-ного выхода аммиака. Непрориагировавшие N2 и H2 возвращают в реактор и тем самым увеличивают степень протекания реакции.
Азот химически пассивен по отношению к кислотам и щелочам, не поддерживает горения.
Получение в промышленности – фракционная дистилляция жидкого воздуха или удаление из воздуха кислорода химическим путем, например по реакции 2C(кокс) + O2 = 2CO при нагревании. В этих случаях получают азот, содержащий так же примеси благородных газов (главным образом аргон).
В лаборатории небольшие количества химически чистого азота можно получить по реакции конмутации при умеренном нагревании:
Применяется для синтеза аммиака. Азотной кислоты и других азотсодержащих продуктов, как инертная среда проведения химических и металлургических процессов и хранения огнеопасных веществ.
Азот и его соединения
Азот — элемент 2-го периода V А-группы Периодической системы, порядковый номер 7. Электронная формула атома [2He]2s 2 2p 3 , характерные степени окисления 0,-3, +3 и +5, реже +2 и +4 и др. состояние N v считается относительно устойчивым.
Азот обладает высокой электроотрицательностью (3,07), третий после F и O. Проявляет типичные неметаллические (кислотные) свойства, образуя при этом различные кислородсодержащие кислоты, соли и бинарные соединения, а так же катион аммония NH4 и его соли.
В природе – семнадцатый по химической распространенности элемент (девятый среди неметаллов). Жизненно важный элемент для всех организмов.
Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
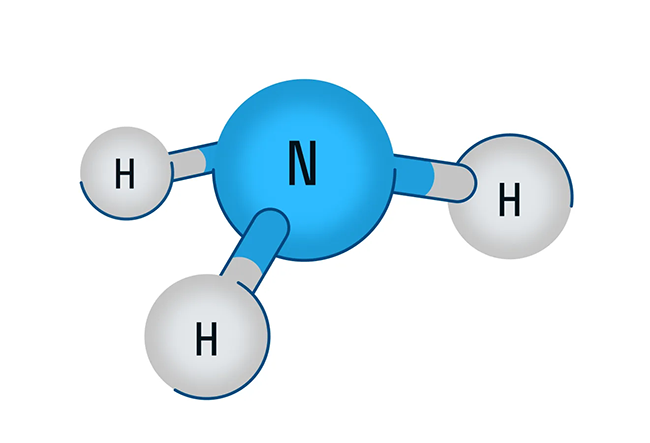
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):

Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
-
6NH3 + 8KClO3 + 6NaOH = 6NaNO3 + 8KCl + 12H2O
-
10NH3 + 6KMnO4 + 9H2SO4 = 5N2 + 6MnSO4 + 3K2SO4 + 24H2O
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
-
NH3 + HCl = NH4Cl
-
NH3 + H2SO4 = NH4HSO4
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
-
Промышленный способ — синтез из простых веществ:
-
Лабораторный способ:
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.
Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
-
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2O -
Окисление оксида азота (II)
2NO + O2 = 2NO2 -
Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:

Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:

Азотная кислота в соотношении 1:3 с соляной кислотой образуют смесь под названием царская водка. Это желтовато-оранжевая дымящаяся жидкость, которая получила свое название от алхимиков благодаря способности растворять «царские» металлы — золото и платину.
Оксиды азота
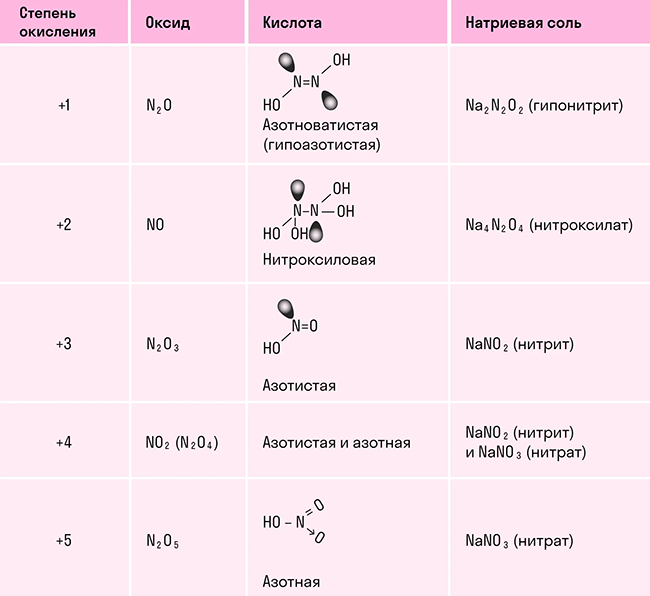
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:
Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Химические свойства азотной кислоты
HNO3 является одной из самых сильных кислот — в водных растворах полностью диссоциирует на катионы водорода и нитрат-ионы:HNO3 H++NO3—
Азотная кислота вступает в реакции:
- с оксидами металлов:MgO+2H+NO3 = Mg2+(NO3)2+H2O
- с основаниями:Mg(OH)2+2H+NO3 = Mg2+(NO3)2+2H2O
- с солями более слабых кислот:
Na2CO32-+2H+NO3 = 2NaNO3+CO2↑+H2O
Следует обратить внимание, что азотная кислота в обменных реакциях может взаимодействовать далеко не со всеми солями, а лишь только с теми, при реагировании с которыми образуются нерастворимые, слабодиссоциирующие и газообразные вещества, которые, по мере их образования, более не участвуют в реакции обмена. В обменных реакциях солями, при взаимодействии с которыми образуются растворимые в воде соли азотной кислоты, азотная кислота не участвует
В окислительно-восстановительных реакциях азотная кислота выступает в роли сильного окислителя. Высокие окислительные свойства HNO3 объясняются тем, что в молекуле азотной кислоты атом азота в составе кислотного остатка NO3— имеет максимально возможную степень окисления +5. По этой причине окислительные свойства NO3— значительно превосходят «возможности» катионов водорода H+, из-за чего азотная кислота реагирует практически со всеми металлами за исключением золота,платины, родия, рутения, иридия и тантала, стоящими в конце ряда напряжений.

Характерной особенностью взаимодействия азотной кислоты с металлами является отсутствие выделения водорода, поскольку окислителями являются не катионы водорода, а нитрат-ионы NO3-, которые, при взаимодействии азотной кислоты с металлами восстанавливается тем полнее, чем более активным является металл и чем более разбавленной является HNO3.
По этой причине образование тех или иных продуктов реакции азотной кислоты и металла зависит от концентрации кислоты и активности металла.
Атом азота в молекуле азотной кислоты имеет степень окисления +5, и может принимать 1, 2, 3, 4, 5 или 8 электронов:
HN+5O3+1e- → N+4O2 HN+5O3+2e- → HN+3O2 HN+5O3+3e- → N+2O HN+5O3+4e- → N2+1O HN+5O3+5e- → N2 HN+5O3+8e- → N-3H3 HN+5O3+8e- → N-3H4NO3
Чем более концентрированной является азотная кислота, тем меньшей окислительной способностью по отношению к металлам она обладает.
С другой стороны, чем более активным является металл, тем в большей степени он восстанавливает азотную кислоту.
Примеры реакций азотной кислоты:
-
концентрированная HN+5O3 с активными металлами (до алюминия в ряду напряжений) восстанавливается до N2O
10HN+5O3+4Ca = 4Ca+2(NO3)2+N2+1O↑+5H2O -
концентрированная HN+5O3 с неактивными металлами (Ni, Cu, Ag, Hg) восстанавливается до NO2
4HN+5O3+Ni = Ni+2(NO3)2+2N+4O2↑+2H2O -
концентрированная HN+5O3 с неметаллами (Ni, Cu, Ag, Hg) восстанавливается до NO2
4HN+5O3+P = HP+5O3+5N+4O2↑+2H2O -
разбавленная HN+5O3 с активными металлами (до алюминия в ряду напряжений) образует аммиак или нитрат аммония
10HN+5O3+4Mg = 4Mg+2(NO3)2+N-3H4N+5O3+3H2O -
разбавленная HN+5O3 с неактивными металлами образует оксид азота (II)
8HN+5O3+3Cu = 3Cu+2(NO3)2+2N+2O↑+4H2O -
разбавленная HN+5O3 с неметаллами образует оксид азота (II)
2HN+5O3+S = H2S+6O4+2N+2O↑
Концентрированная азотная кислота пассивирует алюминий, железо и хром, образуя на их поверхности очень прочную нерастворимую оксидную пленку:
2Al+6HNO3 = Al2O3+6NO2+3H2O
«Царская водка» (смесь концентрированной азотной кислоты с соляной в соотношении 1:3) окисляет золото и платину:
Au+3HNO3+3HCl = AuCl3+3NO2+3H2O
Оксиды азота

При описании свойств азота отмечалось, что при непосредственном взаимодействии азота с кислородом образуется только оксид азота (II) NO. Однако существуют оксиды азота со всеми возможными степенями окисления (от +1 до +5).
При обычной температуре N2O — бесцветный газ со слабым приятным запахом и сладковатым вкусом; обладает наркотическим действием, вызывая сначала судорожный смех, затем — потерю сознания.
1. Разложение нитрата аммония при небольшом нагревании:
2. Действие HNO3 на активные металлы
NO — оксид азота (II), монооксид азота
При обычной температуре NO — бесцветный газ без запаха, малорастворимый в воде, очень токсичный (в больших концентрациях изменяет структуру гемоглобина).
2NO + O2 = 2NO2
10NO + 6KMnO4 + 9H2SO4 = 10HNO3 + 3K2SO4 + 6MnSO4 + 4Н2О
NO2 — оксид азота (IV), диоксид азота
При обычной температуре NO2 — красно-бурый ядовитый газ с резким запахом. Представляет собой смесь NO2 и его димера N2O4 в соотношении -1:4. Диоксид азота хорошо растворяется в воде.
NO2 — кислотный оксид, смешанный ангидрид 2-х кислот
NO2 взаимодействует с водой, основными оксидами и щелочами. Но реакции протекают не так, как с обычными оксидами — они всегда окислительно — восстановительные. Объясняется это тем, что не существует кислоты со С.О. (N) = +4, поэтому NO2 при растворении в воде диспропорционирует с образованием 2-х кислот — азотной и азотистой:
2NO2 + Н2О = HNO3 + HNO2
Если растворение происходит в присутствии O2, то образуется одна кислота — азотная:
4NO2 + 2Н2О + O2 = 4HNO3
Аналогичным образом происходит взаимодействие NO2 со щелочами:
в отсутствие O2: 2NO2 + 2NaOH = NaNO3 + NaNO2 + Н2О
в присутствии O2: 4NO2 + 4NaOH + O2 = 4NaNO3 + 2Н2О
NO2 — очень сильный окислитель
По окислительной способности NO2 превосходит азотную кислоту. В его атмосфере горят С, S, Р, металлы и некоторые органические вещества. При этом NO2 восстанавливается до свободного азота:
10NO2 + 8P = 5N2 + 4P2O5
2NO2 + 8HI = N2 + 4I2 + 4Н2О (возникает фиолетовое пламя)
В присутствии Pt или Ni диоксид азота восстанавливается водородом до аммиака:
2NO2 + 7Н2 = 2NH3 + 4Н2О
Как окислитель NO2 используется в ракетных топливах. При его взаимодействии с гидразином и его производными выделяется большое количество энергии:
2NO2 + 2N2H4 = 3N2 + 4Н2О + Q
N2O3 и N2O5 — неустойчивые вещества
Оба оксида имеют ярко выраженный кислотный характер, являются соответственно ангидридами азотистой и азотной кислот.
N2O3 как индивидуальное вещество существует только в твердом состоянии ниже Т пл. (-100С).
С повышением температуры разлагается: N2O3 → NO + NO2
N2O5 при комнатной температуре и особенно на свету разлагается так энергично, что иногда самопроизвольно взрывается:
ОКСИДЫ АЗОТА
Оксид азота ( I ) N 2 +1 O закись азота, «веселящий газ»
Физические свойства: г аз, бесцветный, запах сладковатый, растворим в воде, t ° пл.= -91 ° C , t ° кип.= -88,5 ° С. Анестезирующее средство. Несолеобразующий
Получение: NH 4 NO 3 – t ° → N 2 O + 2Н2 O
1. Разлагается при 700 ° C с выделением кислорода:
поэтому он поддерживает горение и является окислителем
Оксид азота ( II ) N +2 O окись азота
Физические свойства : г аз, бесцветный, плохо растворим в воде, t ° пл.= -164 ° C , t ° кип.= -152 ° С
1. Каталитическое окисление аммиака (промышленный способ)
3. N 2 + O 2 → 2 NO (в природе, во время грозы)
1. Легко окисляется кислородом и галогенами
2NO + Cl2 → 2NOCl (хлористый нитрозил)
Химические свойства
Все свойства кислотных оксидов .
Оксид азота ( IV ) N +4 O 2 двуокись азота, диоксид азота
Физические свойства: бурый газ, запах резкий, удушливый, ядовит, t °пл.= -11,2° C , t °кип.= 21°С.
1. Кислотный оксид. Взаимодействие с водой
2. Взаимодействие с щелочами
2 NO 2 (бурый газ) → N 2 O 4 (бесцветная жидкость)
Оксид азота ( V ) N 2 +5 O 5 азотный ангидрид
Физические свойства: Кристаллическое вещество, летучее, неустойчивое.
1. Кислотный оксид: взаимодействие с водой
N 2 O 5 + H 2 O → 2 HNO 3
2. Легко разлагается (при нагревании — со взрывом):
Источник
Оксиды азота. Общая характеристика, химические свойства.

Данный урок посвящен оксидам азота, которые при взаимодействии с водой образуют кислоты, и соответственно, являются солеобразующими, — NO2 и N2O5 .
NO2 представляет собой типичный кислотный оксид, который обладает высокой химической активностью , и при взаимодействии с неметаллами (сера, фтор, водород) ведет себя как сильный окислитель; также применяется при производстве серной кислоты (нитрозный метод), окисляя сернистый газ в олеум (SO3), и азотистой кислоты (HNO2).
N2O5 — это высший оксид азота, очень летуч, взаимодействует с органическими веществами, поэтому его нужно хранить в стеклянной посуде ( !Важно! плавиковая кислота (HF) наоборот хранится в полимерной таре по причине того, что разъедает стекло ), легко разлагается до ядовитого NO2 со взрывом ; используется при получении азотной кислоты (HNO3). Более детально изучить химические свойства предлагаю при помощи таблицы, в которой собраны все необходимые реакции для сдачи ЕГЭ
Более детально изучить химические свойства предлагаю при помощи таблицы, в которой собраны все необходимые реакции для сдачи ЕГЭ.
Солеобразующие оксиды азота
N2O5
NO2 ( Nitrogen dioxide, диоксид азота) – красно — бурый газ, ядовит,
с характерным острым запахом;
Хорошо растворяется в воде;
N2O5 ( Dinitrogen pentoxide , пентаоксид азота) – бесцветные, летучие кристаллы, взрывчатые;
Хорошо растворяется в воде;
3) Получение в лаборатории
4) Получение в промышленности
NO + O2 = NO2 (на воздухе — мгновенно);
5) Химические свойства
1) Разложение
2) C кислотами
3) С металлами
4) С неметаллами:
В присутствии воды реакция идет (образование HNO3):
5) С солями
6) С оксидами
7) C основаниями:
2NO2 + 2KOH = KNO3 + KNO2 + H2O
1) Разложение:
2) С кислотами:
3) С металлами:
4) С неметаллами:
5) С солями
6) С оксидами:
7) С основаниями:
1) Используется при производстве H2SO4 и HNO3;
2) Окислитель в жидком ракетном топливе;
3) Вместе с другими оксидами азота образует «лисий хвост» — выбросы химического производства, и из выхлопных труб автомобилей;
4) Токсичен, вызывает отек легких.
1) Применение ограничено из-за взрывоопасной природы оксида азота (V);
2) Используется в качестве нитрующего агента (в органической химии).
Следующее занятие будет посвящено задачам по этой теме.
Страницы
Главная страницаОСНОВЫ ОБЩЕЙ ХИМИИ1.1 Важнейшие классы неорганических веществ2.1 Вещества. Атомы2.2 Размеры атомов2.3 Молекулы. Химические формулы2.4 Простые и сложные вещества2.5 Валентность элементов2.6 Моль. Молярная масса2.7 Закон Авогадро2.8 Закон сохранения массы веществ2.9 Вывод химических формул3.1 Строение атома. Химическая связь3.2 Строение атома3.4 Строение электронной оболочки атома3.5 Периодическая система химических элементов3.6 Зависимость свойств элементов3.7 Химическая связь и строение вещества3.8 Гибридизация орбиталей3.9 Донорно-акцепторный механизм образования3.10 Степени окисления элементов4.1 Классификация химических реакций4.2 Тепловые эффекты реакций4.3 Скорость химических реакций4.4 Необратимые и обратимые реакции4.5 Общая классификация химических реакцийНЕОРГАНИЧЕСКАЯ ХИМИЯ5.1 Растворы. Электролитическая диссоциация5.2 Количественная характеристика состава растворов5.3 Электролитическая диссоциация5.4 Диссоциация кислот, оснований и солей5.5 Диссоциация воды5.6 Реакции обмена в водных растворах электролитов5.7 Гидролиз солей6.1 Важнейшие классы неорганических веществ6.2 Кислоты, их свойства и получение6.3 Амфотерные гидроксиды6.4 Соли, их свойства и получение6.5 Генетическая связь между важнейшими классами6.6 Понятие о двойных солях7.1 Металлы и их соединения7.2 Электролиз7.3 Общая характеристика металлов7.4 Металлы главных подгрупп I и II групп7.5 Алюминий7.6 Железо7.7 Хром7.8 Важнейшие соединения марганца и меди8.1 Неметаллы и их неорганические соединения8.2 Водород, его получение8.3 Галогены. Хлор8.4 Халькогены. Кислород8.5 Сера и ее важнейшие соединения8.6 Азот. Аммиак. Соли аммония8.7 Оксиды азота. Азотная кислота8.8 Фосфор и его соединения8.9 Углерод и его важнейшие соединения8.10 Кремний и его важнейшие соединенияОРГАНИЧЕСКАЯ ХИМИЯ9.1 Основные положения органической химии. Углеводороды9.2 Электронные эффекты заместителей в органических соединениях9.3 Предельные углеводороды (алканы)9.3.1 Насыщенные УВ. Метан9.4 Понятие о циклоалканах9.5 Непредельные углеводороды9.6 Диеновые углеводороды (алкадиены)9.7 Алкины9.8 Ароматические углеводороды9.9 Природные источники углеводородов10.1 Кислородсодержащие органические соединения10.2 Фенолы10.3 Альдегиды10.4 Карбоновые кислоты10.5 Сложные эфиры. Жиры10.6 Понятие о поверхностно-активных веществах10.7 Углеводы11.1 Амины. Аминокислоты11.2 Белки11.3 Понятие о гетероциклических соединениях11.4 Нуклеиновые кислоты12.1 Высокомолекулярные соединения12.2 Синтетические волокна▼
Азот (N)
Соединения азота:
Однозначано назвать ученого, который первым открыл азот не представляется возможным по той простой причине, что это практически одновременно сделали в 1772 году сразу трое — Генри Кавендиш, Джозеф Пристли и Даниэль Резерфорд (еще к этому списку можно причислить и Карла Шееле). Однако, ни один из ученых в свое время так и не понял до конца своего открытия. Многие «пальму первенства» отдают шотландцу Даниэлю Резерфорду, поскольку он первым опубликовал магистерскую диссертацию, в которой описал основные свойства «испорченного воздуха».
Собственно название «азот» было предложено в 1787 году А. Лавуазье.
Азот является четвертым самым распространенным химическим элементом Солнечной системы (после водорода, гелия и кислорода). Азот является одним из самых распространенных элементов на Земле:
- в земной атмосфере азота содержится 3,87·10 18 кг — 75,6% (по массе) или 78,08% (по объему);
- в земной коре азота содержится (0,7—1,5)·10 18 кг;
- в земной мантии азота содержится 1,3·10 19 кг;
- в гидросфере азота содержится 2·10 16 кг (7·10 14 кг в виде соединений).
Азот играет важнейшую роль в жизнедеятельности организмов — он присутствует в белках, аминокислотах, аминах, нуклеиновых кислотах.
Природный азот состоит из двух стабильных изотопов 14 N — 99,635% и 15 N — 0,365%.
Атом азота содержит 7 электронов, которые располагаются на двух орбиталях (s и p) (см. Электронная структура атомов). На внутренней орбитали расположены 2 электрона; на внешней — 5 (одна свободная электронная пара + три неспаренных электрона, которые могут образовывать три ковалентные связи; см. Ковалентная связь).
Вступая в реакции с другими химическими элементами, атом азота может проявлять степень окисления от +5 до -3 (кроме трех валентных электронов еще одна связь может образовываться по донорно-акцепторному механизму за счет свободной электронной пары с атомом, имеющим свободную орбиталь).
Степени окисления азота:
Три неспаренных р-электрона атома азота, лежащие на его внешнем энергетическом уровне, имеют форму равноплечей восьмерки, располагаясь перпендикулярно друг к другу:
При образовании молекулы азота (N2) p-орбиталь, расположенная по оси X, одного атома, перекрывается с аналогичной px-орбиталью другого атома — в месте пересечения орбиталей образуется повышенная электронная плотность с формирование ковалентной связи (σ-связь).
Две другие орбитали одного атома, расположенные по осям Y и Z, перекрываются боковыми поверхностями со своими «собратьями» другого атома, образуя еще две ковалентные связи (π-связи).
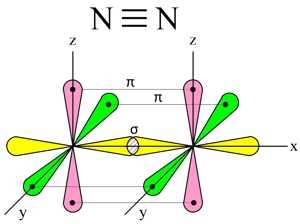
В итоге, в молекуле азота (N2) образуются 3 ковалентные связи (две π-связи + одна σ-связь), т. е., возникает очень прочная тройная связь (см. Множественные связи).
Молекула азота очень прочная (энергия диссоциации 940 кДж/моль), обладает низкой реакционной способностью.
Оксид азота: свойства и все характеристики

В связи с тем, что в своих соединениях азот проявляет различные валентности, для этого элемента характерно несколько оксидов: оксид диазота, моно-, три-, ди- и пентаоксиды азота. Рассмотрим каждый из них более подробно.
Плохо растворяется в воде. При сильном охлаждении из раствора кристаллизуется кларат N2O×5,75H2O.
В твердом состоянии он полностью димеризован (N2O2), в жидком состоянии – частично (≈ 25% N2O2), в газе – в очень малой степени. Чрезвычайно термически устойчив. Плохо растворяется в воде.
При комнатной температуре на 90% разлагается на NOи NO2 и окрашивается в бурый цвет (NO2), не имеет температуры кипения (NO испаряется первым). В твердом состоянии – это белое или голубоватое вещество с ионным строением – нитрит нитрозила (NO+)(NO2—). В газе имеет молекулярное строение ON-NO2.
При температуре выше 135oС – это мономер, при комнатной температуре – красно-бурая смесь NO2 и его димера (тетраоксида диазота) N2O4. В жидком состоянии димер бесцветен, в твердом состоянии белый. Хорошо растворяется в холодной воде (насыщенный раствор – ярко-зеленый), полностью реагируя с ней.
При нагревании возгоняется и плавится, при комнатной температуре разлагается за 10 часов. В твердом состоянии имеет ионное строение (NO2+)(NO3—) – нитрат нитроила.
Таблица 1. Физические свойства оксидов азота.
| Молекулярная формула | N2O | NO | N2O3 | NO2 | N2O5 |
| Молярная масса, г/моль | 44 | 30 | 76 | 46 | 108 |
| Плотность, г/л | 1,9778 | 1,3402 | — | 2,0527 | — |
| Температура плавления, oС | -90,9 | -163,6 | -101 | -11,2 | 41 |
| Температура кипения, oС | -88,6 | -151,7 | 4,5 | 21,1 | — |
Получение оксида азота
В лабораторных условиях оксид диазота получают путем осторожного нагревания сухого нитрата аммония (1) или нагреванием смеси сульфаминовой и азотной (73%-ная) кислот (2):
NH4NO3 = N2O + 2H2O (1);
NH2SO2OH + HNO3 = N2O + H2SO4 + H2O (2).
Монооксид азота получают взаимодействием простых веществ азота и кислорода при высоких температурах (≈1300oС):
N2 + O2 = 2NO.
Кроме этого оксид азота (II) является одним из продуктов реакции растворения меди в разбавленной азотной кислоте:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
При охлаждении смеси газов, состоящей из оксидов азота (II) и (IV) до -36oС образуется триоксид азота:
NO + NO2 = N2O3.
Данное соединение можно получить при действии 50%-ной азотной кислоты на оксид мышьяка (III) (3) или крахмал (4):
2HNO3 + As2O3 = NO2 + NO + 2HAsO3 (3);
HNO3 + (C6H10O5)n = 6nNO + 6nNO2 + 6nCO2 + 11nH2O (4).
Термическое разложение нитрата свинца (II) приводит к образованию диоксидазота:
2Pb(NO3)2 = 2PbO + 4NO2 + O2.
Это же соединение образуется при растворении меди в концентрированной азотной кислоте:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O.
Пентаоксид азота получают путем пропускания сухого хлора над сухим нитратом серебра (5), а также по реакции взаимодействия между оксидом азота (IV) и озоном (6):
2Cl2 + 4AgNO3 = 2N2O5 + 4AgCl + O2 (5);
2NO2 + O3 = N2O5 + O2 (6).
Химические свойства оксида азота
Оксид диазота малореакционноспособный, не реагирует с разбавленными кислотами, щелочами, гидратом аммиака, кислородом. При нагревании реагирует с колнцентрированной серной кислотой, водородом, металлами, аммиаком. Поддерживает горение углерода и фосфора. В ОВР может проявлять свойства как слабого окислителя, так и слабого восстановителя.
Монооксид азота не реагирует с водой, разбавленными кислотами, щелочами, гидратом аммиака. Мгновенно присоединяет кислород. При нагревании реагирует с галогенами и другими неметаллами, сильными окислителями и восстановителями. Вступает в реакции комплексообразования.
Триоксид азота проявляет кислотные свойства, реагирует с водой, щелочами, гидратом аммиака. Энергично реагирует с кислородом и озоном, окисляет металлы.
Пентаоксид азота проявляет кислотные свойства, реагирует с водой, щелочами, гидратом аммиака. Является очень сильным окислителем.
Применение оксида азота
Оксид диазота используют в пищевой промышленности (пропеллент при изготовлении взбитых сливок), медицине (для ингаляционного наркоза), а также в качестве основного компонента ракетного топлива.
Триоксид и диоксид азота применяются в неорганическом синтезе для получения азотной и серной кислот. Оксид азота (IV) также нашел применение в качестве одного из компонентов ракетного топлива и смесевых взрывчатых веществ.
Криогенное производство
Способ заключается в пофракционном испарении сжиженного воздуха и основан на разнице температур кипения его компонентов. Процесс протекает несколько этапов:
- Воздух сжимается в компрессорной установке с одновременным отбором тепла, выделяющегося при компримировании.
- Перед тем как получить азот, из сжиженного воздуха удаляют воду и углекислоту, которые становятся твердыми и выпадают в осадок.
- После снижения давления смесь начинает кипеть, а ее температура падает до -196 °C. Происходит последовательное испарение азота, кислорода и благородных газов.
Криогенное получение азота в промышленности оправдано при значительном расходе, а также при высоких требованиях к его составу. Чистота конечного продукта достигает 99,9999%. Энергоемкое и габаритное оборудование отличается высокой сложностью, требует профессиональной подготовки обслуживающего и технологического персонала.






























