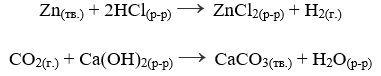Необратимые реакции
Необратимые реакции, напротив, происходят только в одном направлении и не могут быть обратимыми. В необратимых реакциях реагенты превращаются в продукты, и эти продукты не могут превратиться обратно в реагенты.
Пример необратимой реакции:
2H2 (г) + O2 (г) → 2H2O (г)
В этой реакции водород и кислород реагируют, чтобы образовать воду. Это необратимая реакция, потому что вода не может разлагаться на водород и кислород без внешнего воздействия.
Еще одним примером необратимой химической реакции является горение, когда кислород реагирует с органическими веществами, такими как углерод и водород, образуя оксиды, воду и углекислый газ.
Формула горения метана (CH4) выглядит следующим образом:
CH4 + 2O2 → CO2 + 2H2O
Эта реакция является необратимой, так как продукты (CO2 и H2O) не могут быть превращены обратно в метан и кислород при изменении условий реакции.
Другим примером необратимой реакции является гидролиз карбоната кальция (CaCO3), который происходит в водной среде и приводит к образованию гидрокарбоната кальция (Ca(HCO3)2):
CaCO3 + H2O + CO2 → Ca(HCO3)2
Эта реакция является необратимой, так как гидрокарбонат кальция не может быть превращен обратно в карбонат кальция при изменении условий реакции.
В обоих последних примерах реакции происходят в одном направлении и не могут быть обращены обратно в исходные реагенты.
Классификация химических реакций на основании их признаков.
|
в результате таких реакций из двух или более исходных веществ образуется только один продукт, например: С + O2 = CO2 4NO2 + O2 + 2H2O = 4HNO3 |
|
|
в таких реакциях из одного вещества образуется два или больше других веществ: 2KMnO4 = K2MnO4 + MnO2 + O2 CaCO3 = CaO + CO2 |
|
замещенияВсе реакции, в результате которых из простого и сложного веществ образуется другое простое и другое сложное вещества. Например: Zn + CuSO4 = ZnSO4 + Cu В органической химии, под реакциями замещения подразумевают также такие реакции, в результате которых происходит замена атома водорода или заместителя прикрепленного к углеродному скелету молекулы, на другой заместитель. Подробнее — в таблице ниже посвященной классификации реакций в органической химии. |
|
обменаРеакциями обмена называют такие реакции, в результате которых вещества меняются своими составными частями. Например: 2NaOH + CuCl2 = 2NaCl + Cu(OH)2 Частный случай реакции обмена между кислотой и основанием носит также название реакции нейтрализации: NaOH + HCl = NaCl + H2O многие реакции органической химии, в которых вещества меняются своими составными частями относят к реакциям замещения. Подробнее — в таблице ниже посвященной классификации реакций в органической химии. |
|
обратимыетакие реакции обладают способностью протекать как в прямом, так и обратном направлении. Реакции, про которые обязательно нужно знать, что они обратимые: |
|
необратимыеТакие реакции протекают только в прямом направлении. Если речь идет о реакциях между электролитами, то необратимой реакция является в том случае, если образуется осадок, газ или малодиссоциирующее вещество. Например: Na2CO3 + 2HCl = 2NaCl + H2O + CO2 В качестве малодиссоциирующих веществ в реакциях ионного обмена могут образоваться вода, слабые кислоты, гидроксид аммония. |
|
экзотермическиеВ результате таких реакций выделяется энергия в виде теплоты. Обозначают такие реакции, добавляя «+Q» к уравнению реакции, например: |
|
эндотермическиеПри протекании таких реакций поглощается тепло. Для обозначения таких реакций пишут «-Q» в уравнении реакции. Практически все реакции разложения являются эндотермическими: Исключения: реакции разложения HI и NO являются экзотермическими. |
|
гомогенныеГомогенными реакциями называют такие реакции, реагенты в которых находятся в одной фазе. Примерами таких реакций могут быть многие реакции протекающие в растворах, реакции между газообразными веществами: NaOH (р-р) + HCl(р-р) = NaCl + H2O 2CO + O2 = 2CO2 В гомогенных реакциях не наблюдаются границы раздела между реагентами |
|
гетерогенныегетерогенными реакциями называют такие реакции, в которых реагирующие вещества находятся в разных фазах. Примерами таких реакций являются, взаимодействие цинка с раствором соляной кислоты, взаимодействие углекислого газа с известковой водой, и т.д.:
|
|
4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.

Необратимые реакции — это реакции, которые протекают только в одном направлении (вперед →):
То есть, если реакция A + B = C + D является необратимой, это означает, что обратная реакция C + D = A + B не происходит.
Обратимые реакции — это реакции, которые протекают как в прямом, так и в обратном направлении (⇄):
Это означает, что если, например, реакция A + B = C + D является обратимой, то это означает, что одновременно протекают и реакция A + B → C + D (прямая), и реакция C + D → A + B (обратная).
Поскольку происходят как прямые, так и обратные реакции, реактивами (исходными веществами) в обратных реакциях могут быть как вещества в левой части уравнения, так и вещества в правой части уравнения. То же самое относится и к продуктам.
Однако обычно предполагается, что реактивами в данном уравнении обратной реакции являются вещества в левой части уравнения, а продуктами — вещества в правой части, т.е:
В любой обратимой реакции возможно, чтобы скорости прямой и обратной реакций были равны. Такое состояние называется состоянием равновесия.
В равновесном состоянии концентрация как реактантов, так и продуктов постоянна. Концентрации продуктов и реактивов в равновесном состоянии называются равновесными концентрациями.
Смещение химического равновесия под действием различных факторов
Равновесие системы может быть нарушено внешним воздействием на систему, например, изменением температуры, давления или концентрации сырья или продуктов. Однако после устранения этого внешнего воздействия система через некоторое время возвращается в новое состояние равновесия. Этот переход системы из одного равновесного состояния в другое равновесное состояние называется сдвигом равновесия.
Чтобы определить, как смещается химическое равновесие при определенном типе воздействия, полезно применить принцип Ле Шателье:
Если на равновесную систему воздействуют извне, то направление смещения химического равновесия совпадает с направлением этой реакции, тем самым ослабляя эффект оказываемого влияния.
Влияние температуры на состояние равновесия
При изменении температуры равновесие любой химической реакции смещается. Это происходит потому, что каждая реакция имеет тепловой эффект. Однако тепловые эффекты прямой и обратной реакций всегда прямо противоположны. То есть, если прямая реакция экзотермична и имеет тепловой эффект, равный +Q, то обратная реакция всегда эндотермична и имеет тепловой эффект, равны й-Q.
Таким образом, если повысить температуру равновесной системы, то, согласно принципу Ле Шателье, равновесие смещается в сторону той реакции, температура которой понижается, то есть в сторону эндотермической реакции. Если снизить температуру равновесной системы, то равновесие смещается в сторону той реакции, которая приводит к повышению температуры, т.е. экзотермической реакции.
Например, рассмотрим следующую обратимую реакцию и укажем, куда смещается равновесие при понижении температуры:
Как видно из приведенного выше уравнения, прямая реакция является экзотермической, т.е. выделяет тепло. Поэтому обратная реакция является эндотермической, т.е. реакцией, поглощающей тепло. Согласитесь, температура снижается, и равновесие смещается вправо, т.е. в сторону прямой реакции.
Влияние концентрации на химическое равновесие
Увеличение концентрации реагента в соответствии с принципом Ле Шателье должно привести к смещению равновесия в направлении реакции, потребляющей реагент, т.е. в направлении прямой реакции.
И наоборот, если концентрация реагентов уменьшается, равновесие смещается в направлении реакции, в которой образуются реагенты, то есть в направлении обратной реакции (←).
Изменение концентрации продуктов реакции происходит аналогичным образом. Если концентрация продуктов увеличивается, равновесие смещается в сторону реакции, которая приводит к потреблению продуктов, т.е. обратной реакции (←). Если, с другой стороны, концентрация продуктов уменьшается, равновесие смещается в направлении прямой реакции (→), так что концентрация продуктов увеличивается.
Влияние давления на химическое равновесие
В отличие от температуры и концентрации, изменение давления не влияет на равновесное состояние реакции. Чтобы химическое равновесие было смещено изменением давления, суммы коэффициентов перед газами в левой и правой частях уравнения должны быть разными.
Константа равновесия
Обозначим равновесные концентрации веществ , , , . Тогда так как = , k1 • α • β = k2 • γ • δ, откуда
где α, β, γ, δ — показатели степеней, равные коэффициентам в обратимой реакции; Кравн — константа химического равновесия.
Полученное выражение количественно описывает состояние равновесия и представляет собой математическое выражение закона действующих масс для равновесных систем.
При неизменной температуре константа равновесия — величина постоянная для данной обратимой реакции. Она показывает соотношение между концентрациями продуктов реакции (числитель) и исходных веществ (знаменатель), которое устанавливается при равновесии.
Константы равновесия рассчитывают из опытных данных, определяя равновесные концентрации исходных веществ и продуктов реакции при определенной температуре.
Значение константы равновесия характеризует выход продуктов реакции, полноту ее протекания. Если получают К » 1, это означает, что при равновесии γ • δ » α • β, т. е. концентрации продуктов реакции преобладают над концентрациями исходных веществ, а выход продуктов реакции большой.
При Кравн « 1 соответственно выход продуктов реакции мал. Например, для реакции гидролиза этилового эфира уксусной кислоты
константа равновесия:
при 20 °C имеет значение 0,28 (то есть меньше 1).
Это означает, что значительная часть эфира не гидролизовалась.
В случае гетерогенных реакций в выражение константы равновесия входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Например, для реакции
Константы равновесия выражается так:
Значение константы равновесия зависит от природы реагирующих веществ и температуры.
От присутствия катализатора константа не зависит, поскольку он изменяет энергию активации и прямой, и обратной реакции на одну и ту же величину. Катализатор может лишь ускорить наступление равновесия, не влияя на значение константы равновесия.
Состояние равновесия сохраняется сколь угодно долго при неизменных внешних условиях: температуре, концентрации исходных веществ, давлении (если в реакции участвуют или образуются газы).
Изменяя эти условия, можно перевести систему из одного равновесного состояния в другое, отвечающее новым условиям. Такой переход называют смещением или сдвигом равновесия.
Рассмотрим разные способы смещения равновесия на примере реакции взаимодействия азота и водорода с образованием аммиака:
Влияние изменения температуры
При повышении температуры скорости всех реакций (экзо- и эндотермических) увеличиваются. Причем повышение температуры больше сказывается на скорости тех реакций, которые имеют большую энергию активации, а значит, эндотермических.
Таким образом, скорость обратной реакции (эндотермической) увеличивается сильнее, чем скорость прямой. Равновесие сместится в сторону процесса, сопровождающегося поглощением энергии.
Направление смещения равновесия можно предсказать, пользуясь принципом Ле Шателье:
Если на систему, находящуюся в равновесии, оказывается внешнее воздействие (изменяется концентрация, давление, температура), то равновесие смещается в ту сторону, которая ослабляет данное воздействие.
Таким образом:
• при увеличении концентрации реагирующих веществ химическое равновесие системы смещается в сторону образования продуктов реакции;
• при увеличении концентрации продуктов реакции химическое равновесие системы смещается в сторону образования исходных веществ;
• при увеличении давления химическое равновесие системы смещается в сторону той реакции, при которой объем образующихся газообразных веществ меньше;
• при повышении температуры химическое равновесие системы смещается в сторону эндотермической реакции;
• при понижении температуры — в сторону экзотермического процесса.
Принцип Ле Шателье применим не только к химическим реакциям, но и ко многим другим процессам: к испарению, конденсации, плавлению, кристаллизации и др. При производстве важнейших химических продуктов принцип Ле Шателье и расчеты, вытекающие из закона действующих масс, дают возможность находить такие условия для проведения химических процессов, которые обеспечивают максимальный выход желаемого вещества.
Ионные реакции в растворах
Ионные реакции – реакции в растворах электролитов, при которых не происходит изменения зарядов ионов, входящих в соединения.
Ионные реакции могут быть обратимыми и необратимыми:
1. обратимые реакции ионного обмена протекают с участием сильных электролитов:
например,
![]()
Это означает, что реакция практически не происходит, и если выпарить раствор досуха, то твердый остаток будет представлять собой смесь четырех солей. Преимущественное выделение при упаривании той или иной соли определяется ее растворимостью.
2. необратимые реакции ионного обмена протекают в сторону образования:
а) осадков (малорастворимых веществ):
например,
В насыщенном растворе малорастворимого сильного электролита устанавливается равновесие между осадком (твердой фазой) электролита и ионами электролита в растворе, в рассматриваемом примере это равновесие:
Константа равновесия этого процесса имеет вид:
При постоянной температуре
Для реакции в общем виде
Таким образом, произведение концентраций ионов в насыщенном растворе малорастворимого сильного электролита при данной температуре есть величина постоянная (табличная), называемая произведением растворимости.
Произведение растворимости позволяет регулировать процессы образования и растворения труднорастворимых веществ. Например, для
§ если
§ если
Дата добавления: 2016-02-09 ; просмотров: 1748 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Применение химического равновесия
Современные химические технологии часто связаны с необходимостью моделировать смещение равновесия в обратимых реакциях. Это позволяет оптимизировать процессы производства, например, получение аммиака:
Если в процессе синтеза сложного вещества увеличивается содержание молекул азота и водорода, это оказывает положительное влияние (увеличивает выход продукта реакции). При этом в ходе реакции выделяется теплота, поэтому понижение температуры обуславливает увеличение концентрации аммиака. Объем начальных реагентов больше, чем получаемого продукта (число молей газообразных веществ больше в левой части уравнения). Увеличение давления позволит увеличить выход аммиака.
При наращивании темпов производства сотрудники промышленных предприятий заинтересованы определить оптимальное соотношение параметров: давления, температуры, концентрации активных веществ. Можно также прибегнуть к увеличению площади соприкосновения реагентов. Так, для твердых гетерогенных (неоднородных) систем характерно повышение скорости реакции при увеличении площади поверхности контакта веществ, например, в результате измельчения.