Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
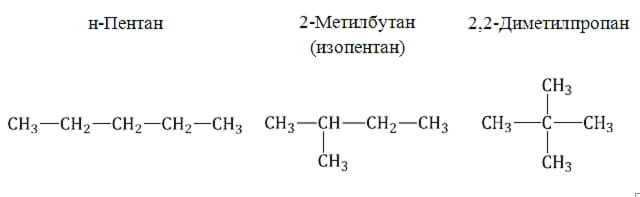
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):

2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:

2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):


Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия)
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла.
Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Классификация органических соединений
Классификацию органических веществ определяют строение углеродной цепи (углеродного скелета) и наличие и особенности строения функциональных групп.
| Углеродный скелет – это последовательность соединенных между собой атомов углерода в органической молекуле. |
| Функциональная группа – это атом или группа атомов, которая определяет принадлежность молекулы к определенному классу органических веществ и химические свойства, соответствующие данному классу веществ. |
|
Классификация органических веществ по составу |
||
| Углеводороды | Кислородсодержащие вещества | Азотсодержащие вещества |
| Состоят из атомов углерода и водорода | Содержат также атомы кислорода | Содержат также атомы азота |
Валентность атома углерода
Под валентностью понимают, что это то количество связей, которые образовывает химический элемент. Один из основополагающих законов органической химии гласит, что в органических соединениях у атома углерода валентность постоянна и равняется 4 (т. к. в возбужденном состоянии у него 4 неспаренных электрона)
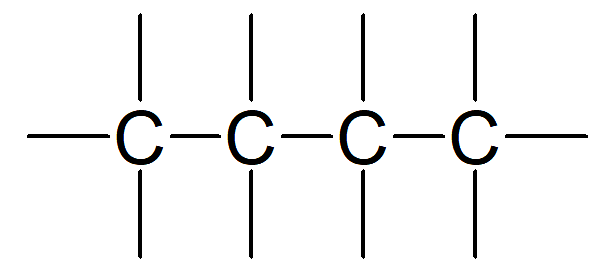
Углеродные связи в органических веществах
В ходе протекания химической реакции органические вещества претерпевают изменения, поскольку происходит разрушение старых и образование новых связей. Глядя на молекулу, опытный химик-органик скажет, какая именно связь разрушится, под действием каких факторов и предскажет, какие продукты и какого строения получатся в конце превращения.
Гомологи
Из того же положения теории строения органических соединений Бутлерова следует, что вещества, имеющие похожее (сходное) строение молекул, должны иметь и похожие (сходные) свойства. Органические соединения, которые имеют похожее строение, а, значит, и похожие свойства, образуют гомологические ряды.
Например, углеводороды, в составе молекул которых есть только одна двойная связь, образуют гомологический ряд алкенов:
и так далее.
Углеводороды, в молекулах которых имеются только простые связи, образуют гомологический ряд алканов:
и так далее.
Члены любого гомологического ряда называются ГОМОЛОГАМИ.
Гомологи — это органические соединения, которые похожи по химическому строению и, значит, по свойствам. Гомологи отличаются друг от друга по составу на группу СН2 или (СН2)n.
Убедимся в этом на примере гомологического ряда алкенов:
Задание 17.3. Сравните состав членов гомологического ряда алканов (гомологов алканов) и убедитесь, что по составу они отличаются на группу СН2 или (СН2)n.
Выводы
Гомологи похожи по строению, а значит, и по свойствам; гомологи отличаются по составу на группу СН2. Группа СН2 называется гомологической разностью.
Теория строения органических веществ
Теория строения органических веществ сформировалась во второй половине XIX века. К этому времени были получены и исследованы многие органические соединения, установлен их качественный и количественный состав, описаны свойства.
Так, в конце XVIII — начале XIX века были выделены важнейшие углеводороды (органические вещества, состоящие только из углерода и водорода) и установлены их молекулярные формулы. Однако оказалось, что знания молекулярных формул, отражающих только состав вещества, явно недостаточно для понимания строения и свойств органических соединений. Приведём примеры некоторых противоречий, заводивших в тупик учёных первой половины XIX века.
Пример 1. Молекулярные формулы простейших углеводородов метана, этана и пропана — CH4, C2H6и C3H8соответственно.
К середине XIX века Э. Франкландом уже было предложено понятие валентности атомов, а А. Кекуле предположил, что атомы углерода четырёхвалентны. Если исходить из того, что водород одновалентен, то, рассматривая приведённые молекулярные формулы, можно ошибочно предположить, что только в метане CH4 углерод имеет валентность, равную четырём, валентность углерода в этане C2H6 должна равняться трём, а в пропане C3H8 углерод должен иметь дробную валентность.
 Пример 2. Одинаковую формулу C4H10имеют два различных вещества.
Пример 2. Одинаковую формулу C4H10имеют два различных вещества.
Температура кипения одного из этих веществ равна –0,5 °С, тогда как температура кипения второго более чем на 11 °С ниже и составляет –12 °С. Накопление подобных необъяснимых на тот момент фактов стало предпосылкой создания новой теории — теории строения органических соединений. Её основные положения в середине XIX века сформулировал А. М. Бутлеров.
К тому времени было известно, что молекулы состоят из атомов, но учёные ещё не придавали значения тому, как атомы располагаются в молекуле, и считали, что познать это невозможно. А. М. Бутлеров высказал предположение о том, что атомы в молекуле соединены в определённой последовательности, которую можно установить химическими методами и отразить в структурной формуле.
Сформулируем важнейшие положения теории строения органических соединений А. М. Бутлерова:
- Атомы, входящие в состав органических соединений, связаны друг с другом в определённой последовательности в соответствии с их валентностью.
- Свойства вещества зависят не только от того, атомы каких элементов и в каком количестве входят в состав молекул, но и от последовательности соединения атомов в молекулах.
Данная теория открыла путь к широкому распространению структурных формул для отображения строения органических веществ.
Используем положения теории А. М. Бутлерова для объяснения противоречий, описанных в примерах 1 и 2.
Сначала объясним строение молекул простейших углеводородов. Учитывая, что валентность углерода равна четырём, а валентность водорода — единице, структурная формула метана CH4следующая:
В молекуле этана C2H6все атомы углерода и водорода входят в состав одной частицы. Для этого два атома углерода должны образовать друг с другом химическую связь. Оставшиеся три единицы валентности каждый атом углерода использует для соединения с тремя атомами водорода. Тогда структурная формула этана:
Аналогичные рассуждения для пропана C3H8приводят к структурной формуле:
Как видно, во всех этих углеводородах углерод четырёхвалентен. Рассмотрим теперь, какое влияние на свойства веществ оказывает последовательность связывания атомов в молекуле на примере соединения с молекулярной формулой C4H10. Можно составить две цепи из четырёх атомов углерода: линейную и разветвлённую:
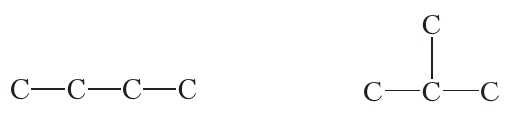
Таким образом, молекулярную формулу C4H10 имеют два вещества:
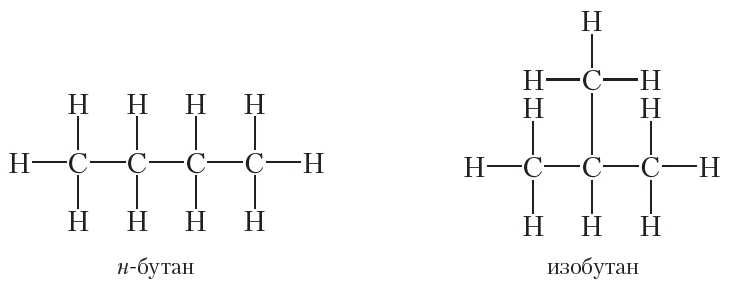
Так как н-бутан (н — сокращённое от нормальный) и изобутан являются разными веществами, они должны иметь различные свойства. Действительно, температура кипения н-бутана равна –0,5 °С, тогда как температура кипения изобутана равна –12 °С. Таким образом, теория Бутлерова позволила объяснить, почему соединения, имеющие совершенно одинаковый состав, могут обладать различными свойствами. Вещества, молекулы которых имеют одинаковый качественный и количественный состав, но разное строение, называются изомерами.
Дальнейшее развитие науки только дополняло и совершенствовало теорию А. М. Бутлерова, показало её справедливость не только для органических, но и для неорганических соединений. Структурные формулы, впервые предложенные А. М. Бутлеровым, и сегодня с успехом используются для отображения строения молекул как органических, так и неорганических соединений.
Значение теории состоит в систематизации огромного фактического материала, что дало возможность целенаправленного синтеза новых веществ с заданными свойствами.
Агрегатные состояния простых органических веществ
Органические вещества выпускаются в мире в промышленных масштабах. Поступающие на завод вещества, называются сырьем, а выпускаемые из него – целевым продуктом.
В зависимости от того, какое сырье использует предприятие, его доставка может осуществляться разными способами: трубопроводами или с помощью транспортировочных машин.
Основная сырьевая база для производства сложных веществ и материалов – углеводороды, которые впоследствии претерпевают химические изменения и превращаются в другие вещества, которые используют для создания более сложных продуктов, например лекарств, пластмасс, клеев, пленок и др.
Самыми востребованными веществами из углеводородов являются этен и этин (вещества, в которых содержится только 2 атома углерода, которые соединены двойной и тройной связью).
Газообразные углеводороды
Этен и этин представляют собой газообразные органические вещества и для их транспортировки используют специальные газовые трубопроводы и баллоны, где они хранятся в сжиженном виде.
Изготавливают из них полимеры, например, полиэтиленовые пакеты или реактивы для более узкого органического синтеза.
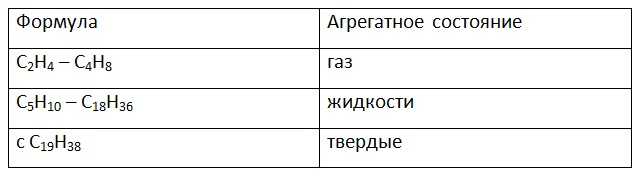
Обычно, вещества в газообразном состоянии имеют в составе молекул от 1 до 4 углеродных атомов.
Жидкие органические вещества класса углеводородов
Состав таких веществ обычно подразумевает наличие атомов в своем составе больше, чем в молекулах газообразных веществ. Из-за утяжеления молекул их подвижность падает и в них могут образовываться межмолекулярные связи.
Для их транспортировки используют бочки, трубопроводы и цистерны. В составе молекул в жидком состоянии содержится от 5 до 18 атомов углерода.
Твердые углеводороды
Если увеличивать количество углеродных атомов в структуре органической молекулы, то углеводороды будут представлять из себя твердые, но пластичные материалы. Примером такого органического вещества является воск или парафин, в состав которых входят тяжелые углеводороды.
Для их транспортировки используют грузовые машины, а складывают их в коробки или ящики.
Кратко примеры агрегатных состояний органических веществ представлены в таблице 2.
Таблица 2. – Агрегатные состояния органических веществ
Гибридизация
Гибридизация – объединение орбиталей атома, которые имеют разные формы (s и p). Объединенные орбитали получаются с одинаковой формой, размером и энергией (рисунок 4).
Объединяться могут не только s и p орбитали, но и d и f, однако в атоме углерода таких нет, поэтому на уроках органической химии их объединения рассматриваться не будут.
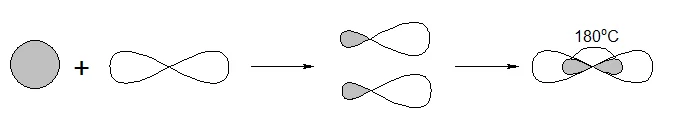 Рисунок 4. – Образование гибридных орбиталей из s и p
Рисунок 4. – Образование гибридных орбиталей из s и p
Основные типы гибридизации атома углерода в молекулах
Наглядно разберемся, как можно представить объединение орбиталей. Предположим, что у нас есть синяя краска и белая краска, и мы в палитре их объединяем, т.е. смешиваем. При «смешении» мы получили краску нового голубого цвета. Тоже самое происходит и с орбиталями в атоме, только смешиваются не цвета, а формы и энергии.
Объединение орбиталей в углероде может проходить по 3 путям:
- он может «смешать» все 4 орбитали (3 p и 1 s) и получить 4 гибридных орбитали. Тип гибридизации: sp3.
- он может «смешать» 3 орбитали (1 s и 2 p) и получить 3 гибридных орбитали. В этом случае одна P орбиталь не будет гибридной и сохранит свои геометрические формы. При соединении p-орбиталей в молекуле появляется π-связь (т.е. появляется кратность). Тип гибридизации: sp2.
- он может «смешать» 2 орбитали (1 s и 1 p) и получить 2 гибридных орбитали. В этом случае остаются 2 p-орбитали, сохранившие свои формы. При их перекрывании образуются 2 π-связи. Тип гибридизации: sp.
Зная, как гибридизация влияет на взаимное расположение атомов друг относительно друга, можно изобразить схематически строение молекулы любого органического вещества.
Рассмотрим молекулу, в которой есть участки с одинарными, двойными и тройными связями, и изобразим ее в пространстве (см.рис. 5).
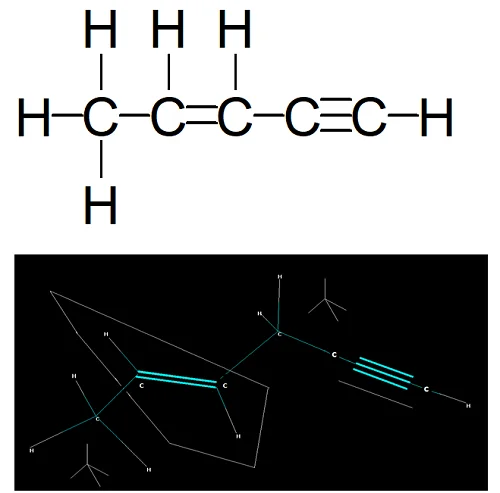
Рисунок 5. – Пространственное расположение молекулы, в которой есть одинарные и кратные связи.
У атомов, находящихся в sp-гибридизации, связи лежат на одной линии, в sp3-гибридизаци — по форме тетраэдра, в sp2-гибридизации – лежат на плоскости, что изображено на рис. 5.
Стоит отметить, что представленные типы гибридизаций атомов в молекулах, характерны не только органическим соединением, но многим неорганическим веществам.
Важнейшие представители органических соединений
Соединения, у которых небольшое количество атомов в молекуле, простые структурные формулы и из которых путем последовательных химических реакций можно получить все остальные химические вещества, называют фундаментальными.
Самые простые органические соединения
Вещества, состоящие только из 2 видов атомов, называются простейшими. В органической химии соединения, образованные только атомами углерода и водорода, называют простыми. На их основе можно создавать другие классы органических веществ, путем замены водорода на другие группы, называемые функциональными.
Общая классификация органических молекул
Классификация органических соединений начинается с анализа углеродного скелета молекулы. Он может быть замкнутый в «кольцо» или в виде цепочки (по-научному: циклический и ациклический).
Циклические соединения делятся на те, в которых цикл состоит только из атомов углерода (тогда такие называются карбоциклические) и на те, у которых помимо него есть еще другой элемент (тогда такие соединения называют гетероциклические).
Карбоциклические подразделяются по наличию кратных связей в цикле на ароматические (когда цикл содержит кратные связи) и алициклические (в которых кратных связей не содержится).
Ациклические делятся на соединения, которые состоят только из одинарных связей (такие соединения называются предельными) и те, которые содержат в структуре углеродного скелета кратные связи (такие соединения называют непредельными).
Углеводороды — это циклические и ациклические соединения, состоящие только из углерода и водорода. Из простых органических соединений образуются более сложные, путем замены атома водорода в углеродном скелете на функциональную группу.
Классификация углеводородов Углеводороды можно разделить на разные группы по аналогичным признакам классификации органических соединений.По видам связей углеводороды делятся на те, в которых:
- все атомы соединены одинарными связями. Их называют алканами и насыщенными углеводородами, потому что в них содержится максимально возможное количество связей. Все остальные вещества называют непредельными.
- есть 2 атома углерода, соединенные двойной связью. Их называют алкенами.
- есть 1 тройная связь между атомами углерода. Их называют алкинами.
- есть 2 двойные связи. Их называют диенами.
Каждый класс соединений вступает в химические реакции по определенным механизмам и будет рассмотрен более подробно на последующих уроках.
Общие сведения о валентности углерода
ОПРЕДЕЛЕНИЕ
Углерод – шестой по счету элемент Периодической таблицы. Относится к неметаллам. Расположен во втором периоде IV группы A подгруппы.
В свободном состоянии углерод известен в виде алмаза, кристаллизующегося в кубической и гексагональной (лонсдейлит) системе, и графита, принадлежащего к гексагональной системе. Такие формы углерода, как древесный уголь, кокс или сажа имеют неупорядоченную структуру. Также есть аллотропные модификации, полученные синтетическим путем – это карбин и поликумулен – разновидности углерода, построенные из линейных цепных полимеров типа …-C≡ C-C≡C-… или .. = C = C = C = C = ….
Известны также аллотропные модификации углерода, имеющие следующие названия: графен, фуллерен, нанотрубки, нановолокна, астрален, стеклоуглерож, колоссальные нанотрубки; аморфный углерод, углеродные нанопочки и углеродная нанопена.
В природе углерод находится в виде двух стабильных изотопов 12С (98,892%) и 13С (1,108%).
Общее строение атома углерода
Углерод в ПСХЭ находится во 2 периоде главной подгруппы 4 группы с порядковым номером 6. Обозначается символом С и масса – 12 а.е.м.
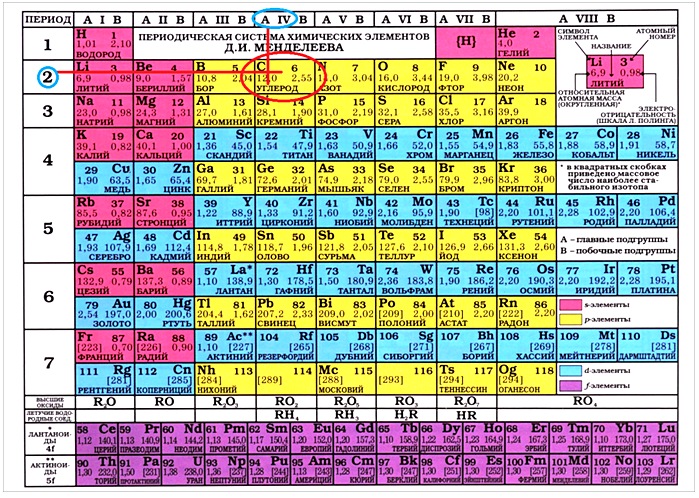
Зная эти основные цифры, можно подробно разобрать схему строения углеродного атома. У него 2 составляющие: ядро,заряженное положительно и электроны, которые заряжены отрицательно и находятся в пространстве вокруг него.
Порядковый номер элемента численно равен заряду ядра и числу в нем электронов. Число нейтронов вычисляется по формуле:
А = Nп + Nн,
где А – массовое число, Nп – число протонов, Nн – число нейтронов.
Получаем, что количество нейтронов равно: Nн = А – Nп = 12-6 = 6
На рисунке 1 видно наглядно, какое строение у атома углерода.
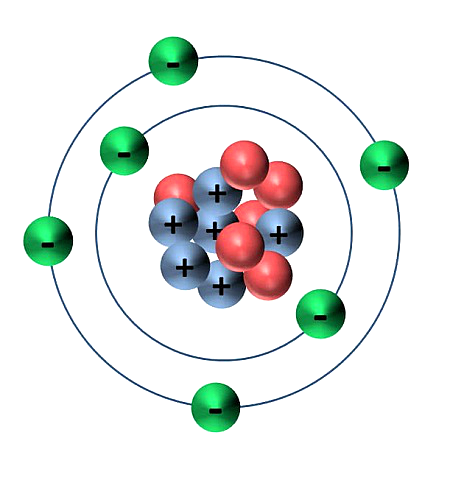 Рисунок 1. – Строение атома углерода
Рисунок 1. – Строение атома углерода
Подробное электронное строение атома углерода
Ядро элемента не несет интереса в описаниях химических реакций, так как связи образуются при объединении электронных оболочек. При их связывании и перераспределении электронной плотности образуются новые молекулы.
Электронная структура
По расположению в ПСХЭ наглядно видно, что углерод имеет:
- 2 уровня, отличающихся по энергии;
- 4 штуки электронов на внешнем энергетическом уровне.
На первом энергетическом уровне в s-орбитали у всех элементов находятся 2 электрона. (см.рис.1). Второй уровень, он же и внешний для углерода, состоит из одной s и трех p орбиталей, и расположение электронов в них зависит от того, в каком состоянии находится атом.
Основное и возбужденное состояние
В основном состоянии на s и p орбиталях расположено по 2 электрона.
Если электрону, находящемуся на s-орбитали, добавить некоторое количество энергии из вне, то он может «перескочить» в пустую p-орбиталь с большей энергией.
Возбужденное состояние атома углерода представляет собой такую конфигурацию, при которой на внешнем уроне каждая его орбиталь имеет по 1 электрону.
Переход из основного состояния в возбужденное называется активацией.
На рисунке 2 схематически изображен процесс активации.
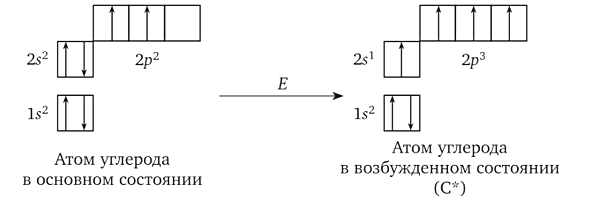 Рисунок 2. – Переход электрона с 2s-орбитали на 2p-орбиталь под действием дополнительной энергии
Рисунок 2. – Переход электрона с 2s-орбитали на 2p-орбиталь под действием дополнительной энергии
Атом углерода образует связи с другими элементами и между собой благодаря объединению неспаренных электронов. Если сравним конфигурацию атома углерода в возбужденном состоянии с конфигурацией в основном, можно сделать вывод о том, что в возбужденном состоянии он способен образовать больше ковалентных связей. В этом состоянии ему нужно быстро находить в окружении себя другие элементы и химически с ними связываться, так как при отсутствии дополнительной энергетической подпитки электрон снова перейдет с p-орбитали на s.
Знание о возбужденном состоянии атома углерода позволило в дальнейшем описывать механизмы реакций, рисовать структурные формулы веществ и описывать расположение молекул в пространстве.Полученные знания в 1861 году обобщил А.М. Бутлеров.





























