Содержание
В каломельный электрод или каломель — вторичный электрод, который позволяет определять потенциалы полуэлементов благодаря реакции, которая происходит между ртутью и хлоридом ртути (I), Hg2Cl2, ранее известная как каломель. Оба реагента, Hg и Hg2Cl2, приобретают или теряют электроны в зависимости от среды, в которую погружен электрод.
Обычно обозначаемый сокращенно EC, этот электрод заменяет стандартный водородный электрод (SHE) во многих измерениях, поскольку его легче сконструировать и менее рискованно обращаться (несмотря на наличие ртути). Внутри он содержит раствор KCl в качестве электролитической среды для потока электронов.

Каломельный электрод может иметь разные варианты в зависимости от его размера или, что более важно, от концентрации KCl. Когда раствор KCl насыщен, мы говорим о насыщенном каломель-электро (ESC)
ESC легче приготовить, чем EC, но он более чувствителен к изменениям температуры.
Использование этого электрода позволило определить потенциалы полуэлементов для бесчисленных окислительно-восстановительных реакций. Аналогичным образом, это повторяющееся устройство в потенциометрических определениях, которые стремятся узнать количество анализируемого вещества как функцию измеренного потенциала E-клеток.
Указатель статей
- 1 Операция
- 1.1 Катодный
- 1.2 Анодный
- 1.3 Общая реакция
- 2 Характеристики каломельного электрода
- 2.1 Представление полуячейки
- 2.2 Стороны
- 2.3 Преимущества
- 2.4 Недостатки
- 3 использования
- 4 ссылки
Определение
Электрод сравнения — электрохимические полуэлементы электрохимического круга, применяемые при измерении электродных потенциалов как их эталон. Потенциал электрода сравнения имеет постоянное значение и не зависит от изменения концентрации раствора электролита электрохимического круга. Необходимость использования данного понятия обусловлена невозможностью измерения абсолютных потенциалов отдельных электродов и создание электрода с величиной потенциала, равна нулю.
Электроды сравнения должны удовлетворять следующим требованиям:
- иметь высокую воспроизводимость потенциала
- малую зависимость потенциала от температуры
- постоянство всех характеристик в течение длительного времени
- быть простыми в изготовлении и эксплуатации
Наиболее полно такие требования удовлетворяют лишь несколько электродов:
- водородный
- каломельный
- оксиднортутный
- хингидронный
- галогеносеребряный
Конструкция — каломельный электрод
|
Каломельный электрод. |
Конструкции каломельного электрода в зависимости от условий его применения могут быть самыми разнообразными, но в принципе повторяют описанную.
Существует много конструкций каломельных электродов, ряд из них выпускается промышленностью.
Во всех конструкциях каломельных электродов сравнения контакт их с исследуемым раствором осуществляется через раствор хлористого калия. Концентрированный ( в данном случае насыщенный) раствор хлористого калия, применяемый в качестве соединительного моста между исследуемым раствором и каломельным электродом, дает очень незначительный ( 1 — 3 мв) диффузионный потенциал ( возникающий всегда в месте соприкосновения двух разных растворов), так как подвижность ионов К и СГ — почти одинакова.
Известно большое число конструкций каломельных электродов, характеризующихся различными технологическими и эксплуатационными параметрами. Во всех конструкциях каломельных вспомогательных электродов контакт их с контролируемым раствором осуществляется через раствор хлористого калия, образующий электролитический контакт. В месте соприкосновения контролируемого раствора с электролитическим контактом устанавливают пористые перегородки /, через которые раствор хлористого калия постепенно просачивается в контролируемый раствор.
Известно большое количество конструкций каломельных электродов, характеризующихся различными технологическими и эксплуатационными параметрами.
|
Хингидронный электрод. |
На рис. 38 представлена конструкция каломельного электрода. На дно сосуда помещают чистую ртуть 2 для контакта, покрывают ее пастой 3, приготовленной растиранием чистой ртути с каломелью. Платиновая проволока 1 служит для подвода и отвода электронов.
В зависимости от условий применения конструкции каломельных электродов может существенно изменяться, о чем будет сказано ниже. Каломельный электрод наиболее распространенный, но не единственный тип сравнительного электрода. Во многих случаях его применение невозможно, например когда недопустимо попадание в измеряемый раствор даже небольших количеств хлористого калия или соединений ртути, при длительных измерениях при температуре выше 70 С, когда потенциал каломельного электрода становится неустойчивым. Тогда предпочитают использовать другие сравнительные электроды, чаще всего хлоро-серебряный.
|
Зависимость потенциала каломельного электрода от температуры. |
В зависимости от условий применения, конструкция каломельного электрода может существенно изменяться. В основном это касается защитного чехла. Например, если температура в аналитической ячейке повышена, защитную пробирку удлиняют с тем расчетом, чтобы собственно электрод находился вне аналитической ячейки при нормальной температуре. В аналитическую ячейку вводят лишь трубку, наполненную раствором хлорида калия. При повышенном давлении в аналитической ячейке каломельный электрод снабжают напорным бачком с раствором хлорида калия; бачок помещают на определенной высоте. Если этого оказывается недостаточно — к бачку подводят давление соответствующей величины.
Потенциалы каломельных электродов измерены относительно нормального водородного электрода. Известно большое число конструкций каломельных электродов, характеризующихся различными технологическими и эксплуатационными параметрами.
Наряду с медносульфатными электродами применяют и другие, например кадмие-сульфатные. На рис. 129 приведена конструкция каломельного электрода. Для измерений на свинцовых кабелях используют уксусно-свинцовый и цинковый электроды, отличающиеся в основном относительным потенциалом, материалом электрода и природой раствора.
В подавляющем большинстве случаев измерения рН в качестве электрода сравнения применяется каломельный электрод. В зависимости от условий измерения изменяется лишь конструкция применяемых каломельных электродов. Однако в некоторых случаях применение каломельного электрода недопустимо. Например, при контроле рН пищевых продуктов без отбора пробы применение каломельного электрода может привести к попаданию в продукт соединений ртути. Тогда в качестве электрода сравнения может быть использован хлоросеребряный электрод с раствором соляной кислоты в электролитическом ключе.
Он состоит из стеклянной трубки, на дне которой имеется ртуть. Поверх ртути налит насыщенный раствор хлористого калия, содержащий осадок каломеля, причем уровень хлористого калия должен быть всегда выше уровня испытуемого раствора. Такая конструкция каломельного электрода позволяет получить довольно стабильный потенциал.
В чем разница между каломелем и стеклянным электродом?
Каломельный электрод и стеклянный электрод — это два типа электродов, используемых для измерения pH системы. Однако ключевое различие между каломельным и стеклянным электродом заключается в том, что каломельный электрод является типом электрода сравнения, тогда как стеклянный электрод не является электродом сравнения. Кроме того, каломельный электрод используется для измерения pH, циклической вольтамперометрии, водной электрохимии и т. Д., А стеклянный электрод в основном используется для измерения pH.
Ниже приводится краткое описание различий между каломельным и стеклянным электродом.

Стороны
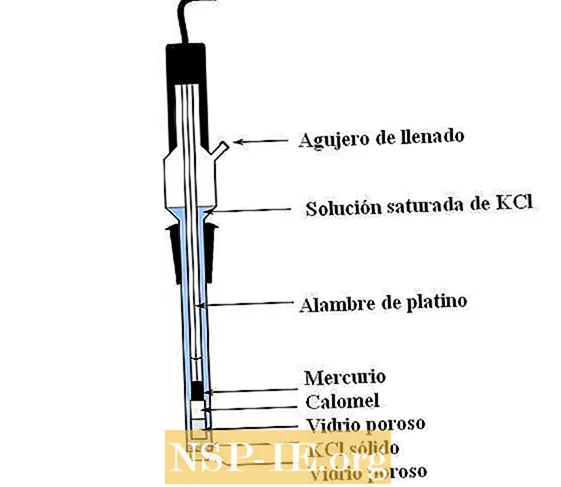
На изображении выше показаны основные части обычного каломельного электрода. Он изготовлен из стекла и состоит из двух емкостей: внешнего, который находится в электрохимическом контакте с измеряемой средой и содержит раствор KCl; и внутренний, где находится смесь Hg-Hg.2Cl2.
Внутри каломельный электрод содержит жидкую ртуть, на которую прилипает паста из ртути.2Cl2 смоченный ртутью. Это самая активная фаза электрода. Пористое стекло обеспечивает только вход или выход ионов Cl.–, но не из кристаллов Hg2Cl2 или из капель ртути.
Платиновая проволока, по которой протекают электроны, погружена в ртуть и отвечает за соединение электрода с вольтметром и рассматриваемой внешней цепью.
Раствор KCl, содержащий нерастворенные кристаллы соли, выливают через заливное отверстие. Между тем, в нижней части электрода есть очень маленькое отверстие в пористом стекле, которое непосредственно контактирует со средой измерения. Назначение пористого стекла — обеспечить контакт без нежелательного обмена веществами, загрязняющими электрод или образец.
Насыщенный каломельный электрод
Анод — насыщенный каломельный электрод.
Анод — насыщенный каломельный электрод; катод — в виде висящей капли ртути, нанесенной электролитически на платиновую проволоку диаметром 0 2 мм.
|
Колонка для адсорбции и десорбции ДОХ.| Подпрограмма 200 мг / л ДОХ при чувствительности 1 / 20. |
Анодом служил насыщенный каломельный электрод.
Анодом служит насыщенный каломельный электрод.
|
Схема установки для снятия электрокапиллярной кривой. |
Наиболее приемлем насыщенный каломельный электрод. Для упрощения работы на установке в качестве, электрода сравнения можно использовать ртутный. Для этого достаточно налить чистую ртуть в кювету электрометра 7 и вывести от нее через стеклянную трубку изолированный контакт.
|
Каломельные электроды сравнения.| Сочетание стандартного и индикаторного электродов. 1 — 4 — — СМ. 5, 6-провода. 7-пробка. 8-широкая пробирка. |
Наиболее распространен насыщенный каломельный электрод
Он удобен потому, что не нужно принимать мер предосторожности против испарения воды.
. Потенциал системы относительно стандартного насыщенного каломельного электрода ( НКЭ) равен 0 4 В
Энзимный электрод состоит из следующих элементов: чувствительное устройство ( Pt-электрод), пленка, где происходит ферментативная реакция ( глкжозооксидаза, фиксированная в пористом или гелевом слое) и диализная целлофановая мембрана. При измерении глюкозы в крови в последнюю необходимо добавлять буферный раствор ( 0 04 М раствор фосфата с рН 7 4, содержащий 0 026 М NaCl 0 004 М КС1) и хинон. При подаче на электрод напряжения 0 4 В получают ток, пропорциональный концентрации глюкозы. В параллельном опыте с электродом подобного типа, но без энзима измеряют холостой, или фоновый ток, значение которого вычитают из значений, полученных с энзимным электродом.
Потенциал системы относительно стандартного насыщенного каломельного электрода ( НКЭ) равен 0 4 В. Энзимный электрод состоит из следующих элементов: чувствительное устройство ( Pt-электрод), пленка, где происходит ферментативная реакция ( глкжозооксидаза, фиксированная в пористом или гелевом слое) и диализная целлофановая мембрана. При измерении глюкозы в крови в последнюю необходимо добавлять буферный раствор ( 0 04 М раствор фосфата с рН 7 4, содержащий 0 026 М NaCl 0 004 М КС1) и хинон. При подаче на электрод напряжения 0 4 В получают ток, пропорциональный концентрации глюкозы. В параллельном опыте с электродом подобного типа, но без энзима измеряют холостой, или фоновый ток, значение которого вычитают из значений, полученных с энзимным электродом.
Электродом сравнения являлся насыщенный каломельный электрод; к нему отнесены все потенциалы, приведенные в работе.
Электродом сравнения служил насыщенный каломельный электрод.
|
Изменение интенсивности сигналов ЭПР радикал-анионов 5-нитропиро-слизевой кислоты в зависимости от напряжения ( Е, отн. нас. к. э. |
В водных растворах насыщенный каломельный электрод можно использовать без особых предосторожностей, но в неводных растворах, несмотря на частые упоминания в литературе о применении такого электрода, по-видимому, его все же нельзя рекомендовать, так как он загрязняет раствор водой. Действительно, в методе ЭХГ точная установка потенциалов не имеет решающего значения, поэтому часто отказываются от применения электрода сравнения
Обыкновенно ЭХГ проводят при потенциалах, соответствующих площадке предельного тока первой одно-электронной полярографической волны, которые находят из данных предварительного полярографического эксперимента. Следует отметить, что для появления сигнала ЭПР при стационарном проведении ЭХГ не обязательно, чтобы на полярограмме в соответствующей среде имелась одноэлектронная волна; сигналы ЭПР могут быть зарегистрированы и в средах, где исходное вещество дает многоэлектронные полярографические волны, и при потенциалах, которые лежат за потенциалами последующих волн.
Электродом сравнения служил насыщенный каломельный электрод.


















![Потенциометрический метод анализа [1965 степин в.в., силаева е.в., курбатова в.и., ханова т.ф., барбаш т.л., поносов в.и. - анализ цветных металлов и сплавов]](http://mapisa-plitka.ru/wp-content/uploads/1/9/c/19cd0cac3a96f24292e236f95e67158e.jpeg)










