ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
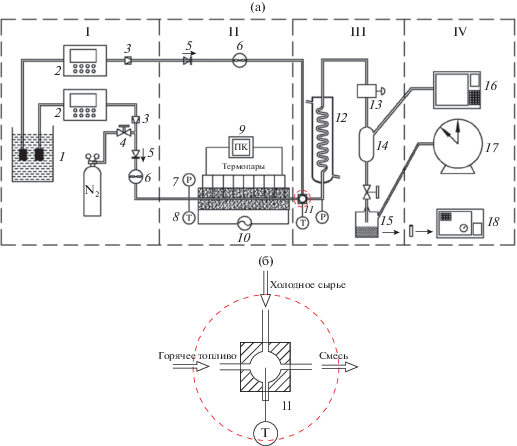
Экспериментальная установка. На а показана экспериментальная установка с онлайн отбором пробы. Устройство состоит
из 4 частей: системы подачи, реакционной зоны, системы охлаждения и системы отбора
и анализа пробы. В целях обеспечения отсутствия кислорода в системе путем полной продувки
экспериментальной установки в течение 5 мин перед каждым экспериментом использовался
азот.
Рис. 1.
Экспериментальный аппарат с онлайн отбором пробы (а). Принципиальная схема полости
смешения (б). I. Система подачи. II. Реакционная зона. III. Система охлаждения. IV.
Система отбора и анализапробы. 1 – топливный бак; 2 – поршневой насос; 3 – фильтр; 4 – игольчатый вентиль; 5 – обратный клапан; 6 – массовый расходомер; 7 – манометр; 8 – термопара; 9 – компьютер; 10 – сеть переменного тока; 11 – полость смешения; 12 – водяной холодильник; 13 – регулятор давления “до себя”; 14 – газожидкостный сепаратор; 15 – приемник жидких продуктов; 16 – газовый хроматограф; 17 – газовый расходомер; 18 – ГХ-МС.
В данной работе в качестве сырья был использован н-декан (TK = 618 K, PK = 2.11 МПа) []. В системе подачи топливо впрыскивалось в реактор в условиях сверхкритического давления
при помощи насоса с постоянным расходом (P500, Dalian Elite Analytical Instruments
Co. ltd.). Для контроля постоянной скорости потока в реальном времени использовался
массовый расходомер (CMF010M323, Emerson). Помимо того, была смонтирована дополнительная
линия с впрыском сырья для системы охлаждения.
Реакционная зона состоит из реактора, сделанного из нержавеющей стали марки GH3128,
с внутренним диаметром 2 мм и толщиной стенки 0.5 мм. Для подключения реактора к электрическому
нагревателю были использованы две медные клеммы. Сырье нагревалось переменным током
со стабилизированной мощностью и напряжением, калиброванным с помощью прибора для
калибровки мощности и тока (PW6001, HIOKI). Для определения давления в системе был
использован манометр (RoseMount-3051GP), а для контроля температуры крекируемого сырья
на выходе из реактора применялись термопары К-типа.
После реактора горячие продукты крекинга поступали в систему охлаждения. Как показано
на б, мы творчески добавили смесительную полость в систему охлаждения. Как правило, при
температуре ниже ~773 К реакции крекинга не протекают, поэтому крекируемое топливо
первоначально охлаждалось непосредственным смешением с топливом-хладагентом. Затем
был использован традиционный теплообменник с водой в качестве теплоносителя для дальнейшего
охлаждения крекируемого сырья до комнатной температуры. Давление в системе снижали
до атмосферного при прохождении топлива через регулятор давления “до себя”.
Для отбора и анализа пробы топлива использовался самодельный газожидкостной сепаратор.
Газовые продукты собирали и закалывали в газовый хроматограф (ГХ, Perkin-Elmer, модель
Clarus 680) для анализа химического состава. Через пробоотборный клапан производился
отбор жидких продуктов, а затем их взвешивание с помощью электрических весов с точностью
до 0.0001 г. Состав жидких продуктов анализировался с помощью газового хроматографа
с масс-спектрометрическим детектором (ГХ-МС, Perkin-Elmer, модель SQ8).
Расчет выхода газообразных продуктов и степени превращения сырья. Для традиционного автономного метода отбора выход газообразных продуктов может быть
рассчитан по формуле:
–mgml
При онлайн отборе необходимо вычесть количество топлива-хладагента, тогда количество
жидких продуктов реакции может быть определено как:
monlinemcml
В автономном методе степень превращения сырья может быть определена следующим образом:
yn-decaneнiнн
yiyn-decaneiннyi,GC-MSyn-decane,GC-MSiннqm1qm2
Как рассчитать теоретический выход продукта реакции, примеры задач
Алгоритм расчета теоретического выхода ηтеор приведен на примере решения следующей задачи:
При взаимодействии 9,84 г оксида железа (III) и 12 г монооксида углерода СО образовались железо и углекислый газ. Рассчитайте теоретический выход (в молях и граммах) железа.
1. Записать уравнение химической реакции:
2. Расставить коэффициенты так, чтобы в обеих частях уравнения количество атомов каждого элемента было одинаковым:
3. Вычислить молярные массы реагентов и целевого продукта (для взятого примера — Fe). Из таблицы Менделеева или справочника узнать атомные массы Ar всех составляющих элементов и посчитать молярные массы М 1 моля каждого исходного вещества и целевого продукта:
4. Найти количество вещества ν каждого реагента:
5. Для определения ключевого компонента — реагента, который расходуется быстрее остальных, следует определить продолжительность реакции и теоретический выход:
составляется соотношение числа молей одного реагента к числу молей другого:
Это говорит о том, что количество используемого для реакции CO в 7 раз больше, чем количество Fe2O3
сравниваются стехиометрические коэффициенты при реагентах, которые показывают, сколько молекул каждого вещества требуется для проведения реакции:
На одну молекулу Fe2O3 должно приходится 3 молекулы CO.
Можно сделать заключение, что CO взят в избытке и расчет следует вести по Fe2O3, который является ключевым компонентом.
6.
7. Масса продукта (Fe), соответствующая данному количеству вещества, будет равна:
На практике также важен расчет фактического выхода продукта η практ или массовой доли выхода продукта ω в %.
Три типа задач:
Понятие селективности и материального баланса
Например, этот критерий позволяет оценить, какое количество метана CH4 превратилось в угарный газ CO при конверсии водяным паром. Может быть выражена не только через количество вещества, но и через любые пропорциональные ему величины: массу, объем.
Для обеспечения максимального выхода целевого продукта недостаточно только высокой степени конверсии (значительное количество вещества может вступить в реакцию, но не участвовать в образовании целевого продукта) или хорошей селективности, выход продукта определяется совокупностью этих факторов.
Например, N0 моль исходного вещества А вступило в реакцию, из них прореагировало Nx моль со следующим распределением:
- на образование продукта B было израсходовано NB моль;
- на образование побочных продуктов C и D было израсходовано NC и ND моль вещества A.
Тогда селективность S реакции по целевому продукту B составит:
SB=NB / (NB+NC+ND) или SB=NB / Nx
Степень превращения реагента A для данного примера будет равна соотношению между числом моль прореагировавшего вещества A к общему числу моль, которые были затрачены на реакцию:
KA=Nx / N0
Выход продукта ηB в этом примере будет равен соотношению между числом моль реагента A, пошедшего на образование целевого продукта, к числу моль, которые были затрачены на реакцию:
ηB= NB / N0
Таким образом, между выходом продукта B, селективностью процесса относительно образования B и степенью превращения исходного реагента A существует взаимосвязь:
ηB= SB × KA.
Селективность подразделяют на:
- полную (интегральную) — соотношение между количеством полученного целевого продукта и всех продуктов процесса;
- мгновенную (дифференциальную) — соотношение между скоростью целевой реакции и скоростью расходования исходного реагента.
Селективность важна для катализаторов, чтобы избирательно увеличивать скорость целевой реакции при наличии нескольких побочных. Высокой селективностью отличаются ферменты (95 — 100%), для гетерогенных катализаторов этот показатель достигает 70%. Гомогенные занимают промежуточное значение.
Выход, степень превращения и селективность — величины безразмерные, учитываются при составлении материального баланса процесса.
Материальный баланс составляется с расчетом расхода реагентов и полученных продуктов на единицу основного продукта. Поскольку на производство вещества поступают в виде смесей, при составлении материального баланса учитывается масса всех компонентов отдельно для твердой, жидкой и газовой фаз. Для процессов, которые идут в несколько стадий, баланс составляется для каждой стадии отдельно.
Материальный баланс, как и выход продукта, может быть:
- теоретическим — определяют по результатам расчетов химиков-технологов на основании экспериментальных выработок;
- фактическим — получают в ходе производственного процесса. Всегда меньше теоретического из-за потерь.
Как увеличить выход продукта реакции, способы расчета, формулы
Фактический выход конкретного химического процесса можно увеличивать при регулировании следующих факторов:
- температура;
- давление;
- скорость перемешивания;
- присутствие катализатора;
- чистота исходных материалов;
- эффективность процесса извлечения продуктов;
- использование одного или нескольких реагентов в избытке и др.
Для каждой химической реакции, лежащей в основе промышленного производства, необходимо эффективно использовать ресурсы, максимально повысить выход целевого продукта, но при этом он должен быть надлежащего качества и в достаточном количестве. Для это обязательно рассчитывают выход продукта.
Расчет выхода продукта
Например, если процент выхода равен ω=80%, это означает, что количество полученного продукта составляет 80% от теоретически возможного.
Выход продукта реакции можно выразить также через коэффициент, обозначается буквой η (эта):
Вопрос № 2. Технологические показатели химических реакций: конверсия, выход селективность, производительность
Технологические показатели химических реакций: конверсия, выход селективность, производительность. Зависимость селективности от степени превращения для последовательных и параллельных реакций. Время контакта, объемная скорость и их взаимосвязь с количеством катализатора, длиной слоя.
Об эффективности осуществления любого пром-го процесса судят прежде всего по экономическим показателям, таким, как приведенные затраты, себестоимость продукции и т.д.
Для оценки эффективности отдельных этапов процесса необходимо помимо общих экономических показателей использовать такие критерии эффективности, которые более полно отражали бы хим. и физико-хим. сущность явлений, происходящих в отдельных апп. технологической схемы.
В кач-ве таких показателей принято прежде всего использовать степень превращения исходного реагента, выход продукта, селективность. Они с разных сторон характеризуют полноту использования возможностей осуществления конкретной хим. р-ции.
Степень превращения (конверсия)показывает на сколько полно в хим.- технологическом процессе используется исходное сырье.
Степень превращения- это отношение массы сырья, вступившего в р-ию за время t к исходной его массе:
ma-кол-во сырья, не вступившего в р-ию;
mc— кол-во сырья, поданного в р-ию.
Выход продукта.Степень превращения характеризует эффективность проведения процесса с точки зрения использования исходного сырья, но эта величина не всегда достаточно полно ее характеризует с точки зрения получения продукта р-ии. Поэтому вводят еще один критерий эффективности- выход продукта.
Выход продукта—это отношение реально полученного кол-ва продукта из использованного сырья к максимальному кол-ву, которое теоретически можно получить из того же сырья:
Селективность. Выход продукта характеризует полученный результат как долю от предельно возможного. Целесообразно оценить и реальную ситуацию, т.е. дать кол-ую оценку эффективности целевой реакции по сравнению с побочными взаимодействиями.
Критерием такой оценки явл. селективность.
Селективность-это отношение массы целевого продукта к общей массе в-в, полученных в данном процессе или к массе превращенного сырья за время t.
Выход продукта, степень превращения и селективность характеризуют глубину протекания хим. – технологического процесса, его полноту и направленность.
Производительность и интенсивность.Важным критерием эффективности работы отдельных апп., цехов или заводов в целом явл. производительность.
Производительность-это кол-во продукта полученного в единицу времени:
Для сравнения работы апп. различного устройства и размеров, в которых протекают одни и теже процессы, используют понятие интенсивность.
Интенсивностью – называют производительность, отнесенная к объему апп.V или к площади его сечения S.
Общая химическая технология, Кутепов А.М., Москва, 1975, стр. 18-27
Химическая технология, Соколов Р.С., Том 1, Москва, 2000, стр. 135-137






























