Теплота и температура
Перед тем как изучить закон Гесса и рассмотреть следствия, вытекающие из него, вспомним, что такое термохимия, чем она занимается и какие ставит перед собой задачи. Рассмотрим понятие теплообмена, теплоты и энергии в химическом смысле.
Выделение тепла происходит сплошь и рядом. Активность движения молекул является единственной и основной причиной всех термодинамических явлений. Процесс диффузии, эффузии, явление теплопроводности – все это легко объясняется молекулярной теорией строения вещества.
Численная характеристика, которая описывает тепловой вид энергии, называется температурой. Нагревать тело теоретически можно сколь угодно долго, оно будет менять свое агрегатное состояние. Смене состояния всегда сопутствует тепловой эффект химической реакции.
Важно! Тело во время нагрева и охлаждения меняет свое агрегатное состояние, только если остальные параметры (давление и объем) сохраняются. Практически, меняя объем и уровень давления, при нагреве можно избежать перехода.. Охлаждать тело (т.е
отдавать его тепло) бесконечно долго не выйдет, так как существует некий предел, когда все молекулы полностью замирают, и из тела выходит все тепло. Такой предел носит название абсолютного нуля. Температурой абсолютного нуля является минус 273 градуса по шкале Цельсия
Охлаждать тело (т.е. отдавать его тепло) бесконечно долго не выйдет, так как существует некий предел, когда все молекулы полностью замирают, и из тела выходит все тепло. Такой предел носит название абсолютного нуля. Температурой абсолютного нуля является минус 273 градуса по шкале Цельсия.
Говоря о Цельсии, следует отметить, что существует три наиболее популярные шкалы измерения температур:
- шкала Цельсия;
- шкала Фаренгейта;
- шкала Кельвина.
Шкала Цельсия привязана к поведению воды при нормальных условиях (атмосферном давлении). Согласно этой шкале вода замерзает при температуре 0 градусов по Цельсию, а кипит при температуре 100 градусов. Эта шкала стала очень удобной в бытовой и повседневной жизни: комнатная температура около 25 0С, температура тела 36,6 0С. Шкала Фаренгейта привязана к раствору воды, соли и нашатырного спирта. Температура замерзания этого раствора составляет 0 0F, что приблизительно равно -17,8 0С.
Шкала Кельвина носит наибольший физический смысл. Нулем по этой шкале принято считать абсолютный ноль, т.е. -273 0С. Эта шкала лишена отрицательных температур и имеет прямую линейную связь с остальными. Вода кипит при 373 0К, замерзает при 273 0К.
Измерение температуры
Базовые понятия из термохимии
Та энергия, которая доступна в потенциальном и теоретическом виде для преобразования тепла в изобарном процессе, называется энтальпией. Также нужно помнить, что изобарным принято называть процесс, во время которого показатели давления не меняются. Для обозначения постоянства в термохимии используется приставка «изо». К примеру: изотермический и изохорный процессы указывают на постоянную температуру.
Для обучения студентов специалисты всегда рассматривают элементарную ситуацию. Если есть обычный баллон, в котором под постоянным прессом находится газ, то энтальпией обозначают итоговую сумму потенциальной энергии пресса и собственной энергии газа. Именно энтальпией принято отображать ту энергию, которая начнётся выделяться сразу после того, как из ёмкости начнёт выходить топливо.

Не менее интересный пример: человек сидит под грушей, а над его головой висит спелый фрукт. Теоретически он может упасть в любой момент. Если человек продолжит сидеть под деревом, то рано или поздно груша оторвётся. Потенциальная энергия фрукта и есть энтальпия, которую принято обозначать формулой DH0/f. Если речь касается энтальпии продуктов химической реакции, тогда в силу вступают некоторые поправки — DH0/f прод.
Для обозначения реагентов специалисты вывели дополнительную формулу DH0/f реагенты. Чтобы указать точное количество задействованного вещества, следует задействовать букву n. Это своеобразный коэффициент, который нужно обязательно переводить в химическую реакцию перед основным компонентом. К примеру, Fe +2 HCL = FeCL2 + H₂. Стоит отметить, что число n — это цифра «2», которая указана перед соляной кислотой.
Первое и второе следствие

Классический тепловой эффект представляет собой некую сумму всех энтальпий продуктов этой реакции. В категорию исключений вошло только итоговое количество всех энтальпий исходных веществ. Это следствие довольно просто изобразить в виде формулы: DHx.р. = n прод. * DH0/f прод. — n исх. * DH0/f реагентов. Именно это следствие закона позволяет максимально быстро и правильно рассчитать тепловой эффект реакции.
Второе следствие используется только по отношению к соединениям органического типа. Если в тепловых эффектах химических реакций применяются натуральные вещества, то итоговый результат представляет собой сумму энергии сгорания первичного компонента. Это утверждение не касается энергии, которая образуется в результате сгорания продуктов реакции. В строгом соответствии со вторым законом специалисты разработали универсальную формулу для стандартных условий: ΔН реакц. = ΣvкΔН обр, к — ΣHVHΔH обр, н.
Способы решения элементарных задач
Чтобы неподготовленный человек мог самостоятельно разобраться во всех тонкостях основного закона термохимии, необходимо изучить несколько наглядных примеров
Если обратить внимание на всё нюансы, то в итоге можно научиться искать тепловые эффекты химических реакций.. Стандартная формула окисления этилового спирта выглядит так: C2H5OH = 3O2 + 2CO2 + 3H2O
Уравнение для поиска решения задачи состоит из трёх этапов:
Стандартная формула окисления этилового спирта выглядит так: C2H5OH = 3O2 + 2CO2 + 3H2O. Уравнение для поиска решения задачи состоит из трёх этапов:
- DH crop = c +3 DH0/f(H2O) — DH0/f(C2H5OH);
- DH0/f(C2H5OH) = 2DH0/f(CO 2) + 3DH0/f(H2O) — DH0/f(C2H5OH);
- DH0/f(C2H5OH) = 2 (-393, 5) + 3 (241,
 — (-277, 7) = 1234, 7 кДж / моль.
— (-277, 7) = 1234, 7 кДж / моль.

Второй пример задачи более простой. Основная задача — вычислить тепловой эффект дегидратации этилового спирта. Установленные показатели:
- DH crop(C2H4) = -1422.
- DH crop(H2O) = 0.
- DH crop(C2H5OH) = -1234.
Все эти значения были получены из предыдущего примера. Реакция дегидратации выглядит следующим образом: C2H5OH = C2H4 + H2O. Для решения задачи следует задействовать второе следствие закона Гесса: DH x.p. = DH crop(C 2 H 5 OH) — DH crop(C2H4) — DH crop(H2O) = 188 кДж/моль. Из всех приведённых примеров даже новичку несложно догадаться, что основной закон термохимии на практике является главным, так как именно на нём и всех его следствиях основана вся современная экспериментальная химия.
Все перечисленные правила и утверждения носят базовый характер во всех научных отраслях. Закон Гесса ежедневно успешно применяется в микробиологии, биохимии, генетике и даже фармацевтике
Это напрямую связано с тем, что во всех перечисленных науках очень важно уметь правильно рассчитывать тепловой эффект реакции. Всю недостающую информацию можно изучить в научной литературе, где подробно описаны все формулы, а также их значение.
Показатели температуры и тепла
Используемое специалистами математическое выражение закона Гесса имеет несколько важных нюансов. Предварительно нагретые предметы и жидкости не могут бесконечно отдавать накопленное тепло. Всегда существует некий предел, когда молекулы полностью замирают. Такое явление носит название абсолютного нуля. Для этой ситуации свойственна температура -273 градуса по шкале Цельсия. Этот нюанс должны учитывать те, кто решил ознакомиться с законом русского химика Гесса. Например, непосредственное экспериментальное определение теплового эффекта реакции окисления углерода в оксид углерода (II) ΔH2 (реакция 2) осуществить практически невозможно (при сгорании образуется смесь оксидов).

Специалисты выделяют три самых популярных шкалы измерения температур:
- Фаренгейт.
- Цельсий.
- Кельвин.

Самой распространённой является шкала Цельсия, но она напрямую зависит от характеристик воды при стабильном атмосферном давлении. Рассматриваемая жидкость замерзает при температуре 0°. Кипеть вода начинает после достижения отметки +100 °C. Шкала Цельсия получила огромный спрос в повседневной жизни человека. Комфортная комнатная температура находится в пределах +25 °C, оптимальная температура тела человека составляет +36,6 градуса. Шкала Фаренгейта сильно зависит от характеристик раствора, состоящего из воды, нашатырного спирта и соли. Эта жидкая смесь замерзает при 0°F, что по другим показателям может соответствовать -18 °C.
Самый большой физический смысл носит шкала Кельвина. Абсолютным нулём считается температура — 273 °C. Эта шкала лишена отрицательных температур и имеет прямую линейную связь с остальными показателями. Замерзает вода при отметке 273°К, а для закипания нужно 373°К.
https://youtube.com/watch?v=qT0BmBHq_iY
Ссылки
- Уиттен, Дэвис, Пек и Стэнли. (2008). Химия. (8-е изд.). CENGAGE Обучение.
- Википедия. (2020). Закон Гесса. Получено с: en.wikipedia.org
- Коэн Шелли. (18 мая 2020 г.). Закон Гесса. Химия LibreTexts. Получено с: chem.libretexts.org
- Кларк Джим. (2010). Закон Гесса и расчеты изменения энтальпии. Получено с: chemguide.co.uk
- Хельменстин, Энн Мари, доктор философии (11 февраля 2020 г.). Определение закона Гесса. Получено с: thinkco.com
- Фуист Лаура. (2020). Закон Гесса: определение, формула и примеры. Исследование. Получено с: study.com
- QuimiTube. (2014). Теория 14 Термохимия: Расчет энтальпии реакции по закону Гесса. Получено с: quimitube.com
4.4. Закон Гесса window.top.document.title = «4.4. Закон Гесса»;
Пользуясь табличными значениями и , можно рассчитать энтальпии различных химических процессов и фазовых превращений. Основанием для таких расчетов является закон Гесса, сформулированный петербургским профессором Г. И. Гессом (1841 г.): «Тепловой эффект (энтальпия) процесса зависит только от начального и конечного состояния и не зависит от пути перехода его из одного состояния в другое».
Анализ закона Гесса позволяет сформулировать следующие следствия:
-
Энтальпия реакции равна разности сумм энтальпий образования конечных и начальных участников реакций с учетом их стехиометрических коэффициентов.
ΔH = ΣΔHобр.конечн – ΣΔHобр.нач -
Энтальпия реакции равна разности сумм энтальпий сгорания начальных и конечных реагентов с учетом их стехиометрических коэффициентов.
ΔH = ΣΔHсгор.нач – ΣΔHсгор.конечн -
Энтальпия реакции равна разности сумм энергий связей Eсв исходных и конечных реагентов с учетом их стехиометрических коэффициентов.
В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах (ΣEисх) и выделяется при образованиии продуктов реакции (–ΣEпрод). Отсюда
ΔH° = ΣEисх – ΣEпрод Следовательно, экзотермический эффект реакции свидетельствует о том, что образуются соединения с более прочными связями, чем исходные. В случае эндотермической реакции, наоборот, прочнее исходные вещества.
При определении энтальпии реакции по энергиям связей уравнение реакции пишут с помощью структурных формул для удобства определения числа и характера связей.
-
Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком.
ΔHобр = –ΔHразл -
Энтальпия гидратации равна разности энтальпий растворения безводной соли и кристаллогидрата
Из вышесказанного видно, что закон Гесса позволяет обращаться с термохимическими уравнениями как с алгебраическими, т. е. складывать и вычитать их, если термодинамические функции относятся к одинаковым условиям.
Например, диоксид углерода можно получить прямым синтезом из простых веществ (I) или в две стадии через промежуточный продукт (II):
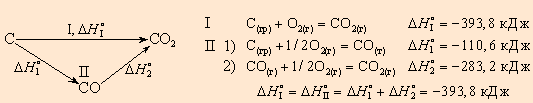 |
| Рисунок 4.1Энтальпия первого пути равна сумме энтальпий отдельных стадий второго пути |
Эти термохимические реакции можно представить в виде энтальпийных диаграмм. Естественно, за начало следует принять стандартные состояния простых веществ, энтальпии которых равны нулю. Образование сложных веществ (CO и CO2) сопровождается понижением энтальпии системы.
 |
| Рисунок 4.2Энтальпийная диаграмма C + O2 |
Закон Гесса как основной закон термохимии и примеры расчетов с его использованием
Закон Гесса констатирует:Рассмотрим классический пример.
При экзотермическом взаимодействии углерода (графита) и кислорода образуется углекислый газ. У этого процесса есть два возможных пути: напрямую или через промежуточную стадию, идущую с образованием угарного газа (оксида углерода (II)):
При прямом процессе, идущем непосредственно с образованием углекислого газа, выделяется 393,5 кДж энергии:
Если процесс взаимодействия графита с кислородом идет в две стадии, то каждая из них также сопровождается выделением энергии:
Просуммируем эти два уравнения:
Получаем то же, что и в первом случае (то есть при прямом взаимодействии графита с кислородом): выделяется 393,5 кДж энергии.
Прежде, чем рассмотреть примеры расчетов, в которых используется формула закона Гесса, необходимо сделать некоторые уточнения:
1) результаты термохимических расчетов (и измерений) всегда относят к одному молю вещества, которое образуется в ходе реакции;
2) теплота образования – это количество теплоты, выделяющееся при реакции простых веществ с образованием 1 моля продукта;
3) теплоты образования простых веществ принимают за ноль;
4) если прямой процесс является экзотермическим, то обратный будет эндотермическим, и наоборот.
Пример 1.
Запишем термохимические уравнения реакций, о которых идет речь:
Представим уравнение (2) так, чтобы СО стал конечным продуктом реакции, а не исходным веществом. Для этого запишем уравнение в обратном виде. Теплота сгорания по знаку в таком случае станет противоположной:
Для получения ответа на вопрос задачи (по закону Гесса) просуммируем уравнения (1) и (2):
Таким образом, при сгорании углерода с образованием угарного газа выделяется 110,5 кДж энергии.
Пример 2.
В реакции, для которой требуется вычислить теплоту:
- участвуют 1 молекула этилена и 6 молекул фтора;
- образуются 2 молекулы тетрафторуглерода и 4 молекулы фтороводорода.
— в первой из данных по условию реакций все коэффициенты и теплоту реакции умножим на 2, чтобы получить 4 молекулы фтороводорода;
— во второй реакции также все коэффициенты и теплоту реакции умножим на 2, чтобы получить 2 молекулы тетрафторуглерода;
— уравнение третьей реакции запишем в обратном виде, чтобы этилен стал исходным веществом, а не продуктом реакции;
— изменим знак теплоты третьей реакции на противоположный, так как ее уравнение записываем в обратном виде.
Просуммируем все уравнения:
Таким образом, теплота реакции этилена с фтором ΔН= -2486,3 кДж.
Альтернативный метод
Есть способ добиться того же результата проще и проще. Об этом упоминалось в предыдущем разделе.
2SO3(г) → 2SO2(г) + O2(грамм)
Чтобы определить ΔHrxn для этой реакции, мы должны рассчитать ΔHºf (реагенты) и ΔHºf (продукты). ΔHºf (SO3) составляет -395,6 кДж / моль, а ΔHºf (SO2) составляет -296,8 кДж / моль. ΔHºf (O2) равно 0, поскольку элементарный кислород существует в виде молекулы O2 а не как свободные атомы кислорода.
Итак, имеем:
ΔHrxn = ΔHºf (продукты) — ΔHºf (реагенты)
= [ΔHºf (SO2) + ΔHºf (O2)] — ΔHºf (SO3)
= ΔHºf (SO2) — ΔHºf (SO3)
Однако мы должны умножить обе энтальпии образования на 2, чтобы уравнять стехиометрические коэффициенты по химическому уравнению:
ΔHrxn = 2ΔHºf (SO2) — 2ΔHºf (SO3)
И при расчетах имеем:
ΔHrxn = 2 (-296,8 кДж / моль) — 2 (-395,6 кДж / моль)
= 197,6 кДж / моль
Фактически, именно так обычно предпочитают решать все упражнения, в которых применяется закон Гесса.
Энтальпия реакции от энтальпий образования
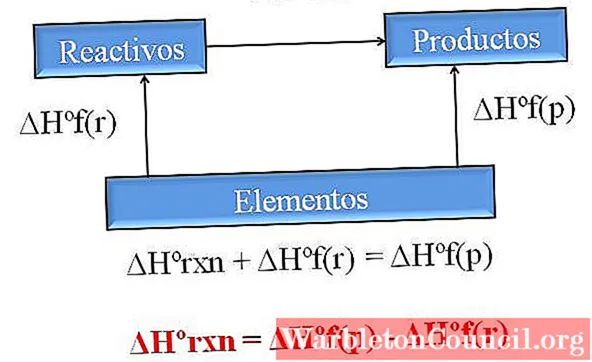
Одним из наиболее ценных следствий закона Гесса является то, что он позволяет определять энтальпии любой химической реакции, принимая энтальпии образования всех задействованных соединений (реагентов и продуктов).
Изображение выше иллюстрирует этот момент. Под энтальпией образования понимается тепло, связанное с образованием соединения из его элементов. Указанная энтальпия представляет собой максимально возможную разницу между реагентами и продуктами без необходимости консультироваться с другими химическими реакциями; по крайней мере, не связанные с раздельным образованием соединений.
Как вы читаете диаграмму на этот раз? Один из приемов состоит в том, чтобы всегда складывать энтальпии, когда движется в направлении стрелки, и вычитать их, когда стрелка находится в противоположном направлении. Таким образом, ΔHºrxn, стандартная энтальпия реакции, добавляется к ΔHºf (реагенты), стандартная энтальпия образования реагентов, а ΔHºf (продукты), из них вычитается стандартная энтальпия образования продукта.
Расчет энтальпии реакции
Причина, по которой верно то, что:
ΔH = ΔH1 + ΔH2 + ΔH3
Это потому, что энтальпия, или изменение энтальпии, зависит от состояния. Это означает, что их значения не изменяются количеством промежуточных стадий, стадий или реакций. Например, ΔH останется неизменным даже при наличии ΔH10 рассматривать в алгебраической сумме.
Энтальпии можно было представить как вершины гор. Как бы ни были направлены к ним ступени, высота, отделяющая их от уровня моря, никогда не изменится. И именно высоты складываются или вычитаются, чтобы определить неизвестную высоту ближайшей горы.
Вернемся к предыдущей диаграмме: A — гора, D — другая гора и так далее. Разница в высоте между вершинами A и D самая большая. Если сложить высоты между A-B, B-C и C-D, получится высота A-D. Это то, что происходит с энтальпиями соответствующих химических реакций.
Суммы реакции
Диаграммы может быть очень трудно интерпретировать, особенно когда необходимо учитывать множество реакций. По этой причине используется сумма реакций. Этот метод значительно облегчает расчет энтальпий и ускоряет понимание закона Гесса.
Предположим, например, что мы хотим определить ΔHºrxn следующей реакции:
А + В + С → АВС
И у нас также есть две другие реакции:
A + B → AB (ΔHº1)
AB + C → ABC (ΔHº2)
Интересно, что A + B + C находятся на левой стороне (реагенты), а ABC — на правой стороне (продукты). Затем мы просто добавляем две последние реакции:
А + В → АВ
AB + C → ABC
А + АВ + С → АВС + АВ
Поскольку AB находится с обеих сторон, он исключен. Итак, у нас есть:
А + В + С → АВС
ΔHºrxn = ΔHº1 + ΔHº2
При добавлении реакций использование какой-либо диаграммы опускается.
Что такое термохимия?
Нагревание и охлаждение – несимметричные физические понятия, физическим смыслом обладает только понятие нагревание (повышение температуры). Процесс охлаждения возможен только при передаче тепловой энергии. Тело, которое отдает тепло, становится холоднее. В результате этого принято говорить, что оно охлаждается. Для сравнения можно использовать понятие «свет» и «тьма». Если «свет» является физическим явлением, возможным при существовании соответствующих элементарных частиц, то тьма – это всего лишь отсутствие света.
После того как термопередача завершена, температуры обоих тел сравниваются и наступает равновесие. Во время термообмена проистекает трата тепловой энергии, которая называется теплотой. Эта величина измерима в Джоулях (или калориях) и представляет собой энергию той же природы, что и в механике (представленная в виде работы сил).
Существует устойчивый миф (особенно он часто показан в кино), что в космосе все тела быстро замерзают и покрываются снегом и инеем. Однако следует помнить, что космос представляет собой почти что вакуум. Поэтому отдавать тепло тела не могут в космосе, так как отсутствует вещество, проводящее тепло. Говоря простыми словами, тепловой энергии некуда деться. По этой причине уже более 5 миллиардов лет горячая магма земли сохраняет свою температуру почти постоянной.
Если химия начинает изучать физические законы строения материи, акцентируя особое внимание на разновидности процессов, изучить которые можно только при помощи химической теории, то такой раздел химии носит название физическая химия. Область физ
химии, которая исследует структуру вещества в явлениях с сопровождением выделения или обмена теплоты, с превращениями внутренней энергии растворов в тепло, носит название химическая термодинамика
Область физ. химии, которая исследует структуру вещества в явлениях с сопровождением выделения или обмена теплоты, с превращениями внутренней энергии растворов в тепло, носит название химическая термодинамика.
Если данный раздел естествознания будет акцентировать особое внимание на исследовании явлений с выделением тепла, которые протекают во время процессов, то его принято называть термохимия. Термохимия представляет собой область знания, изучающую преобразования термического типа; процессы, в которых выделяются и поглощаются тепловые виды энергий
Закон Гесса
Этот закон заслуженно считают главным законом термохимии. Формулировка закона Гесса закона выглядит так:
Численные значения тепловых эффектов, во время протекания химических реакций не зависят от того каким образом протекают сами процессы.
Основной закон термохимии гласит, что если есть множество различных способов провести одну и ту же химическую реакцию, то тепловые процессы будут одинаковы во всех случаях.
Естественно, это будет так, если условия всех реакций одинаковы – давление, температура равны. Это научное утверждение, несмотря на интуитивную очевидность, далеко не так просто понять. Давайте разберем его формулировку.
Если процесс проходит в абсолютно идентичных условиях, т.е. либо давление, либо температура неизменны, то независимо от того во сколько стадий будет проходить реакция, тепловая энергия (вырабатываемая или затраченная) будет неизменна.
Важно! Один из самых простых примеров закона: усваивание сахаров в человеческом теле. Переработка глюкозного раствора в нашем теле происходит по очень сложным органическим реакциям, разбитым на множество органических этапов
Однако энергия, выделяемая в течение всего растворения, так или иначе, такая же, как энергия простого сгорания глюкозы.
Постараемся выразить закон Гесса в математической форме. Для этого представим себе, некоторую реакцию между веществами А1, А2, А3 и т.д. Это могут любые вещества –вода, углекислый газ, кислоты, щелочи и т.д. Сама реакция также может быть любой – окисление, восстановление, дегидратация и пр. Наша задача при помощи ряда веществ А1, А2 и т.д. получить вещества В1, В2 и т.д. Например, реакция окисления, в которой окислителем является ион водорода:
.
В этой реакции исходные вещества: железо и соляная кислота являются примерами наших гипотетических А1, А2, а конечными веществами являются хлорид железа и водород – пример В1, В2.
Естественно, это не единственная реакция при помощи которой можно получить и водород. Например, можно, получить при помощи меди:
.
Таким образом, можно утверждать, что есть множество различных способов из веществ А1, А2 получать вещества В1, В2. При этом во время реакций будет выделятся определенное количество теплоты, которое мы будем обозначать .
Например, если реакция проходит простым традиционным путем в один шаг, то выделяется теплота. Если можно провести реакцию другим путем (тоже в один шаг), то получается уже другое количество теплоты ; если, к примеру, реакция проходит в два этапа, то сначала выделяется теплота , а потом , но в сумме получается .
Учитывая эти обозначения, в математическом виде закон Гесса представить довольно легко. Если в результате реакции выделяется энергия но разными путями выделялись тепловые эффекты , , , при этом эта же реакция может протекать еще двумя путями с выделением эффектов , , то формула закона Гесса будет выглядеть так:
.
Благодаря этому термохимическому утверждению есть возможность численно извлекать и рассчитывать энергию термодинамических явлений, которую экспериментальными способами получать крайне сложно и энергозатратно. Иными словами, зная численной значение внутренней энергии в уже проверенной реакции, является возможным вычислить тепловой эффект в более сложном процессе.





























