Математическое представление
Физики обычно используют единообразные условные обозначения для представления величин в I законе термодинамики. Они выглядят так:

- U 1 (или Ui) — начальная внутренняя энергия в начале процесса.
- U 2 (или Uf) — конечная внутренняя энергия в конце процесса.
- Дельта U = U 2 — U 1 — изменение внутренней энергии (используется в тех случаях, когда особенности начальной и конечной внутренних энергий не имеют значения).
- Q — тепло, передаваемое в (Q > 0) или из (Q <0) системы.
- W — работа, выполненная системой (W > 0) или в системе (W <0).
Анализ термодинамического процесса в классе физики обычно включает анализ ситуации, когда одна из этих величин либо равна 0, либо контролируется разумным образом. Например, в адиабатном процессе теплообмен (Q) равен 0, в изохорном работа (W) тоже имеет значение 0.
Определение и понятие
Термодинамика — это раздел физики, который занимается взаимоотношениями между теплом и другими формами энергии. В частности, он описывает, как тепловая энергия преобразуется в другие виды и влияет на материю. Основные принципы термодинамики содержат три закона:

- I закон термодинамики гласит, что тепло является формой энергии, поэтому термодинамические процессы подчиняются принципу ее сохранения. Это означает, что тепловая энергия не может быть создана или уничтожена, однако ее можно перенести из одного места в другое и преобразовать в другие виды. Изменение энергии неизолированной термодинамической системы равно разности между количеством теплоты, переданной системе, и работой, совершенной системой над внешними силами.
- Второе начало термодинамики гласит, что энтропия любой замкнутой изолированной системы всегда увеличивается. Изолированные системы самопроизвольно эволюционируют в направлении теплового равновесия — состояния максимальной энтропии (мера упорядоченности) системы. Энтропия Вселенной (предельно изолированная система) только увеличивается и никогда не уменьшается. Кратко описать этот простой закон можно так: комната, если её не убирать, со временем неизменно становится более грязной и беспорядочной, даже если постоянно поддерживать ее в чистоте. Когда происходит уборка в помещении, его изолированная система уменьшается, но усилия по очистке приводят к ее увеличению за пределами комнаты, которое превышает потерянную энтропию.
- Третье начало термодинамики гласит, что энтропия системы приближается к постоянному значению, когда температура снижается к абсолютному нулю. Предельно изолированная система обычно равна нулю и во всех случаях определяется только количеством различных основных состояний, которые она имеет. В частности, энтропия чистого кристаллического вещества (идеальный порядок) при абсолютной нулевой температуре равна нулю. Это выражение верно, если идеальный кристалл имеет только одно состояние с минимальной энергией.
Эти законы не имеют особого отношения к тому, как и почему происходит теплообмен, что имеет смысл для открытий, которые были сформулированы до того, как атомная теория была полностью принята. Они имеют дело с общей суммой энергетических и тепловых переходов внутри системы и не учитывают специфическую природу теплопередачи на атомном или молекулярном уровне.
Применение на практике
Наиболее распространённым практическим применением I закона является тепловой двигатель. Он преобразует тепловую энергию в механическую и наоборот. Большинство таких двигателей попадает в категорию открытых систем. Их основной принцип использует взаимосвязь между теплом, объёмом и давлением рабочей жидкости, которая обычно является газом. В некоторых случаях она может подвергаться фазовым переходам от газа к жидкости и обратно во время цикла.
Если газ подвергается нагреванию, он расширяется, но когда он ограничен, давление увеличивается. Если нижняя стенка удерживающей камеры является верхом подвижного поршня, то давление оказывает силу на поверхность, заставляя его двигаться вниз. Это движение затем можно использовать для выполнения работы, равной суммарному усилию, приложенному к верхней части поршня, умноженному на расстояние, на которое он перемещается.
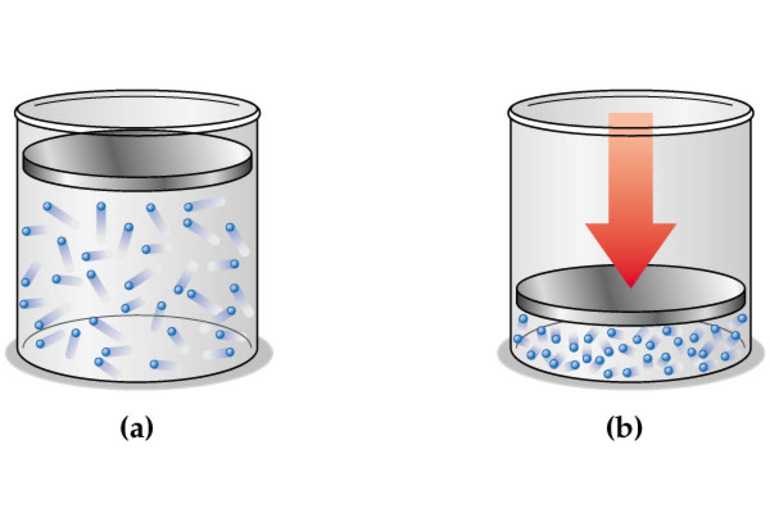
Существуют многочисленные вариации основного теплового двигателя. Например, паровые двигатели полагаются на внешнее сгорание, чтобы нагреть бак котла, содержащий рабочую жидкость, обычно воду. Она превращается в пар, а затем давление используется для привода поршня, который преобразует тепловую энергию в механическую. Однако в автомобильных двигателях используется внутреннее сгорание, когда жидкое топливо испаряется, смешивается с воздухом и воспламеняется внутри цилиндра над подвижным поршнем, приводящим его в движение вниз.
Холодильники и тепловые насосы — это двигатели, которые преобразуют механическую энергию в тепло. Большинство из них попадает в категорию закрытых систем. Когда газ сжимается, его температура увеличивается. Он может затем передавать тепло в окружающую среду. Затем, когда сжатому газу позволяют расширяться, его температура становится ниже, чем была до сжатия, потому что часть его тепловой энергии оказалась удалена во время горячего цикла. Холодный газ может затем поглощать тепловую энергию из окружающей среды. Это принцип работы кондиционера.
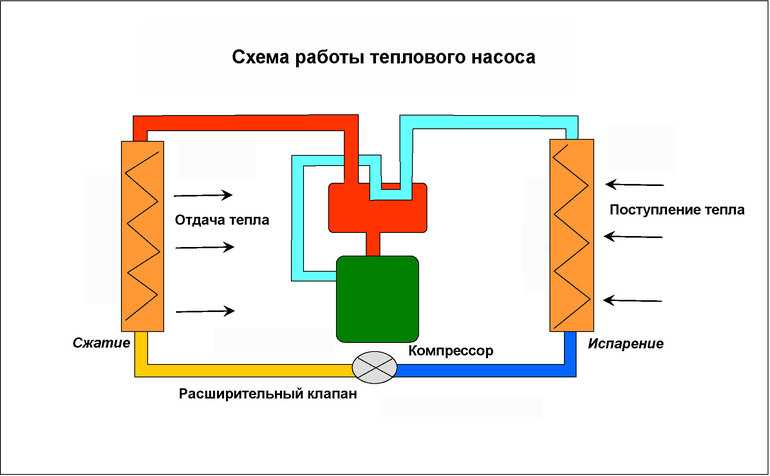
Тепловой насос — это просто кондиционер, работающий в обратном направлении. Тепло от сжатой рабочей жидкости используется для обогрева здания. После этого он переносится наружу, где расширяется и становится холодным, что позволяет ему поглощать тепло из наружного воздуха, который даже зимой обычно теплее, чем холодная рабочая жидкость.
В геотермальных или наземных системах кондиционирования воздуха и тепловых насосах используются длинные U-образные трубки в глубоких скважинах или набор горизонтальных труб, погруженных в большую площадь, по которой циркулирует рабочая жидкость, а тепло передаётся на землю или из нее. Другие системы используют реки или океаническую воду для нагрева или охлаждения рабочей жидкости.
Работа в термодинамике
При p = const (изобарный процесс)
\(~A = p \cdot \Delta V\) ,
где A = –А` – работа газа (Дж); A` – работа над газом (Дж); p – давление газа (Па); ΔV = V2 — V1 – изменение объема (м3); V2 и V1 – конечный и начальный объемы газа соответственно (м3).
Если объем увеличивается, то ΔV > 0 и A > 0, а A` 0. Это можно использовать для проверки ответа.
Работа над газом численно равна площади фигуры в осях p(V), ограниченной графиком, осями и перпендикулярами к крайним точкам графика.
Если процесс не изобарный, то работу газа можно найти
- или по формуле \(~\int_{V_1}^{V_2} p\, dV\)
- или графическим способом: работа равна площади фигуры в осях p(V), ограниченной графиком и осями.
Основные изопроцессы
Поскольку тепловые двигатели могут пройти сложную последовательность шагов, упрощённая модель часто используется для иллюстрации принципов термодинамики. В частности, можно рассмотреть газ, который расширяется и сжимается в цилиндре с подвижным поршнем при заданном наборе условий. Применение первого закона термодинамики к изопроцессам содержит два таких набора:
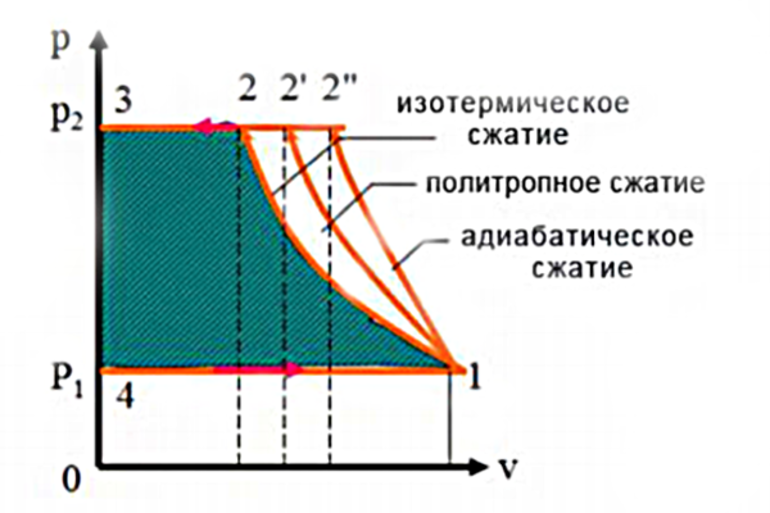
- Одно условие, известное как изотермическое расширение, включает в себя поддержание постоянной температуры газа. Поскольку он работает против сдерживающей силы поршня, то должен поглощать тепло для сохранения энергии. В противном случае он будет охлаждаться при расширении или, наоборот, нагреваться при сжатии. Это пример, в котором поглощённое тепло полностью превращается в работу со стопроцентной эффективностью. Однако этот процесс не нарушает фундаментальных ограничений по эффективности, поскольку само по себе расширение не является циклическим процессом.
- Второе условие, известное как адиабатическое расширение (от греческого «адиабатос», что означает «непроходимый»), — это состояние, при котором предполагается, что цилиндр идеально изолирован, так что тепло не может течь внутрь него или наружу. При применении первого начала термодинамики для адиабатического процесса газ охлаждается при расширении, потому что работа, выполняемая против сдерживающей силы на поршне, может исходить только от внутренней энергии газа. Таким образом, изменение этого показателя должно быть ΔU = -W, о чём свидетельствует снижение его температуры. Газ остывает, хотя теплового потока нет, потому что он работает за счёт собственной внутренней энергии. Точное количество охлаждения можно рассчитать по теплопроводности газа.
Многие природные явления адиабатны, потому что времени для значительного теплового потока недостаточно. Например, когда тёплый воздух поднимается в атмосферу, он расширяется и охлаждается по мере того, как давление падает при наборе высоты. Но он является хорошим теплоизолятором, поэтому нет значительного теплового потока от него. В этом случае окружающий воздух играет роль стенок изолированного цилиндра и подвижного поршня.
Тепло, подаваемое при постоянном давлении, также известно как изобарный процесс. При нем не происходит изменения давления во время подачи тепла в систему.
Первое начало термодинамики рассматривается многими как основа концепции сохранения энергии. В основном это говорит о том, что энергия, которая поступает в систему, не может быть потеряна по пути, но должна быть использована для того, чтобы изменить внутреннюю энергию, либо выполнить работу. С этой точки зрения он является одним из самых обширных научных понятий, когда-либо обнаруженных.
Применение первого начала термодинамики к изопроцессам. Уравнение Майера
Рассмотрим применение первого закона термодинамики к изопроцессам, происходящим с идеальным газом. В изотермическом процессе температура постоянная, следовательно, внутренняя энергия не меняется. Тогда уравнение первого закона термодинамики примет вид: , т. е. количество теплоты, переданное системе, идет на совершение работы при изотермическом расширении, именно поэтому температура не изменяется.
В изобарном процессе газ расширяется и количество теплоты, переданное газу, идет на увеличение его внутренней энергии и на совершение им работы: .
При изохорном процессе газ не меняет своего объема, следовательно, работа им не совершается, т. е. А = 0, и уравнение первого закона имеет вид , т. е. переданное количество теплоты идет на увеличение внутренней энергии газа.
Уравнение Майера
Оно показывает, что расширение моля идеального газа при постоянном давлении и изменении его температуры на 1 Кельвин требует дополнительного, по сравнению с изобарическим расширением, количества теплоты, необходимого для совершения работы. Это значение равно универсальной газовой постоянной. ![]()
Уравнение Пуассона
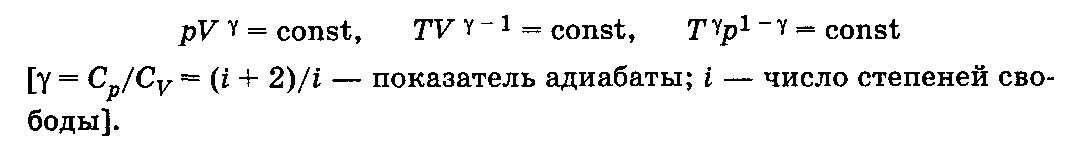
(Показатель адиабаты или коэффициент Пуассона)
21. Обратимые и необратимые термодинамические процессы. Второе начало термодинамики. Принцип работы тепловых машин. К.П.Д. обратимых и необратимых тепловых машин.
Обратимый процесс (то есть равновесный) — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений.
Обратимый процесс можно в любой момент заставить протекать в обратном направлении, изменив какую-либо независимую переменную на бесконечно малую величину.
Обратимые процессы дают наибольшую работу. Бо́льшую работу от системы вообще получить невозможно
Это придает обратимым процессам теоретическую важность. На практике обратимый процесс реализовать невозможно
Он протекает бесконечно медленно, и можно только приблизиться к нему.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы. Примеры необратимых процессов: диффузия, термодиффузия, теплопроводность, вязкое течение и др. Переход кинетической энергии макроскопического движения через трение в теплоту, то есть во внутреннюю энергию системы, является необратимым процессом.
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю.
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Принцип работы тепловых машин:В современной технике механическую энергию получают главным образом за счет внутренней энергии топлива. Устройства, в которых происходит преобразование внутренней энергии в механическую, называют тепловыми двигателями.
Для совершения работы за счет сжигания топлива в устройстве, называемом нагревателем, можно воспользоваться цилиндром, в котором нагревается и расширяется газ и перемещает поршень.Газ, расширение которого вызывает перемещение поршня, называют рабочим телом. Расширяется же газ потому, что его давление выше внешнего давления. Но при расширении газа его давление падает, и рано или поздно оно станет равным внешнему давлению. Тогда расширение газа закончится, и он перестанет совершать работу. Для того чтобы двигатель работал непрерывно, необходимо, чтобы поршень после расширения газа возвращался каждый раз в исходное положение, сжимая газ до первоначального состояния. Сжатие же газа может происходить только под действием внешней силы, которая при этом совершает работу (сила давления газа в этом случае совершает отрицательную работу). После этого вновь могут происходить процессы расширения и сжатия газа. Значит, работа теплового двигателя должна состоять из периодически повторяющихся процессов (циклов) расширения и сжатия.
История открытия
История термодинамики начинается с Отто фон Герике, который в 1650 году построил первый в мире вакуумный насос и продемонстрировал его действие, используя свои магдебургские полушария. Ученый был вынужден произвести такой эксперимент, чтобы опровергнуть давнее предположение Аристотеля о том, что «природа не терпит вакуума».
Вскоре после этого в 1656 году английский физик и химик Роберт Бойль узнал о конструкции Герике и по согласованию с учёным Робертом Гуком построил воздушный насос. Используя его, они заметили корреляцию между давлением, температурой и объёмом. Со временем был сформулирован закон Бойля, согласно которому давление и объём обратно пропорциональны.

Французский физик Сади Карно впервые сформулировал базовый принцип термодинамики в 1824 году. Его учёный использовал для определения своего теплового двигателя цикла Карно. В итоге этот принцип перешел во второй закон термодинамики немецкого физика Рудольфа Клаузиуса. Ему нередко приписывают и формулировку первого закона.
Одной из причин быстрого развития термодинамики в XIX веке была необходимость разработки эффективных паровых двигателей во время промышленной революции.
Что такое термодинамика
Слово термодинамика с греческого переводится как «тепло» и «сила».
В термодинамике изучают состояния и процессы, для описания которых необходимо ввести понятие температуры.
Процессы, происходящие в термодинамической системе, описываются макроскопическими параметрами, которые вводятся для описания систем, состоящих из большого числа частиц, и не применимы к отдельным молекулам и атомам, в отличие от величин, вводимых в механике или электродинамике. Пример макроскопических величин — это температура, давление, объем, концентрация компонентов системы, которые могут изменяться в ходе процесса.
Термодинамика изучает:
- переходы энергии из одной формы в другую, от одной части системы к другой;
- энергетические эффекты, которые сопровождают различные процессы, их зависимость от условий протекания процессов;
- возможность, направление и пределы протекания самопроизвольного течения самих процессов.
Не только физика, но химия живет по правилам термодинамики.
Как в физике, так и в химии в основе термодинамики лежат три закона или «три начала термодинамики».
Количество теплоты
\(~Q = c \cdot m \cdot \Delta t\) ,
где Q – количество теплоты, необходимое для нагревания или охлаждения тел (Дж); c – удельная теплоемкость, табличная величина ( Дж /(кг·ºС) = Дж /(кг·К) ) ; m – масса тела (кг); Δt = ΔT = t2 — t1 = T2 — T1 – на сколько тело нагрели или охладили (ºС); t1 и t2 – начальная и конечная температуры (ºС); T1 и T2 – начальная и конечная абсолютные температуры (К).
- Если тело нагревается, то ΔT > 0, если тело охлаждается, то ΔT < 0.
- Количество теплоты будем считать положительным (Q > 0), если тепло подводим к телу, т.е. тело нагревается.
- Количество теплоты будем считать отрицательным (Q < 0), если тело отдает тепло, т.е. тело охлаждается.
\(~Q = C \cdot \Delta t\) ,
где Q – количество теплоты, необходимое для нагревания или охлаждения тел (Дж); C – теплоемкость (Дж/ºС или Дж/К); Δt = ΔT = t2 — t1 = T2 — T1 – на сколько тело нагрели или охладили (ºС); t1 и t2 – начальная и конечная температуры (ºС); T1 и T2 – начальная и конечная абсолютные температуры (К).
- Если тело нагревается, то ΔT > 0, если тело охлаждается, то ΔT < 0.
- Количество теплоты будем считать положительным (Q > 0), если тепло подводим к телу, т.е. тело нагревается.
- Количество теплоты будем считать отрицательным (Q < 0), если тело отдает тепло, т.е. тело охлаждается.
\(~Q = q \cdot m\) ,
где Q – количество теплоты, выделяемое при полном сгорании топлива (Дж); m – масса топлива (кг); q – удельная теплота сгорания топлива, табличная величина (Дж/кг).
КПД нагревательного элемента равен
\(~\eta = \frac{Q_n}{Q_t}\) ,
где Qn – количество теплоты, которое потребуется для нагревания тел (Дж), Qt – количество теплоты, которое выделяется при полном сгорании топлива (Дж).
КПД может измеряться и в процентах, тогда расчетная формула будет иметь вид \(~\eta = \frac{Q_n}{Q_t} \cdot 100%\).
Уравнение теплового баланса
При теплообмене N тел без потерь выполняется уравнение теплового баланса
\(~Q_1 + Q_2 + \ldots + Q_N = 0\) ,
где QN – количество теплоты, которое получает (QN > 0) или отдает (QN < 0) N тело (Дж).
Применение изопроцессов в тепловом двигателе
В начале XIX столетия французский изобретатель Сади Карно тщательно изучил пути повышения эффективности работы тепловых двигателей. Инженер придумал универсальный цикл, который должен производить идеальный газ с помощью изопроцессов в некоторой тепловой машине. В результате получилось определить максимально возможный энергетический потенциал. Цикл Карно состоит из двух адиабат и изотерм.
Замечание 2
Идеальный газ приводят в контакт с определенным нагревателем и предоставляют ему шанс расширяться изотермически, то есть при температуре самого нагревателя.
Когда расширившийся элемент перейдет в следующее состояние, его тепло полностью изолируют от устройства и предоставят возможность самостоятельно расширяться адиабатически, то есть газ совершает некоторый функционал за счет убыли его внутренней энергии.
Расширяясь изотермически газ постепенно охлаждается до тех пор, пока его изначальная температура не будет равна температуре работающего холодильника. Теперь вещество взаимодействует с холодильником, где все процессы сжимаются изобарно. Затем идеальный газ необходимо изолировать от тепла, при этом температура самого объекта увеличивается и постепенно достигает температуры нагревателя. Процесс повторяется неоднократно.
Некоторые известные виды тепловых двигателей:
- паровая турбина;
- паровая машина;
- двигатель внутреннего сгорания;
- реактивный мотор.
Физическая база работы всех тепловых двигателей абсолютно однообразна и равномерна. Данный агрегат состоит из трех главных частей: рабочего тела, нагревателя и холодильника.
Карно доказал, что рентабельность любой другой тепловой машины будет значительно меньше, чем эффективность работы указанного цикла. На практике не применяют оборудования, работающие по закону Карно, но формула позволяет определить максимально подходящий параметр при изначально заданных температурах основных частей.
Очевидно, что для увеличения действия изопроцессов в термодинамике необходимо понижать температуру холодильника и увеличивать температуру нагревателя. Стоит отметить, что осуществлять данные процессы искусственно – совершенно невыгодно, так как это требует дополнительных затрат энергии. Однако формула Карно показала, что на сегодняшний день существуют неиспользованные и мощные резервы повышения работы паровых машин, так как практический метод очень сильно отличается от цикла Карно.
Термодинамические системы
По словам профессора физики университета штата Миссури Макки, энергию можно разделить на две части. К одной из них принадлежит поршень, движущийся и толкающий газ.
Макки объясняет: «Когда я приставляю два образца металла друг к другу, два атома сталкиваются, одна из частиц отрывается быстрее другой, я не могу удержаться от наблюдения за этим процессом. Это происходит в очень маленьком масштабе времени, на небольшом расстоянии и много раз в секунду. Итак, мы просто делим всю передачу энергии на две группы: то, что мы будем отслеживать, и то, что не будем. Последний из них называется теплом». Термодинамические системы обычно рассматриваются как открытые, закрытые или изолированные:
- Открытая система, в отличие от закрытой или изолированной, свободно обменивается энергией и веществом с окружающей средой. Например, кастрюля с кипящим супом получает энергию из печи, излучает тепло из емкости и выделяет вещество в виде пара. Это открытая система.
- Если поставить крышку на горшок плотно, он всё равно будет излучать тепловую энергию, но больше не станет выделять вещество в виде пара. Это закрытая система.
- Если налить суп в идеально изолированный термос и закрыть крышку, не будет никакой энергии или вещества. Это изолированная система.
В другом примере звёзды белых карликов, которые больше не производят энергию, могут быть изолированы световыми годами почти до идеального вакуума в межзвёздном пространстве, но в итоге они будут охлаждаться с нескольких десятков тысяч градусов почти до абсолютного нуля в связи с потерей энергии из-за излучения. Хотя этот процесс занимает больше времени, чем нынешний век Вселенной, его не остановить.






























