Разница между ионным и ковалентным соединением
| Ионное соединение | Ковалентное соединение |
| Ионное взаимодействие между двумя частицами создается за счет полной передачи одного или нескольких электронов. | Ковалентность между двумя химическими веществами возникает из-за совместного использования электронного облака. |
| Ионные связи обычно наблюдаются между металлом и неметаллическим веществом. | Ковалентные связи обычно представляют собой связь между двумя неметаллическими соединениями. |
| Более высокие температуры плавления и кипения являются одной из наиболее важных характеристик ионного соединения. | Низкие температуры кипения и плавления являются свойствами ковалентного соединения. |
| Ионная связь присутствует только в твердом состоянии любого химического вида. | Ковалентная связь присутствует во всех трех состояниях (твердое, жидкое, газообразное) любых химических веществ. |
Полный перенос электронов в ионном соединении.Изображение Фото: Wikimedia Commons
Совместное использование электронного облака в ковалентном соединении.Изображение Фото: Википедия
Чтобы узнать больше, пожалуйста, следуйте: Полярный или неполярный N2: почему, как, характеристики и подробные факты
структура

Два аниона HCO показаны на верхнем изображении3— и катион Ca2+ взаимодействуя электростатически. Ca2+ в соответствии с изображением, оно должно быть расположено посередине, поскольку именно так HCO3— они не будут отталкивать друг друга из-за своих отрицательных зарядов.
Отрицательный заряд в HCO3— он делокализован между двумя атомами кислорода путем резонанса между карбонильной группой C = O и связью C-O-; в то время как в СО32-, Это делокализовано между тремя атомами кислорода, так как связь С-ОН депротонирована и поэтому может получить отрицательный заряд по резонансу.
Геометрию этих ионов можно рассматривать как сферы кальция, окруженные плоскими треугольниками карбонатов с гидрированным концом. С точки зрения соотношения размеров, кальций заметно меньше, чем ионы HCO3-.
Водные растворы
Ca (HCO)3)2 Он не может образовывать кристаллические твердые вещества, и он действительно состоит из водных растворов этой соли. В них ионы не одни, как на изображении, а окружены молекулами H.2О.
Как они взаимодействуют? Каждый ион окружен сферой гидратации, которая будет зависеть от металла, полярности и структуры растворенных частиц.
Ca2+ координируется с атомами кислорода воды с образованием акокомплекса Ca (OH)2)N2+, где n обычно считается равным шести; то есть «водный октаэдр» вокруг кальция.
Пока HCO анионы3— взаимодействовать с водородными связями (ИЛИ2СО-Н-ОН2) или с атомами водорода в воде в направлении отрицательного заряда делокализует (HOCO)2— H-OH, диполь-ионное взаимодействие).
Эти взаимодействия между Ca2+, HCO3— и вода настолько эффективна, что они делают бикарбонат кальция очень растворимым в этом растворителе; в отличие от CaCO3, в котором электростатические притяжения между Ca2+ и СО32- очень сильны, выпадают в осадок из водного раствора.
Помимо воды, есть молекулы СО2 вокруг, которые реагируют медленно, чтобы обеспечить больше HCO3— (в зависимости от значения pH).
Гипотетическое твердое тело
Пока что размеры и заряды ионов в Са (HCO)3)2, ни присутствие воды, объясните, почему не существует твердого соединения; то есть чистые кристаллы, которые можно охарактеризовать с помощью рентгеновской кристаллографии. Ca (HCO)3)2 это не что иное, как присутствующие в воде ионы, из которых продолжают расти кавернозные образования.
Да ка2+ и HCO3— они могут быть изолированы от воды, избегая следующей химической реакции:
Ca (HCO)3)2(aq) → CaCO3(s) + CO2(г) + Н2O (l)
Затем их можно сгруппировать в белое кристаллическое твердое вещество со стехиометрическими пропорциями 2: 1 (2HCO3/ 1Ca). Там нет никаких исследований о его структуре, но это можно сравнить с NaHCO3 (для бикарбоната магния, Mg (HCO)3)2, не существует как твердое вещество), или с CaCO3.
Стабильность: NaHCO3 против Ca (HCO)3)2
NaHCO3 кристаллизуется в моноклинной системе, и СаСО3 в тригональной (кальцит) и ромбической (арагонитовой) системах. Если Na был заменен+ для ча2+, кристаллическая сеть будет дестабилизирована большей разницей в размерах; то есть Na+ поскольку он меньше, он образует более стабильный кристалл с HCO3— по сравнению с Ca2+.
На самом деле, Ca (HCO)3)2(aq) нуждается в воде, чтобы испариться так, чтобы ее ионы могли быть сгруппированы в кристалле; но кристаллическая решетка этого не достаточно сильна, чтобы сделать это при комнатной температуре. Когда вода нагревается, происходит реакция разложения (уравнение выше).
Быть ионом Na+ в растворе это будет кристалл с HCO3— до его термического разложения.
Причина, почему Ca (HCO)3)2 он не кристаллизуется (теоретически), это происходит из-за разницы ионных радиусов или размеров его ионов, которые не могут образовывать стабильный кристалл до его разложения.
Ca (HCO)3)2 против CaCO3
Если с другой стороны, H был добавлен+ к кристаллическим структурам CaCO3, они бы резко изменили свои физические свойства. Возможно, его точки плавления заметно падают, и даже морфология кристаллов в конечном итоге изменяется.
Стоит ли пытаться синтезировать Са (HCO)3)2 Твердая? Трудности могут превзойти ожидания, и соль с низкой структурной стабильностью может не дать существенных дополнительных преимуществ в любом применении, где другие соли уже используются..
Буфер [ править ]
Он работает как буфер в крови следующим образом: при низком pH концентрация ионов водорода слишком высока, поэтому вы выдыхаете CO 2 . Это заставит уравнение сдвинуться влево, [ требуется дальнейшее объяснение ], по существу уменьшая концентрацию ионов H + , вызывая более щелочной pH.
Когда pH слишком высокий, концентрация ионов водорода в крови слишком низкая, поэтому почки выделяют бикарбонат ( HCO- 3). Это заставляет уравнение сдвигаться вправо, существенно увеличивая концентрацию ионов водорода, вызывая более кислый pH.
Три важных обратимых реакции контролируют указанный выше баланс pH:
- H 2 CO 3 ⇌ H + + HCO- 3
- H 2 CO 3 ⇌ CO 2 + H 2 O
- CO 2 (водн.) ⇌ CO 2 (г)
Выдыхаемый CO 2 (г) истощает CO 2 (водный), который, в свою очередь, потребляет H 2 CO 3 , вызывая вышеупомянутый сдвиг, оставшийся в первой реакции по принципу Ле Шателье . По тому же принципу, когда pH слишком высок, почки выделяют бикарбонат ( HCO- 3) в мочу в виде мочевины через цикл мочевины (или орнитиновый цикл Кребса-Хенселейта). При удалении бикарбоната больше H + образуется из угольной кислоты (H 2 CO 3 ), которая поступает из CO 2 (г), производимого клеточным дыханием .
Что особенно важно, тот же буфер действует в океанах. Это главный фактор изменения климата и долгосрочного углеродного цикла из-за большого количества морских организмов (особенно кораллов), которые образованы из карбоната кальция
Повышенная растворимость карбоната за счет повышения температуры приводит к снижению образования морского кальцита и увеличению концентрации углекислого газа в атмосфере. Это, в свою очередь, увеличивает температуру Земли. Тоннаж CO2- 3находится в геологическом масштабе, и все они могут быть повторно растворены в море и выброшены в атмосферу, что еще больше повысит уровень CO 2 .
Физико-химические свойства
Физическое состояние
Он не появляется в твердом состоянии. Он находится в водном растворе и пытается превратить его в твердое вещество путем испарения воды, но не работает, поскольку он превращается в карбонат кальция..
Растворимость в воде
16,1 г / 100 мл при 0 ° С; 16,6 г / 100 мл при 20 ° С и 18,4 г / 100 мл при 100 ° С. Эти значения свидетельствуют о высоком сродстве молекул воды к ионам Са (HCO)3)2, как объяснено в предыдущем разделе. Между тем, только 15 мг CaCO3 они растворяются в литре воды, что отражает их сильное электростатическое взаимодействие.
Потому что Ca (HCO)3)2 он не может образовывать твердое вещество, его растворимость не может быть определена экспериментально. Однако, учитывая условия, созданные СО2 при растворении в воде, окружающей известняк, можно рассчитать массу кальция, растворенного при температуре Т; масса, которая была бы равна концентрации Ca (HCO)3)2.
При разных температурах растворенная масса увеличивается, как показано значениями при 0, 20 и 100 ° С. Итак, согласно этим экспериментам, сколько Ca (HCO) определяется3)2 растворяется в непосредственной близости от CaCO3 в водной среде, газифицированной СО2. Как только СО сбежит2 газообразный, СаСО3 будет выпадать в осадок, но не Ca (HCO3)2.
Точка плавления и кипения
Кристаллическая сеть Ca (HCO)3)2 намного слабее, чем CaCO3. Если его можно получить в твердом состоянии и измерить температуру, при которой он плавится внутри фузиометра, он наверняка получит значение значительно ниже 899ºC. Аналогичным образом, то же самое можно ожидать при определении точки кипения..
Кристаллическое строение карбонатов щелочных металлов
Параметры кристаллической структуры 1Л2СОз приведены в работе , вид примитивной ячейки показан на рис. 2. В 1Л2СОз, обладающего моноклинной сингонией C2h , имеется по одной подрешетке лития и углерода и две неэквивалентные подрешетки кислорода с расстояниями С-01=1.267 А, С-О2=1.290 А. Каждый атом металла окружен четырьмя атомами кислорода, находящимися на расстояниях от 1.90- -2.03 А.
\Данный кристалл относится к моноклинной сингонии C2h и имеет следующие параметры примитивной ячейки: а=8.920 А, Ь=5.245 А, с=б.050 А, /3=101.35 и объем V=277.5 А3. Координаты атомов в элементарной ячейке приведены в табл. 4.
Примитивная ячейка кристалла Na2C03 В структуре Ыа2СОз атомы натрия образуют 3 подрешетки с неэквивалентными расстояниями: Nal-C=3.223 A Na2-C=3.078 A Na3-С=2.992 А. Атомы углерода образуют одну и кислорода — две подрешетки с неэквивалентными расстояниями: С-01=1.257 А, С-02= 1.276 А. Кристаллы К2СОз, Ш)2СОз, Cs2C03 являются изоструктурными и принадлежат к моноклинной сингонии С2И . Элементарная ячейка К2СОз приведена на рис. 4. Данные о кристаллической структуре К2СОз приводятся в работе , Rb2C03 в , Cs2C03 в . Число формульных единиц Z=4. В KN02 Z=3 и определение его структуры выполнено позже .
К2СОз имеет три неэквивалентные кислородные подрешетки, две подрешетки калия и одну углерода. Атомы кислорода образуют с углеродом неэквивалентные связи с расстояниями: С-01=1.278 А, С-02=1.317 А, С-ОЗ =1.276 А. Атомы калия образуют с углеродом две неэквивалентные связи с расстояниями: К1-С=3.251 А, К2-С=3.452 А и с расстояниями для К1 2.83- -2.88 А и для К2 2.64- — 2.68 А). Расстояния между атомами калия и кислорода приведены в табл. 6. Rb2C03 имеет следующие параметры элементарной ячейки: а=5.870 А, Ь=10.120 А, с=7.330 А, /5=97.7. Атомы кислорода образуют с углеродом неэквивалентные связи с расстояниями: С-01=1.278 А, 002=1.317 А, С-ОЗ =1.276 А. Атомы рубидия образуют с углеродом две неэквивалентные связи с расстояниями: Rbl-C=3.251 A, Rb2-C=3.452 А.
Кристалл ЫКСОз получают путем смешивания расплава карбоната калии и карбоната лития, после чего производят кристаллизацию и получают твердый раствор (LixK1.x)2C03 . При х=1 образуется кристалл LiKC03 с известной кристаллической структурой .
Параметры кристаллической структуры LiKC03 взяты из работы , вид примитивной ячейки показан на рис. 5. Данный кристалл относится к моноклинной сингонии С 2Л и имеет следующие параметры примитивной ячейки: я=7.2228 А, 6=7.0067 А, с=7.5940 А, р=127.421 и объем =308.97 А3. Рис. 5. Элементарная ячейка LiKC03
Электронная структура СОз и его радикалов хорошо известна . Свободный ион имеет симметрию D3h и длину связи С-О-1.279 А. В табл.9 приведены энергии молекулярных орбиталей (МО) С0 вычисленные с помощью стандартного программного пакета GAMESS методом функционала плотности с обменно-корреляционным функционалом B3LYP . Здесь, как и в дальнейшем, за нуль энергии выбрано самое верхнее заполненное состояние.
Самые нижние по энергии молекулярные орбитали (МО) симметрии 1а/ и двукратно вырожденная 1е; построены преимущественно из s-состояний кислорода. По условиям симметрии МО 1е;/ и 1а27 образованы ж-орбиталями атомов кислорода, а \г.2- гибридизоваными л:-орбиталями углерода и кислорода.
Сравним уровни энергии, вычисленные с помощью пакета GAMESS, с результатами ранних работ. Симметрия МО совпадает для всех уровней энергии кроме 1а2У/ и Зе из . Общее число МО в свободном карбонат-ионе равно двенадцати и четыре уровня энергии двукратно вырождены. В большинстве работ посвященных карбонатам щелочных металлов для объяснения результатов экспериментов рассматривают кристалл, как анион СОз и катион, но при этом не используют результаты прямых вычислений. Это связано, по всей видимости, с тем, что выполнение таких расчетов являлось трудоемкой задачей. Вычисление энергетических уровней СО с симметрией интересующего кристалла приводит к снятию двукратного вырождения. Такой подход объясняет экспериментальные закономерности значительно лучше. В данной работе закономерности, установленные в зонном спектре, сравниваются с уровнями энергиями МО, что позволяет выяснить происхождения кристаллических орбиталей (КО). Сравнение КО с МО позволит установить, как проявляется действие кристаллического поля на анион.
риски
Поскольку это соединение не существует в твердой форме, маловероятно, что оно будет представлять риск манипулирования его водными растворами, поскольку оба Са2+ как HCO3— они не вредны при низких концентрациях; и, следовательно, наибольший риск, который может возникнуть при приеме таких растворов, может быть связан только с употреблением опасной дозы кальция..
Если соединение образовало твердое вещество, хотя оно может физически отличаться от СаСО3, его токсические эффекты не могут выходить за рамки простого дискомфорта и резекции после физического контакта или вдыхания.
Карбонат-ион
Карбонат-ион, хорошо удерживаемый сильноосновным анионитом, уменьшает его емкость поглощения по кремневой кислоте; для удаления СО2 при регенерации требуется присутствие едкого натра.
Карбонат-ион является анионом угольной кислоты Н2СО3, неизвестной в свободном состоянии. При получении ее из солей она почти полностью распадается на ангидрид ( СО2) и воду. Так как Н2СО3 весьма слабая кислота, карбонаты щелочных металлов имеют тделочную реакцию. Из средних солей растворимы в воде только соли калия, натрия и аммония.
Карбонат-ион является анионом угольной кислоты Н СО3, Hf известной в свободном состоянии. При получении ее из солей она почти полностью распадается на ангидрид ( СО2) и воду. Так как Н2СО3 весьма слабая кислота, карбонаты щелочных металлов имеют щелочную реакцию. Из средних солей растворимы в воде только соли калия, натрия и аммония.
Карбонат-ион является анионом угольной кислоты Н2СО3, неизвестной в свободном состоянии. При получении ее из солей она почти полностью распадается на ангидрид ( СО2) и воду. Так как Н2СО3 весьма слабая кислота, карбонаты щелочных металлов имеют щелочную реакцию. Из средних солей растворимы в воде только соли калия, натрия и аммония.
Карбонат-ион бесцветен, поэтому карбонаты окрашены в цвет гидратированного катиона.
Карбонат-ион СОр открывают из отдельной порции раствора частной реакцией.
Карбонат-ион ( СО3) может быть определен только по отношению твердого вещества к кислоте ( 24а, стр. Слабая реакция с групповыми реактивами, исчезающая при добавлении малого количества НС2Н3О2, обусловлена присутствием СО3 из Na2CO3, применявшегося при приготовлении раствора для испытания на анионы.
Карбонат-ион является резонансным гибридом трех эквивалентных структур.
Карбонат-ион в водах определял Бербени следующим образом: в аликвотной части анализируемого раствора после удаления СОа определяют содержание Са титрованием в сильнощелочном растворе в присутствии мурексида. Ко второй аликвотной части приливают отмеренное количество раствора Са ( ОН) 2, в осадок выпадает СаСО3, а остающийся в растворе Са оттитровы-вают. По разности обоих расходов определяют содержание СО2, учитывая добавленное количествд Са. Ценин определяет углекислоту аналогичным образом.
Карбонат-ион вступает во многие реакции, однако лишь некоторые из них имеют аналитическое значение.
Карбонат-ион является анионом угольной кислоть Н2СО3, которая в свободном состоянии не известна; она существует только в водном растворе. При получении ее из солей она распадается на угольный ангидрид С02 ( диоксид углерода) и воду.
Карбонат-ион обнаруживают непосредственно в первоначальном испытуемом веществе до приготовления содовой вытяжки.
Карбонат-ион СОз — является анионом угольной кислоты неизвестной в свободном состоянии. При получении из солей она почти полностью распадается на ангидрид ( СО2) и воду. Так как Н2СО3 весьма слабая кислота, карбонаты щелочных металлов имеют щелочную реакцию. Из средних солей растворимы в воде только соли калия, натрия и аммония. Катионы остальных групп осаждаются СОз — в виде средних и основных карбонатов, а некоторые ( например, А13, Cr3, TiIV) — в виде гидроокисей.
Плоский карбонат-ион, три эквивалентные связи которого направлены к вершинам углов правильного треугольника, уже обсуждался в гл.
Карбонат-ион COjj имеет плоское треугольное строение. Четвертый электрон углерода образует я-связь.
приложений
На первый взгляд, часть BaCO3 может не обещать какого-либо практического применения в повседневной жизни, но если вы видите белый минеральный кристалл, белый как молоко, он начинает понимать, почему ваш экономический спрос.
Используется для изготовления бариевых стаканов или в качестве добавки для их укрепления. Это также используется в производстве оптических очков.
Благодаря большой энтальпии и нерастворимости в сети он используется при изготовлении различных типов сплавов, резин, клапанов, напольных покрытий, красок, керамики, смазочных материалов, пластмасс, смазок и цементов..
Кроме того, он используется в качестве яда для мышей. При синтезе эта соль используется для производства других соединений бария и, таким образом, служит материалами для электронных устройств..
БаСО3 могут быть синтезированы в виде наночастиц, выражая в очень небольших масштабах новые интересные свойства белого. Эти наночастицы используются для пропитки металлических поверхностей, в частности химических катализаторов..
Было обнаружено, что он улучшает катализаторы окисления, и это как-то способствует миграции молекул кислорода по его поверхности..
Они рассматриваются как инструменты для ускорения процессов, в которые включаются атомы кислорода. И, наконец, они используются для синтеза надмолекулярных материалов.
Карбонат-ион
Карбонат-ион СО — можно обнаружить и более простым способом: добавляя к исследуемому раствору соли соляную кислоту и по выделению СОг делая заключение о присутствии карбоната натрия.
ПолучающиЕся карбонат-ион может реагировать с ионом гидроксония, гидрооксалат-ионом и другими кислотами.
Пример карбонат-иона довольно прост, ибо речь идет об учете резонанса для одной пары я-электронов, а параметры а, Ь и с в выражении волновой функции V одинаковы. При большем числе пар л-электронов и связанных атомов точный расчет этих параметров становится очень сложным.
Образованию карбонат-иона способствует всегда прибавляемый к сернистому аммонию гидрат окиси аммония. Такой реактив для проведения систематического хода анализа непригоден, так как наряду с катионами 3 — й группы может частично осаждать и катионы 2 — й группы.
Избыток карбонат-ионов взаимодействует с ионами Са2, содержащимися в воде, с образованием труднорастворимого карбоната кальция.
Образованию карбонат-иона способствует всегда прибавляемый к сернистому аммонию гидрат окиси аммония. Такой реактив для проведения систематического хода анализа непригоден, так как наряду с катионами 3 — й группы может частично осаждать и катионы 2 — й группы.
Источником карбонат-ионов может быть и сам твердый реагент, используемый для приготовления стандартного раствора основания.
Добавление карбонат-иона в слабо основной раствор вызывает осаждение элементов группы 2А, Mg2, Са2, Sr2 и Ва2, поскольку эти металлы образуют нерастворимые карбонаты.
|
Схема замещения двухвалентного иона Са2 одновалентным ионом Na. |
Помимо карбонат-ионов, разжижающее действие могут усиливать оксалат-ионы, фторид-ионы и др. Образование нерастворимых соединений служит в данном случае движущей силой процесса разжижения.
Обнаружение карбонат-иона COf -, Если в анализируемом растворе обнаружен сульфит-ион SO, то его необходимо окислить в.
В карбонат-ионе, имеющем форму плоского треугольника, атом С находится в зр2 — гибридизованном состоянии, а орби-таль р образует я-орбиталь. Атомы С и О в валентных состояниях образуют показанные на рис. 4.1 молекулярные орбитали, и а-орбитали расщепляются на трехкратно вырожденные связывающую и разрыхляющую орбитали. Однократное связывание атомов за счет л-орбита-лей приводит к образованию четырех молекулярных орбиталей, две из которых вырожденны.
В карбонат-ионе СОз — вследствие делокализации n — связей и заряда ( 2 -) по всем его связям последние приобретают частично характер двойных связей. Из системы молекулярных орбиталеи иона COJT ( рис. 36) видно, что 10 электронов располагаются в о. Подобную изо-электронную структуру имеет нитрат-ион NOJ, в котором все три связи N-О равноценны.
|
Система молекулярных орбиталей для карбонат-иона С0 §. |
В карбонат-ионе СОз — вследствие делокализации р-элек-тронов и заряда ( 2 -) связи приобретают частично характер двойных.
Внешние ссылки [ править ]
- Равновесие карбонат / бикарбонат / угольная кислота в воде: pH растворов, буферная емкость, титрование и распределение частиц в зависимости от pH, вычисленное с помощью бесплатной электронной таблицы
- «Карбонат» . Dictionary.com . Проверено 5 апреля 2014 года .
| vтеОксоуглероды | |
|---|---|
| Общие оксиды |
|
| Экзотические оксиды |
|
| Полимеры |
|
| Соединения, полученные из оксидов |
|
| vтеНеорганические соединения углерода и родственных ионов | |
|---|---|
| Соединения |
|
| Ионы углерода |
|
| Оксиды и родственные |
|
| Авторитетный контроль |
|
|---|
Карбонат
Карбонат является солью из угольной кислоты (Н 2 СО 3 ), характеризуются наличием карбонатного иона , в многоатомном ионе с формулой CO 2- 3 . Название может также относиться к карбонатному эфиру , органическому соединению, содержащему карбонатную группу C (= O) (O–) 2 .
Этот термин также используется как глагол для описания карбонизации : процесса повышения концентрации карбонат- и бикарбонат- ионов в воде для производства газированной воды и других газированных напитков — либо путем добавления газообразного диоксида углерода под давлением, либо путем растворения карбоната. или бикарбонатные соли в воду.
В геологии и минералогии термин «карбонат» может относиться как к карбонатным минералам, так и к карбонатной породе (которая состоит в основном из карбонатных минералов), и в обоих преобладает карбонатный ион CO. 2- 3 . Карбонатные минералы чрезвычайно разнообразны и распространены в химически осажденных осадочных породах . Наиболее распространены кальцит или карбонат кальция , СаСО 3 , главный компонент известняка (а также основной компонент раковин моллюсков и скелетов кораллов ); доломит , карбонат кальция и магния CaMg (CO 3 ) 2 ; и сидерит , или карбонат железа (II), FeCO 3 , важная железная руда . Карбонат натрия («сода» или «натрон») и Карбонат калия («поташ») использовался с древних времен для очистки и консервирования, а также для изготовления стекла . Карбонаты широко используются в промышленности, например при выплавке чугуна, в качестве сырья для производства портландцемента и извести , в составе керамических глазурей и т. Д.
свойства
На2Колорадо3 представляет собой гигроскопичное белое твердое вещество без запаха, с молекулярной массой 106 г / моль и плотностью 2,54 г / мл при 25 ° C.
Его свойства изменяются, поскольку он включает молекулу воды в свою кристаллическую структуру. Поскольку вода может образовывать водородные мостики, а ионы «открывают пространство» между ними, объем кристалла увеличивается, а плотность гидрата уменьшается. Например, для Na2Колорадо3· 10H2Или его плотность составляет 1,46 г / мл..
На2Колорадо3 плавится при 851 ° C, разлагается в соответствии со следующим уравнением:
не доступно2Колорадо3(s) => Na2O (s) + CO2(G)
Опять же, несмотря на то, что ионы СО32- и на+ Они отличаются по размерам, их электростатические взаимодействия очень эффективны и поддерживают стабильную кристаллическую сеть.
Молекулы воды «препятствуют» этим взаимодействиям, и в результате гидраты более подвержены разложению, чем ангидрид..
Это основная соль; растворение в воде приводит к образованию раствора с рН выше 7. Это связано с гидролизом СО32-, чья реакция высвобождает ОН- в середине:
Колорадо32-(ac) + H2O (l) HCO3-(ac) + OH-(Aq)
Он очень хорошо растворяется в воде и в полярных растворителях, таких как глицерин, глицерин, ацетон, ацетаты и жидкий аммиак..
Строение карбонат иона (СО3)2-
По данным рентгеноструктурного анализа, в карбонат-ионе все связи С—О имеют одинаковую длину, все атомы кислорода — одинаковую электронную плотность.
Чтобы передать строение этой частицы, необходимо воспользоваться набором из трёх предельных структур:
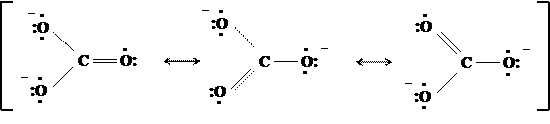
Как видно, данные резонансные структуры не отличаются расположением атомов, они различаются только распределением электронов между ними. Хотя, согласно концепции резонанса, граничные структуры в действительности не существуют, а являются лишь формулами, однако наложением их друг на друга можно представить распределение электронов в реальной частице. Такой «резонансный гибрид» называется мезоформулой. Если канонические структуры равноценны между собой по энергии (как в карбонат-ионе), то они вносят равный вклад в реальное строение молекулы (имеют одинаковый «удельный вес»).
Мезоформула показывает, что в этом анионе нет чисто простых и чисто двойных связей. Все связи имеют нецелочисленную кратность. Аналогично, ни на одном из атомов кислорода нет целого отрицательного заряда: все заряды дробные, их величины равны между собой. Такое распределение электронов называется делокализацией. Оно соответствует экспериментальным данным.
Рассмотрим гидролиз карбоната натрия Na2CO3. Для составления уравнений гидролиза Na2CO3 по ступеням исходим из следующего положения. Соль образована сильным основанием и слабой кислотой. Ион слабой кислоты будет связывать ионы водорода воды. Поскольку ион несет две единицы заряда, то следует рассматривать две ступени гидролиза. Для каждой ступени надо уметь записывать три вида уравнений: а) в сокращенной ионной форме; б) в ионной форме;
а)
б) к ионам этого уравнения приписываем ионы противоположного знака:
2Nа+
в) записываем ионы предыдущего уравнения в виде химических формул веществ и получаем уравнение гидролиза в молекулярной форме:
Nа2СО3 + Н2О
а)
б) Nа+
в) NаНСО3 + Н2О
В обычных условиях гидролиз протекает главным образом по первой ступени: ионы связывают ионы водорода Н+ воды, образуя сначала , и лишь при сильном разбавлении и нагревании следует учитывать гидролиз образовавшейся кислой соли.
Итак, в результате гидролиза соли, образованной слабой кислотой и сильным основанием, ионы водорода Н+ (от молекул воды Н2О) образуют с ионами устойчивые ионы . В растворе накапливаются свободные ионы ОН–, поэтому среда становится щелочной,
Прямо сейчас студенты читают про:
Алгоритм проведения оксигенотерапии через носовой катетер Подготовить: Установить с пациентом доверительное отношение, объяснить механизм проведения процедуры и получить согласие на ее. Виды, сроки и порядок проведения проверок СИЗОД Техническое обслуживание проводится в соответствии с нормами и сроками. Философия Древнего Востока Древнеиндийская философия 1.Какие идеи, сюжеты, присутствующие в древнеин­. Технология разработки лесосек на рубках леса 5.1. Для разработки лесосек рекомендуются различные схемы. На выбор схемы оказывают влияние. Алгоритм взятия крови с помощью вакуумной системы Примечание: Вакуумные системы могут быть очень разными: держатели.
Источник статьи: http://studopedia.ru/4_120028_stroenie-karbonat-iona-so-.html
Присутствие вне Земли
Принято считать, что наличие карбонатов в горных породах является веским доказательством наличия жидкой воды. Недавние наблюдения планетарной туманности NGC 6302 свидетельствуют о наличии карбонатов в космосе , где изменение водной среды, аналогичное земному, маловероятно. Были предложены другие минералы, которые соответствовали бы наблюдениям.
До недавнего времени карбонатные отложения не были обнаружены на Марсе с помощью дистанционного зондирования или миссий на месте, хотя марсианские метеориты содержат небольшое количество. Подземные воды, возможно, существовали на Гусеве и Meridiani Planum .
Источник статьи: http://wikipredia.net/ru/Carbonates
доказательство
Доказательство карбоната баритовой водой
Карбонат- ионы (CO 3 2- ) могут быть обнаружены путем добавления соляной кислоты, которая образует диоксид углерода :
- С.О32-+2 ЧАСС.л⟶С.О2↑+2 С.л-+ЧАС2О{\ displaystyle \ mathrm {CO_ {3} ^ {2 -} + 2 \ HCl \ longrightarrow CO_ {2} \ uparrow +2 \ Cl ^ {-} + H_ {2} O}}
Газообразный диоксид углерода подается в реагент обнаружения извести или баритовой воды . Там создается белое помутнение карбоната кальция или бария :
- Б.а(ОЧАС)2 (аq)+С.О2 (грамм)⟶Б.аС.О3↓+ЧАС2О (л){\ displaystyle \ mathrm {Ba (OH) _ {2} \ (aq) + CO_ {2} \ (g) \ longrightarrow BaCO_ {3} \ downarrow + H_ {2} O \ (l)}}
- Гидроксид бария и диоксид углерода реагируют с образованием карбоната бария и воды.
Количественное обнаружение низких концентраций карбоната в воде проводят вместе с определением гидрокарбонатов, часто путем титрования с соляной кислотой ( «ЗСО»): если измеренный материал имеет значение рН выше 8,3 в начале, соляной кислоты расход до pH 8,3, эквивалентного концентрации карбоната. Дальнейшее потребление кислоты до достижения pH 4,3 соответствует сумме карбоната и гидрокарбоната. Для воды со значением pH ниже 8,3 титруйте только до 4,3 (только гидрокарбонат) и рассчитайте исходную, затем очень низкую долю карбонат-ионов из угольной кислоты.
Карбонаты и гидрокарбонаты также можно определять с помощью ионной ВЭЖХ или капиллярного электрофореза . В обоих случаях определяется «общий карбонат», и компоненты карбонат, гидрокарбонат и «свободная угольная кислота» рассчитываются из равновесия диссоциации угольной кислоты с учетом значения pH, ионной силы и температуры.
Как нарисовать MgCO3 структура Льюиса?
Структура Льюиса представляет собой структурное представление любой молекулы, показывающее несвязывающие электроны вокруг соответствующих атомов. Давайте поговорим об этом.
Определение валентных электронов:
Наблюдения и советы этой статьи мы подготовили на основании опыта команды структура льюиса MgCO3 содержит три типа атомов: магний (Mg), углерод (C) и кислород (O), которые имеют два, четыре и шесть электронов в соответствующих валентных оболочках.
Находим связующие электроны:
CO32- в MgCO3 имеет всего четыре ковалентные связи (две одинарные и одну двойную) и есть одна ионная связь между Mg и CO3. Следовательно, всего (5 × 2) = 10 электронов задействовано в качестве связывающих электронов.
Определение несвязывающих электронов:
Только СО32- в MgCO3 несут неподеленные пары (неподвижные пары кислорода). Всего 10 электронов остаются несвязывающими электронами.MgCO3 Структура Льюиса
Как нарисовать структуру CO32-льюиса?
Структура Льюиса любой молекулы рисуется с помощью следующих шагов:
Шаг – 1 Предскажите групповые положения атомов C и O, присутствующих в CO32-, и обратите внимание на валентные электроны, присутствующие на атомах C и O. Шаг — 2 Определите общую валентность, присутствующую в CO32- структура льюиса
Шаг — 2 Определите общую валентность, присутствующую в CO32- структура льюиса.
Шаг — 3 Поместите наименее электроотрицательный атом в центральное положение или, если молекула многоатомная, поместите два атома рядом друг с другом.
Шаг — 4 Остальные оставшиеся атомы связаны с центральными атомами одинарными ковалентными связями, в которых присутствуют два валентных электрона.
Шаг — 5 После связывания оставшиеся валентные электроны размещаются на внешних атомах, чтобы завершить октеты.
Шаг — 6 Проверьте полные или неполные октеты всех атомов, присутствующих в структуре CO32-льюиса.
Шаг — 7 Вычислить одинокий электрон пары и формальный заряд, присутствующие в структуре CO32-льюиса.
Шаг — 8 Наконец, необходимо определить форму, гибридизацию и валентный угол CO32- структура льюиса.
CO32-структура Льюиса



















![Карбонатсодержание а также структура и связь [ править ]](http://mapisa-plitka.ru/wp-content/uploads/8/6/8/868cd74fe51c6b66be01e779cd0e6554.jpeg)










