Окисление жирных кислот
Жирные кислоты во
многих тканях (в первую очередь в скелетных мышцах и миокарде)
вовлекаются в специфический процесс –
b-окисление, протекающее в митохондриях. Все превращения ЖК
начинаются с их активации — образования ацил-КоА.
Мембрана митохондрий
непроницаема для жирных кислот, в том числе и в форме ацил-КоА. Их
перенос обеспечивается карнитином.
В митохондриях на
митохондриальном матриксе происходит окисление жирных кислот,
сопряженное с окислительным фосфорилированием (с синтезом АТФ).
b-окисление протекает по
следующей схеме:
В первой реакции
происходит дегидрирование при участии ФАД-зависимой дегидрогеназы. Затем
присоединение воды (гидроксил – в b-положение)
с образованием b-гидроксиацил-КоА.
Дегидрирование НАД-зависимой дегидрогеназой у
b-углеродного атома приводит к
образованию b-кетоацил-КоА.
Заключительный этап катализирует тиолаза, расщепляющая тиосвязь с
участием HS-Коэнзима-А, что приводит к
образованию ацетил-КоА и ацил-КоА с укороченной на два углеродных атома
цепью.
Ацетильный остаток
ацетил-КоА окисляется в цикле Кребса, укороченная жирная кислота
вовлекается в повторный цикл b-окисления.
В конечном счете, она распадается на такое количество остатков ацетила,
которое в два раза меньше числа атомов углерода в ней.
При окислении жирных
кислот с нечетным количеством углеродных атомов на последнем цикле
b-окисления образуется
ацетил-КоА и активная форма пропионовой кислоты (пропионил-КоА).
Пропионил-КоА карбоксилируется до метилмалонил-КоА и изомеризуется в
сукцинил-КоА. Последний поступает в ЦТК.
Состав и функции желчи
Желчь – это
одновременно и секрет и экскрет, выделяемый печенью. Как экскрет
выполняет функцию выведения из организма продуктов метаболизма, а как
секрет – участвует в пищеварении и обеспечении основных условий для
работы пищеварительных ферментов.
В печени коровы за
сутки образуется около 5 – 7 л желчи, у крупной собаки – 200 – 300 мл.
На 96 – 99% желчь состоит из воды. Сухой остаток состоит из желчных
кислот, холестерина, фосфолипидов, гормонов, некоторых иммунных белков (Ig A),
минеральных веществ. В переваривании липидов важнейшую функцию выполняют
желчные кислоты.
Желчные кислоты –
продукты конечного метаболизма холестерина. В печени образуются холевая
и хенодезоксихолевая кислоты (первичные), затем, под действием бактерий
кишечника они переходят в дезоксихолевую и литохолевую. Кроме того,
желчные кислоты конъюгируют с глицином или с таурином и образуют
гликохолевую, таурохолевую, гликодезоксихолевую и т.д.
Желчные кислоты, как
амфифильные соединения, ориентируются на границе жир-вода, погружаясь
гидрофобной частью молекулы в жир, а гидрофильной – в воду. Это приводит
к снижению поверхностного натяжения и дроблению капель жира. В итоге
увеличивается общая поверхность капель жира, что увеличивает контакт
жира с ферментами (по закону адсорбции), растворенными в водной среде.
Кроме того,
благодаря фосфатам и бикарбонатам желчи происходит нейтрализация кислоты
желудочного сока, что обеспечивает смещение рН в щелочную сторону (7,2 –
7,8). Таким образом, желчь и кишечный сок обеспечивают оптимальную для
работы ферментов среду.
После гидролиза
липидов и образования жирных кислот для их всасывания в кишечнике
желчные кислоты образуют конъюгаты с жирными кислотами и обеспечивается
транспорт такого комплекса через мембрану эпителиальных клеток. Желчные
кислоты (кроме литохолевой) и их конъюгаты постоянно участвуют в
печеночно-кишечном цикле (энтеро-портальная рециркуляция). Одна молекула
желчной кислоты может за сутки проходить 5 – 15 циклов.
Литохолевая кислота,
при первом же попадании в печень связывается с серной кислотой и более
не возвращается в портальную систему, а экскретируется с фекалиями.
Функции желчи:
—Эмульгирование жиров корма (за счет желчных кислот);
—Нейтрализация кислоты желудочного сока;
—Активация пищеварительных ферментов поджелудочной
железы и кишечного сока;
—Бактерицидное действие (неспецифические
Ig A);
—Активация моторики кишечника;
—Всасывание высших жирных кислот;
—Выведение продуктов обмена веществ из организма.
Окисление глицерина
На первом этапе этих превращений затрачивается энергия: глицерин вступает в реакцию с АТФ с образованием глицерофосфата и АДФ. На следующем этапе превращений происходит окисление фосфоглицерина и его превращение в фосфодиоксиацетон (рис. 42).
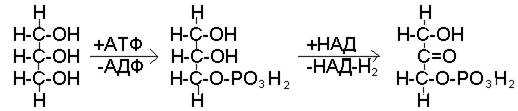
глицерин фосфоглицерин фосфодиоксиацетон
Рис. 42. Начальные этапы использования глицерина в качестве источника энергии
Перенос водорода с НАД-Н2, образующегося в ходе этой реакции, на кислород по цепи дыхательных ферментов сопряжен с ресинтезом трех молекул АТФ. Таким образом, не только компенсируются первоначальные затраты энергии, но и образуется две дополнительных молекулы АТФ.
Фосфодиоксиацетон преобразуется в свой изомер – фосфоглицериновый альдегид, дальнейшие превращения которого тождественны превращениям, происходящим в процессе окисления углеводов (рис. 43).
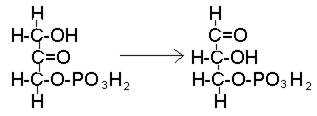
Рис. 43. Превращение фосфодиоксиацетона в фосфоглицериновый альдегид
Через несколько этапов он превращается в пировиноградную кислоту (ПВК), затем в ацетил-КоА, превращения которого завершаются в цикле трикарбоновых кислот (ЦТКК). Конечными продуктами окисления глицерина являются Н2О и СО2.
Глицерин является достаточно энергоемким веществом. При полном (до СО2и Н2О) окислении одной молекулы глицерина освобождается энергия, за счет которой может быть ресинтезирована 22 молекулы АТФ (с учетом затрат одной молекулы АТФ на начальном этапе превращений).
Дата добавления: 2015-10-29 ; просмотров: 12716 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Источник
Окисление глицерина
Глицерин сначала
фосфорилируется с участием АТФ до глицерофосфата (3-фосфоглицерол).
Затем под действием НАД-зависимой глицерофосфатдегидрогеназы окисляется
до 3-фосфоглицеринового альдегида. Фосфоглицериновый альдегид далее
может окисляться до пировиноградной и молочной кислоты.
Синтез жирных кислот
Синтез жирных кислот
протекает в цитозоле из Ацетил-КоА, образовавшегося в митохондриях при
гликолизе. Для использования ацетилкоэнзима-А в процессах, протекающих в
цитоплазме клетки, протекает ряд реакций для переноса Ацетил-КоА через
митохондриальную мембрану.
В митохондриях
ацетил-КоА взаимодействует со Щавелевоуксусной кислотой (ЩУК),
образуется лимонная кислота. В цитоплазме протекает обратный процесс.
Таким образом, в цитоплазме образуется Ацетил-КоА.
Для синтеза жирных
кислот протекает еще ряд последовательных реакций, образуется
малонил-КоА.
Ацетильная и малонильная группы переносятся на АПБ при участии ацетил-и
малонил-трансацилаз. АПБ — ацилпереносящий белок. Далее к Ацетил-АПБ
прибавляется Малонил-АПБ с образованием Ацетоацетил-АПБ. Наступает цакл
реакций, противоположных бета-окислению жирных кислот, но вместо КоА
носителем является АПБ, а вместо НАД и ФАД в процессах гидрирования
участвует НАДФН2.
Бутирил-АПБ вступает
в новый цикл (взаимодействует с малонил-АПБ), в результате которого
углеродная цепь удлиняется на 2 атома. Циклы повторяются, пока цепь
включит 16 атомов углерода (пальмитиновая кислота) или большего четного
числа.
Метаболизм кетоновых тел
Кетоновые тела,
являясь продуктами жирового обмена, выполняют в организме функцию
энергетического субстрата, т.е. источника энергии. К кетоновым телам
относят b-гидроксимасляную
кислоту, ацетоуксусную кислоту и, как конечный (тупиковый) продукт –
ацетон (диметилкетон). Это небольшие водорастворимые молекулы. Общая
концентрация кетоновых тел в крови млекопитающих составляет около 5 мг%
(у жвачных животных до 10 мг%). Синтезируются кетоновые тела в печени (в
гепатоцитах) из ацетил-КоА. У жвачных животных отмечают также синтез
кетоновых тел в слизистой оболочке преджелудков.
При выраженном
углеводном голодании (белковый и белково-жировой рацион с недостатком
углеводов), при нарушениях обмена углеводов (сахарный диабет) в
результате клеточного голодания усиливается распад и использование
жиров, что приводит к накоплению ацетил-КоА. Излишек молекул ацетил-КоА
вовлекается в синтез кетоновых тел. Резкое увеличение концентрации
кетоновых тел в крови приводит к развитию кетозов и кетоацидозов.
Для синтеза
кетоновых тел используется три молекулы ацетил-КоА. При конденсации двух
молекул ац.-КоА образуется ацетоацетил-КоА; затем добавление третьей
молекулы приводит к образованию b-гидрокси-b-метил-глютарил-КоА.
При этих реакциях освобождается две молекулы HS-КоА.
Полученная молекула b-гидрокси-b-метил-глютарил-КоА
под действием лиазы распадается на ацетоуксусную кислоту и ацетил-КоА.
Все указанные реакции протекают в матриксе митохондрий гепатоцитов.
В цитоплазме клеток
ацетоуксусная кислота при участии НАД-зависимой дегидрогеназы (НАДФ*Н2)
может восстанавливаться до b-гидроксимасляной
кислоты или спонтанно декарбоксилироваться с образованием ацетона
(диметилкетона).
Метаболизм фосфолипидов
К фосфолипидам
относятся глицерофосфолипиды – производные фосфатидной кислоты, и
сфингофосфолипиды.
Основными
компонентами фосфолипидов являются кефалин, лецитин, фосфатидилсерин и
сама фосфатидная кислота.
Метаболизм
фосфолипидов тесно связан со многими процессами в организме: образование
и разрушение мембранных структур клеток, формирование липротеинов,
мицелл желчи, образование в легочных альвеолах поверхностных пленок (сульфоктанта)
препятствующих слипание альвеол. Нарушение обмена фосфолипидов – причина
развития многих заболеваний (липидоз печени, респираторный
дистресс-синдром).
Превращение липидов в тканях
В тканях постоянно идут процессы распада и синтеза липидов. Основную массу липидов организма человека составляют ТГ, которые в клетке имеются в виде включений. Период обновления ТГ в разных тканях составляет в среднем от 2 до 18 суток. Распад липидов происходит в лизосомах, в меньшей степени в микросомах и цитоплазме клеток при участии тканевых липаз. В результате тканевого липолиза образуются общие метаболиты: глицерин и ВЖК, окисление которых до конечных продуктов (воды и углекислого газа) сопровождается выделением большого количества энергии в виде АТФ.
Окисление глицерина в тканях тесно связано с гликолизом и гексодифосфатным путём путем превращения глюкозы, в который вовлекаются метаболиты глицерина по следующей схеме:
киназа ↓ АТФ АДФ
дегидрогеназа ↓ НАД НАДН2, Н2О, 3АТФ
дегидрогеназа, +Н3РО4 ↓ НАД НАДН2
дифосфоглицераткиназа ↓ АДФАТФ
фосфоглицеромутаза ↓
енолаза ↓
фосфоенолпируваткиназа ↓ АДФАТФ
+ HS-KoA, -СО2, |
ТПФ, липоевая кислота ↓ НАДНАДН2
Энергетический эффект окисления глицерина: АТФ=(3+3+1+1+3+12)-1=22
Таким образом, энергетический эффект окисления 1 молекулы глицерина в кислородных условиях составляет 22 молекулы АТФ.
Окисление ВЖК в тканях изучал Кнопп (1904г), который показал, что процесс окисления ВЖК до конечных продуктов циклический. Он назвал окисление ВЖК -окислением.
Все ВЖК, имеющие чётное количество углеродных звеньев в цепи, обязательно окисляясь, укорачиваются в результате 1 бета цикла на 2 углеродных звена и проходят последнюю стадию превращения масляной кислоты, которая имеет свои особенности.
Ленинджером в 1949 году было установлено, что окисление ВЖК идет в митохондриях. Линнен в 1954 году установил, что -окисление в тканях сопровождается укорочением ВЖК на 2 углеродных звена. В дальнейшем Ац-КоА окисляется до конечных продуктов в ЦТК. Линнен описал все стадии окисления ВЖК. В наше время -окисление ВЖК в тканях называется циклом Кноппа-Линнена.
Установлено, что процесс -окисления начинается в цитоплазме клеток с активации ВЖК. Биомембраны митохондрий для ВЖК не проницаемы и их транспорт внутрь митохондрий возможен только при участии азотистого основания – карнитина. Ацил-КоА в цитоплазме соединяется с карнитином при участии трансферазы. Образовавшийся комплекс ацил-карнитин легко проникает в митохондрии. В межмембранном пространстве уже при участии митохондриальных трансфераз этот комплекс распадается. Карнитин возвращается в цитозоль, а ВЖК подвергается окислению в матрице. Т.о. карнитин выполняет роль челнока для ВЖК между цитоплазмой и митохондриями.
Так идет окисление всех ВЖК. В результате одного -цикла выделяется 5 молекул АТФ, АцКоА включается в ЦТК и дает еще 12 молекул АТФ. Т.о. в результате окисления 2-х углеродных атомов цепи ВЖК выделяется 17 молекул АТФ.
Окисление масляной кислоты.
Масляная кислота бутирил-КоА кротонил-КоА -гидроксибутирил-КоА ацетоацетил-КоА. Особенность последней стадии окисления ВЖК в том, что в тиолазной реакции образуется 2 молекулы Ац-КоА, одна из которых не проходила начальный этап -окисления с выделением 5 молекул АТФ.
АТФ(ВЖК)=n/2*17-6, где:
n – количество углеродных звеньев ВЖК;
17 — количество молекул АТФ, выделяющееся в результате 1 бета цикла окисления (12 – ЦТК, 5 – само -окисление);
6 (1+5): 1 — та молекула АТФ, которая поглощается при активировании ВЖК;
5 – количество АТФ, которые не выделяются на последней стадиях окисления при превращении масляной кислоты.
Окисление ВЖК, имеющих нечётное количество углеродных звеньев.
Такие ВЖК поступают в организм человека с пищей морских организмов, растений, мяса жвачных животных и растений. Окисление происходит также, как и ВЖК, имеющих чётное число углеродных звеньев, но только до последней стадии, когда образуется пропионил-КоА.
CH3-CH2-COSKoA (это пропионил-КоА) (карбоксилаза, биотин), +СО2, +Н2О, АТФАДФ+Фн) СООН-СН(СН3)-СOSKoA (это метитмалонил-КоА) (мутаза) СООН-СН2-СН2-СOSKoA (это сукцинил-КоА)
Образующийся сукцинил-КоА является одним из метаболитов ЦТК, куда он вовлекается для своего дальнейшего окисления.
ВЖК, окисляясь в клетке, дают большое количество энергии в виде макроэргических связей в молекулах АТФ, которая (энергия) используется мышцами (сердечной, скелетными), нервной тканью, при длительных физических нагрузках, в стрессовых ситуациях.
Биосинтез глицерофосфолипидов
Фосфолипиды
синтезируются во всех клетках, содержащих ядро. Существует несколько
путей синтеза глицерофосфолипидов. Рассмотрим синтез фосфатидилсерина и
кефалина из фосфатидной кислоты и синтез лецитина из диглицерида и
холина.
Прежде чем холин
вступит в синтез лецитина, происходит фосфорилирование холина и
присоединение холина к нуклеотиду. При взаимодействии диацилглицерола с
ЦДФ-холином синтезируется лецитин и освобождается цитидинмонофосфат (ЦМФ).
При отсутствии
готового холина синтез фосфолипидов происходит на основе фосфатидной
кислоты и аминокислоты серина, образуется фосфотидилсерин.
При
декарбоксилировании фосфатидилсерина образуется кефалин. Для синтеза
лецитина из кефалина необходимо присоединить к азоту три метильных
радикала. Источником метильных радикалов служит метионин в активной
форме (S-аденозилматионин) с которого фермент
метилтрансфераза переносит группу -CH3
на кефалин.
Метаболизм холестерина
Холестерин (Холестерол)
представляет собой одноатомный спирт. Включает кольца
циклопентанпергидрофенантрена и 8-углеродную боковую цепь.
Функции
холестерола: 1) структурный компонент клеточных мембран; 2)
предшественник в синтезе других стероидов (гормонов, витамина Д, желчных
кислот).
Источники
холестерола: пища животного происхождения и биосинтез. Стерины
растительного происхождения (фитостерины) в отличие от холестерола в
кишечнике животных не всасываются и выделяются с фекалиями.
В крови животных
холестерол находится в составе липопротеинов. При этом около 30% —
свободного и около 70% — этерифицированного (связанного с жирными
кислотами) холестерина. В желчи холестерол содержится в безбелковом
состоянии, при этом его растворимость поддерживается за счет присутствия
большого количества фосфолипидов (лецитина). По-этому при нарушении
обмена фосфолипидов холестерин желчи выпадает в осадок и формирует
желчные камни.
Около 20 – 30
процентов холестерола поступает в организм из рациона. Остальные 70 –
80% синтезируется. Основное место биосинтеза – печень и лишь около 10 –
20 % всего биосинтеза стеринов наблюдается в клетках кишечника, кожи и
надпочечников.
Выводится из
организма холестерол через кишечник с калом как в виде желчных кислот,
так и в свободной форме и в форме эфиров.
Клинико-диагностическое значение
Кетоновые тела, являясь нормальными метаболитами
жирового обмена у здоровых животных всегда присутствуют в крови.
Концентрация их в крови составляет около 5 мг% (для жвачных животных до
10 мг%). При увеличении концентрации кетоновых тел в в крови закономерно
растет содержание их во всех секретах и экскретах организма, и, в том
числе в молоке и в моче. Т.е. гиперкетонемия всегда сопровождается
гиперкетонурией, лактокетозом и т.д. Состояние организма,
сопровождающееся накоплением кетоновых тел называется кетозом или
кетоацидозом (кетоновые тела, являясь кислотами, приводят к истощению
буферных систем организма вплоть до смещения рН в кислую сторону).
Кетозы сельскохозяйственных животных наиболее
часто встречаются у жвачных (коровы, овцы, козы). Развиваются кетозы
жвачных при несбалансированном кормлении на фоне закисления кормов
(недоброкачественный силос, сенаж) и недостаточности углеводов
(высоко-концентратный тип кормления). Наиболее подвержены развитию
данной болезни высоко продуктивные животные, обычно хорошо упитанные.
У мелких домашних животных (кошки, собаки)
кетоацидозы обычно вторичны, являются осложнением других болезней
(сахарный диабет, панкреатит). Вызвано развитие кетоацидозов нарушением
использования глюкозы как энергетического субстрата, что приводит к
увеличению продукции ацетил-КоА и кетоновых тел при активации окисления
жирных кислот.
Тяжелые кетозы являются состоянием, угрожающим
жизни. Так именно кетоацидоз при сахарном диабете является наиболее
частой причиной гибели диабетических больных. При этом концентрация
кетоновых тел в сыворотке крови больше 100 мг%.
Приложение
Физиологические
показатели жирового обмена у домашних и сельскохозяйственных животных.
|
Биохимический показатель |
коровы |
свиньи |
лошади |
собаки |
кошки |
|
Общие липиды в сыворотке крови (г/л) |
2,5 – |
4 – 12 |
1,6– |
7 – 15 |
6 – 13 |
|
Общий холестерин в сыворотке крови (ммоль/л) |
1,3 – |
2 – |
1,8– |
3 – |
1,8– |
|
Кетоновые тела в сыворотке крови (мг%) |
1,1– |
0,5– |
отр. |
1,8– |
отр. |
|
Триглицериды в сыворотке крови (ммоль/л) |
0,2– |
0,2– |
1,1– |
0,5– |
0,5– |
|
Летучие жирные кислоты в сыворотке крови (моль/л) |
0,1– |
— |
— |
— |
— |
Литература
1.
Авдеева Л.В., Алейникова Т.Л., Белушкина Н.Н. и др., Биохимические
основы патологических процессов. /под редакцией Северина Е.С., М., 2000,
304 с.
2.
Зайцев С.Ю., Конопатов Ю.В., Биохимия животных. СПб, 2004, 384 с.
3.Клаус
Бикхардт, Клиническая ветеринарная патофизиология. М., 2001, 400 с.
4.
Конопатов Ю.В., Рудаков В.В., Пилаева Н.В. и др., Методические указания
к лабораторным занятиям по биохимии. СПб., 1994, 44 с.
5.
Пилаева Н.В., Фёдоров Б.М., Карпенко Л.Ю. и др., Биологическая химия.
/методические указания к лабораторным занятиям по биохимии для студентов
ветеринарных факультетов и врачей ФПК. СПб., 2002, 67 с.
6.
Рубин В.И., Ларский Э.Г., Орлова Л.С., Биохимические методы исследования
в клинике. Саратов, 1980, 321 с.
Переваривание и всасывание фосфолипидов
Переваривание и
всасывание фосфолипидов, поступающих с кормом сходно с триглицеридами.
Отличием является то, что в поджелудочной железе синтезируется
специфические ферменты – фосфолипазы A1,
А2, C и D.
Таким образом, в
кишечнике под действием фосфолипаз поджелудочной железы фосфолипиды (в
частности лецитин) гидролизуются до свободного глицерина, двух молекул
жирных кислот, ортофосфорной кислоты и аминоспирта или аминокислоты (в
частности холина из лецитина, этаноламина из кефалина и серина из
фосфатидилсерина).
Всасывание глицерина
и жирных кислот рассмотрено раннее. Фосфорная кислота всасывается в виде
натриевых и калиевых солей. Всасывание аминоспиртов происходит в
комплекса с нуклеотидами – цитидиндофосфаты в виде Цитидиндифосфохолина
(ЦДФ-холин), ЦДФ-этаноламина.
Всасывание и транспорт жирных кислот и глицерина
Жирные кислоты с
длиной углеродной цепи менее 11 способны к самостоятельному всасыванию
через стенку кишечника в лимфу. Более крупные молекулы усваиваются в
комплексе с желчными кислотами.
Глицерин –
трехатомный спирт, водорастворим и легко всасывается из кишечника и по
воротной вене поступает в печень.
Комплекс из 2-3
молекул желчных кислот и жирной кислоты в стенке кишечника распадается.
После чего в стенке кишки происходит синтез (ресинтез) триглицеридов.
Транспорт липидов в крови и лимфе.
Липиды нерастворимы
в воде, а, следовательно, и в крови, поэтому весь транспорт липидов в
организме животных тесно связан с белками. Транспорт липидов
осуществляется в комплексе с белками в виде липопротеинов.
Все липопротеины
имеют сходное строение. В центре гидрофобное ядро (где и находится
триацилглицерол) и гидрофильный слой на поверхности. Гидрофильный слой
представлен гидрофильными участками белков (апопротеинов) и амфифильными
молекулами липидов (фосфолипидами и холестеролом), гидрофобные части
которых погружены в гидрофобное ядро.
По плотности и
размеру частиц липопротеины крови разделяют на хиломикроны (ХМ),
липопротеины очень низкой плотности (ЛПОНП), липопротеины низкой
плотности (ЛПНП), липопротеины высокой плотности (ЛПВП).
Экзогенные
триглицеролы после всасывания в кишечнике ресинтезируются.
Синтезированные в стенке кишечника триглицериды, ввиду своих размеров
попадают преимущественно в лимфатическую систему, и лишь некоторое
количество поступает в портальный кровоток. В лимфе и крови триглицериды
связываются с белком. Таким образом, формируются мельчайшие капли –
хиломикроны. Хиломикроны – самые крупные из липопротеинов крови, диаметр
их более 120 нм. Однако при этом хиломикроны имеют низкую плотность
(0,92-0,98 г/мл). Триацилглицеролы составляют до 85% всей массы ХМ.
ЛПОНП синтезируются
в печени. Как и хиломикроны обеспечивают транспорт триглицеридов,
которые составляют 50% массы ЛПОНП.
Под действием
мембранного фермента эндотелиоцитов – липопротеинлипазы из ХМ и ЛПОНП
извлекаются триглицериды на метаболические нужды тканей и липопротеины
увеличиваются по плотности. Таким образом, формируются ЛПНП и ЛПВП.
Основная функция последних, транспорт холестерола и фосфолипидов. ЛПНП и
ЛПВП поглощаются путем эндоцитоза клетками печени, кишечника, жировой
ткани, почек и надпочечников. Следует отметить, что ЛПНП обеспечивают
транспорт холестерола к тканям, а ЛПВП – от тканей к печени.
Синтез триглицеридов
Триглицериды
синтезируются в стенке кишечника, в печени и жировой ткани (в адипоцитах).
Синтез триглицеридов
в стенке кишечника может происходить из моноглицерида (из
2-моноацилглицерола) и двух молекул активных жирных кислот (остатки
жирных кислот в комплексе с ацилпереносящим энзимом –
S-КоА), или из глицерина и трех молекул активных жирных кислот с
участием АТФ, что более характерно для процессов в печени и жировой
ткани.
Синтез жира из
глицерина и жирных кислот в печени и жировой ткани происходит по
следующему пути. Глицерин фосфорилируется с использованием АТФ до
глицерофосфата (фермент глицеролкиназа), затем под действием фермента
глицеролфосфатацилтрансферазы взаимодействует с двумя молекулами
ацилкоэнзима-А (например, с пальмитил-КоА). Образуется фосфатидная
кислота (3-фосфо-1,2-диацилглицерол). При взаимодействии последней с
ацилкоэнзимом-А образуется триглицерид, свободный HS-КоА
и остаток ортофосфорной кислоты.
Печень – основной
орган, где идет синтез жирных кислот из продуктов гликолиза. Основной
путь синтеза триглицелидов в печени из жирных кислот и глицерофосфата.
Глицерофосфат, в свою очередь, в печень поступает из гидролиза жиров, а
так же при восстановлении диоксиацетонфосфата (из гликолиза) при помощи
восстановленного НАДФ (НАДФ Н+Н).
Окисление жирных кислот и глицерина
Как уже указывалось
ранее, нейтральные жиры (триацилглицеролы или триглицериды) являются
важнейшим энергетическим субстратом для организма. Следовательно, они
подвергаются процессам окисления с целью получения энергии. Нейтральный
жир в клетке подвергается гидролизу, а затем жирные кислоты и глицерин
окисляются, что сопровождается синтезом АТФ.
4.7. Обмен холестерина
Холестерин является предшественником в синтезе стероидов: желчных кислот, стероидных гормонов, витамина D3.Холестерин является обязательным структурным компонентом мембран клеток. Источниками холестерина для клеток является пища (экзогенный холестерин), а также холестерин, синтезированный в печени, кишечнике, коже (эндогенный холестерин). На долю печени приходится около 85% всего эндогенного холестерина. кишечнике синтезируется около 10% а,коже-5% эндогенного холестерина. Печень и кишечник участвуют в распределении холестерина между клетками органов и ткани через транспортные липопротеины крови.
Биологическая роль холестерина:
1.Структурная. Свободный холестерин является, обязательным структурным компонентом мембран клеток.
2.Метаболическая. Холестерин является предшественником биологически активных веществ: витамина D3
СТЕРОИДНЫХ гормонов (АНДРОГЕНОВ, ЭСТРОГЕНОВ, КОРТИКОИДОВ) При окислении холестерина в печени при участии ЦИТОХРОМА Р-450 образуются желчные кислоты, которые принимают участие в переваривании жиров пищи. Наиболее богаты холестерином плазматические мембраны ГЕПАТОЦИТОВ, где на его долю приходится 30% всех мембранных липидов. Содержание холестерина в миелине составляет 20%. В свободном виде холестерин транспортируется по организму с помощью транспортных ЛИПОПРОТЕИНОВ крови.
1. Пища. За сутки в организм взрослого человека поступает 0,3гр. холестерина.
2. У человека в среднем с массой 65-70кг за сутки синтезируется 3.5 -4,2гр. холестерина. Печень занимает главное место в синтезе холестерина (85%), в меньшей степени холестерин синтезируется в кишечнике (10%) и коже (5%). На экспорт холестерин синтезируется только в печени и кишечнике.
Процесс биосинтеза сложный и многоступенчатый, происходит в цитоплазме клеток. В нём участвуют более 100 ферментов, включает 35 уравнений химических реакций.
Биосинтез холестерина можно разделить на 3 стадии:
1.-биосинтез мевалоновой кислоты;
3.-циклизация сквалена и образование холестерина
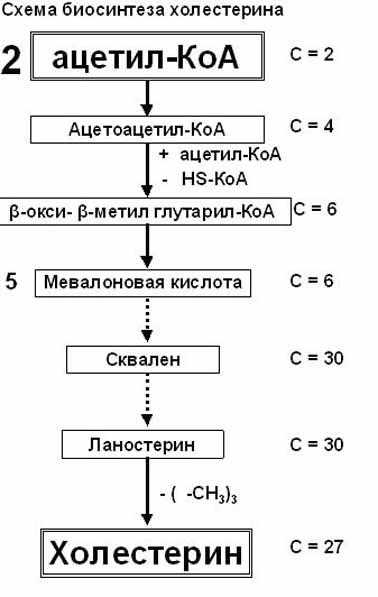
рис. Биосинтез холестерина
Регуляторным ферментом, от активности которого зависит возможность и интенсивность биосинтеза холестерина является бета-гидроксиметил-глутарил — КоА –редуктаза.
Этот фермент является объектом действия лекарственных гипохолестеринемических препаратов.
Источником образования холестерина является ацетил-КоА при распаде белков, липидов и углеводов
Образовавшийся в результате распада мембранных ЛИПИДОВ, а также излишки холестерина клеток выводятся с помощью ЛПВП для последующего окисления в печень.Конечными продуктами окисления холестерина и его производных являются желчные кислоты,которые удаляется из организма в составе каловых масс в виде КОПРОСТЕРИНОВ.
Источник






























