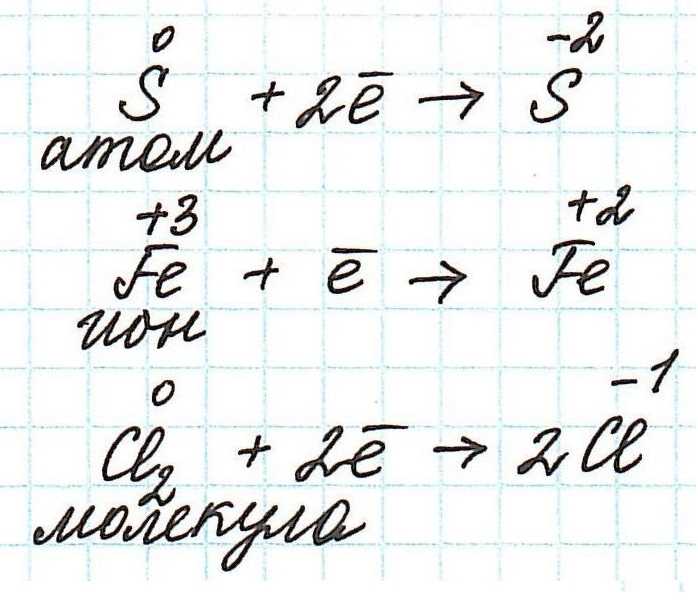2NaCl —> 2Na+ + 2Cl– —электролиз—> 2Na0 + Cl20
Если электролизу подвергается расплав, который содержит несколько
различных катионов металлов, то в этом случае последовательность
восстановления определяется электродными потенциалами металлов в данных
условиях. При этом в первую очередь восстанавливаются катионы металлов,
обладающих большим значением электродного потенциала.
Окислительно-восстановительное действие электрического тока может
быть во много раз сильнее действия химических окислителей и восстановителей.
Меняя напряжение на электродах, можно создать почти любой силы окислители
и восстановители, которыми являются электроды электролитической ванны или
электролизера. Известно, что ни один самый сильный химический окислитель не
может отнять у фторид-иона F– его электрон. Но это осуществимо
при электролизе, например, расплава соли NaF или CaF2. В этом
случае на катоде (восстановитель) выделяется из ионного состояния металлический
натрий или кальций:
Окислители, восстановители. Окисление, восстановление
Итак, окисление – это процесс, в ходе которого частица передает свои электроны другой частице. В качестве таких частиц могут выступать отдельные атомы или ионы, а также молекулы.
Частица, передающая свои электроны, является восстановителем.
Переход электронов принято показывать с помощью :
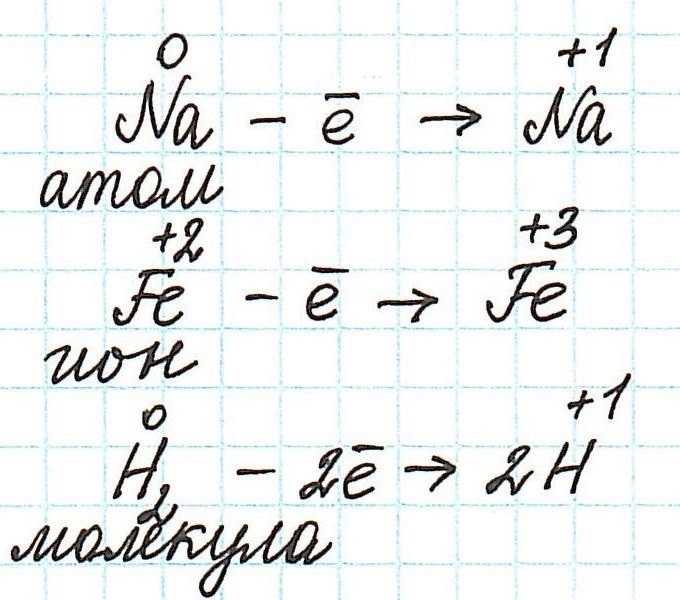
Как не сложно заметить из представленных полуреакций, окислительный процесс приводит к увеличению степени окисления.
А вот восстановление, по сути, противоположно окислению. В его основе – принятие электронов одной частицей от другой.
Частица, принимающая электроны, является окислителем.
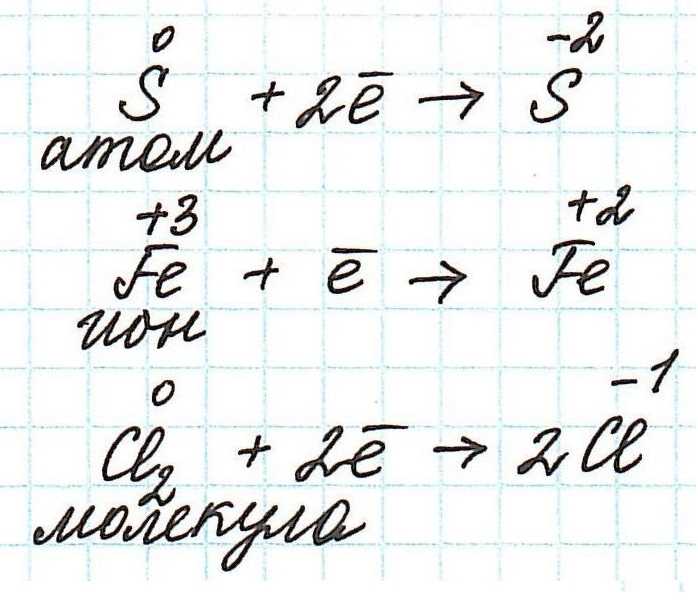
Восстановление всегда сопровождается уменьшением степени окисления!
Итак, запомним:
Способность к окислению и восстановлению: как определить
Существует несколько закономерностей, которые помогают определить наличие у частицы (атома, иона, молекулы) способности окисляться или восстанавливаться. Обратимся к
1) В периодах слева направо (т.е. с повышением порядкового номера элемента) восстановительные свойства простых веществ уменьшаются, а окислительные увеличиваются:
То есть в начале периода находятся явные восстановители, а в конце – окислители. Например, в III периоде активным восстановителем является натрий, а активным окислителем – хлор.
А причина данной закономерности кроется в строении атомов элементов.
У атомов элементов одного периода:
- количество энергетических уровней остается постоянным (так, у элементов III периода их три);
- число электронов внешнего уровня растет (например, от 1 электрона у натрия и до 7 электронов у хлора).
В связи с этим растет и сила притяжения электронов к ядру. В результате радиус атома уменьшается.
У элементов конца периода эта сила велика. Поэтому атомы очень трудно отдают свои электроны в химических взаимодействиях и легче принимают их от других атомов, стремясь завершить внешний энергетический уровень. Так проявляются их окислительные свойства.
Атомам элементов начала периода для завершения внешнего уровня до устойчивого 8-электронного состояния легче отдать свои немногочисленные электроны, проявив тем самым восстановительные свойства.
2) Элементы побочных подгрупп (это металлы четных рядов больших периодов) на внешнем уровне имеют 2 или 3 (реже 1 в случае «провала») электрона, поэтому легко могут их отдавать, являясь, таким образом, восстановителями:
3) Элементы одной главной подгруппы имеют одинаковое число электронов на внешнем энергетическом уровне (например, элементы VI группы – шесть электронов). Число же энергетических уровней увеличивается и, соответственно, радиусы атомов тоже увеличиваются. Это приводит к тому, что электроны внешних уровней удаляются от ядра и притяжение их к нему ослабевает.
Вот именно поэтому, восстановительная способность (способность отдавать электроны) у элементов главных подгрупп сверху вниз растет, а окислительная способность (способность принимать электроны) снижается:
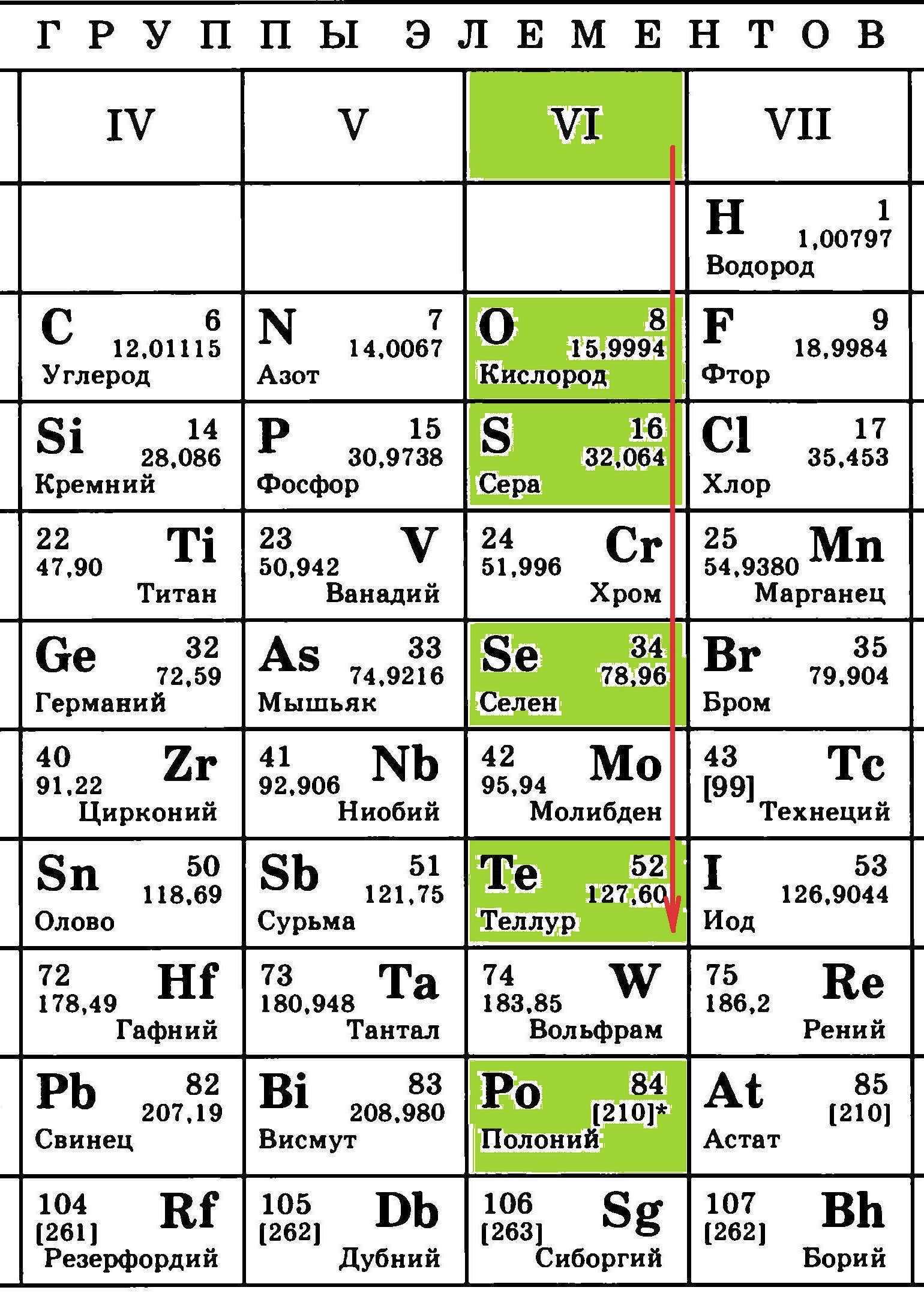
Так, среди элементов главной подгруппы VI группы окислительная способность сильнее всего проявляется у кислорода, а теллур в некоторых взаимодействиях способен проявлять восстановительные свойства.
4) Определить, чем будет являться частица (или вещество, в состав которого она входит) в окислительно-восстановительном процессе, можно по значению степени окисления (с.о.).
Если атомы имеют самую наименьшую с.о., то проявят они восстановительные свойства. Если самую высокую – то окислительные. А если с.о. является промежуточной по значению, то проявят как те, так и другие свойства (в зависимости от конкретных условий химической реакции). Например:
2H+ + SO42– = H2SO4
Таким образом на катоде выделяется водород, а на
аноде — кислород; в катодном пространстве получается гидроксид натрия, в
анодном пространстве серная кислота. При смещении растворов (католита и
анолита) получится Na2SO4 и H2O. Следовательно,
количества ионов натрия и SO42– остаются неизменными
(соль не расходуется), т. е. в данном случае при электролизе водного
раствора Na2SO4 происходит разложение воды.
Электролиз водного раствора соли, образованной активным
металлом и бескислородной кислотой.
В качестве примера рассмотрим электролиз водного раствора йодида
калия KI с угольными электродами. Йодид калия в водном растворе содержит
ионы K+ и I–. Катодный процесс аналогичен катодному
процессу при электролизе Na2SO4. На аноде отрицательно
заряженные ионы йода притягиваются к нему и, отдавая свои электроны,
превращаются в молекулярный йод. Следовательно, на катоде выделяется
водород, а на аноде йод.
Электролиз раствора соли малоактивного металла с анодом из
того же металла.
Рассмотрим электролиз водного раствора сульфата меди CuSO4
с анодом из неочищенной меди. Стандартный потенциал меди Cu/Cu2+E=+0,337 В, т. е. значительно больше, чем потенциал
процесса восстановления молекул воды E=–0,83 В. Поэтому
при электролизе нейтрального раствора CuSO4 на катоде происходит
разряд ионов Cu2+ и выделение меди. На аноде протекает противоположный
процесс — окисление металла меди, так как потенциал меди много меньше
потенциала окисления воды, а тем более – потенциала окисления иона SO42–.
Таким образом, при электролизе CuSO4 на катоде осаждается
чистая медь – происходит восстановление катионов меди из раствора, а
примеси остаются в растворе, и одновременно – растворение (окисление)
металла анода. Этот случай электролиза применяется для очистки металлов.
Законы электролиза.
Количественные соотношения при электролизе между выделившимся веществом
и прошедшим через электролит электричеством выражаются двумя законами
Фарадея.
I закон Фарадея. Количества веществ, выделяющихся на электродах
при электролизе, прямо пропорциональны количеству электричества, прошедшего
через электролит. Количество вещества, выделяющегося при прохождении
через электролит 1 кулона электричества, называется электрохимическим
эквивалентом.
II закон Фарадея. Количества веществ, выделившихся на электродах
при прохождении одинакового количества электричества, прямо пропорциональны
их химическим эквивалентам. Следовательно, для восстановления на катоде
и окисления на аноде одного грамм-эквивалента любого вещества необходимо
затратить одно и то же количество электричества, а именно 96487 кулонов.
Эта константа называется числом Фарадея и обозначается буквой F. Из
законов Фарадея вытекает
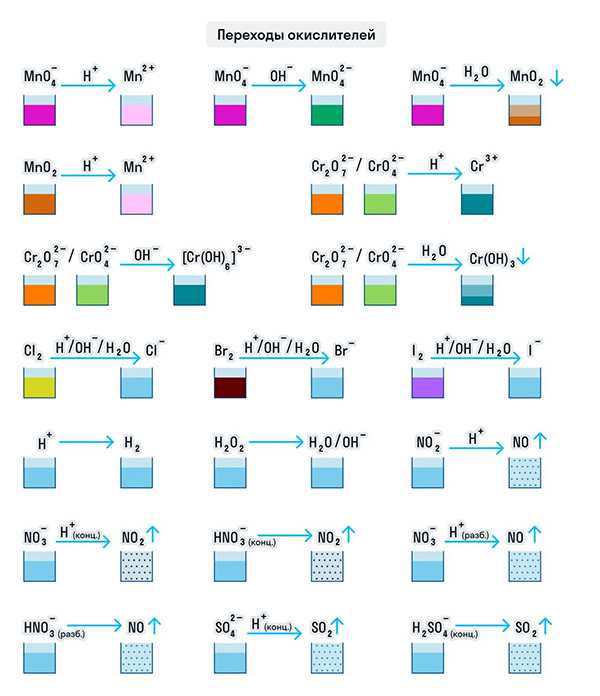
Примеры веществ-окислителей
Только окислителями могут быть элементы в высшей своей степени окисления. Например, S+6 в серной кислоте (H2SO4), N+5 в азотной кислоте (HNO3) или солях-нитратах, Cr+6 в хроматах (CrO42−) и дихроматах (Cr2O72−) соответственно, а также Mn+7 (MnO4−).
В зависимости от среды проведения реакции Mn+7 и Cr+6 ведут себя по-разному. Рассмотрим на схемах:
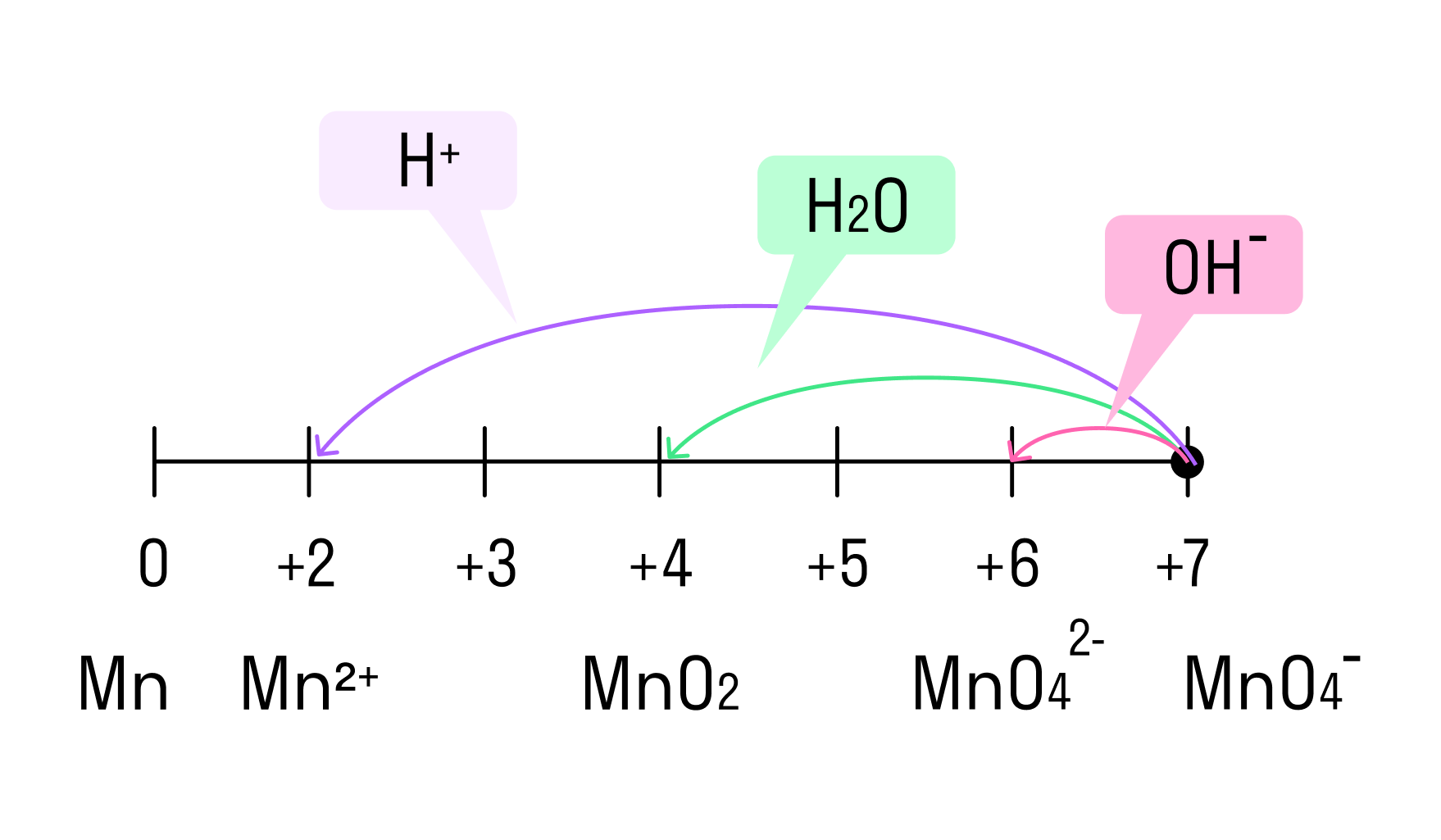
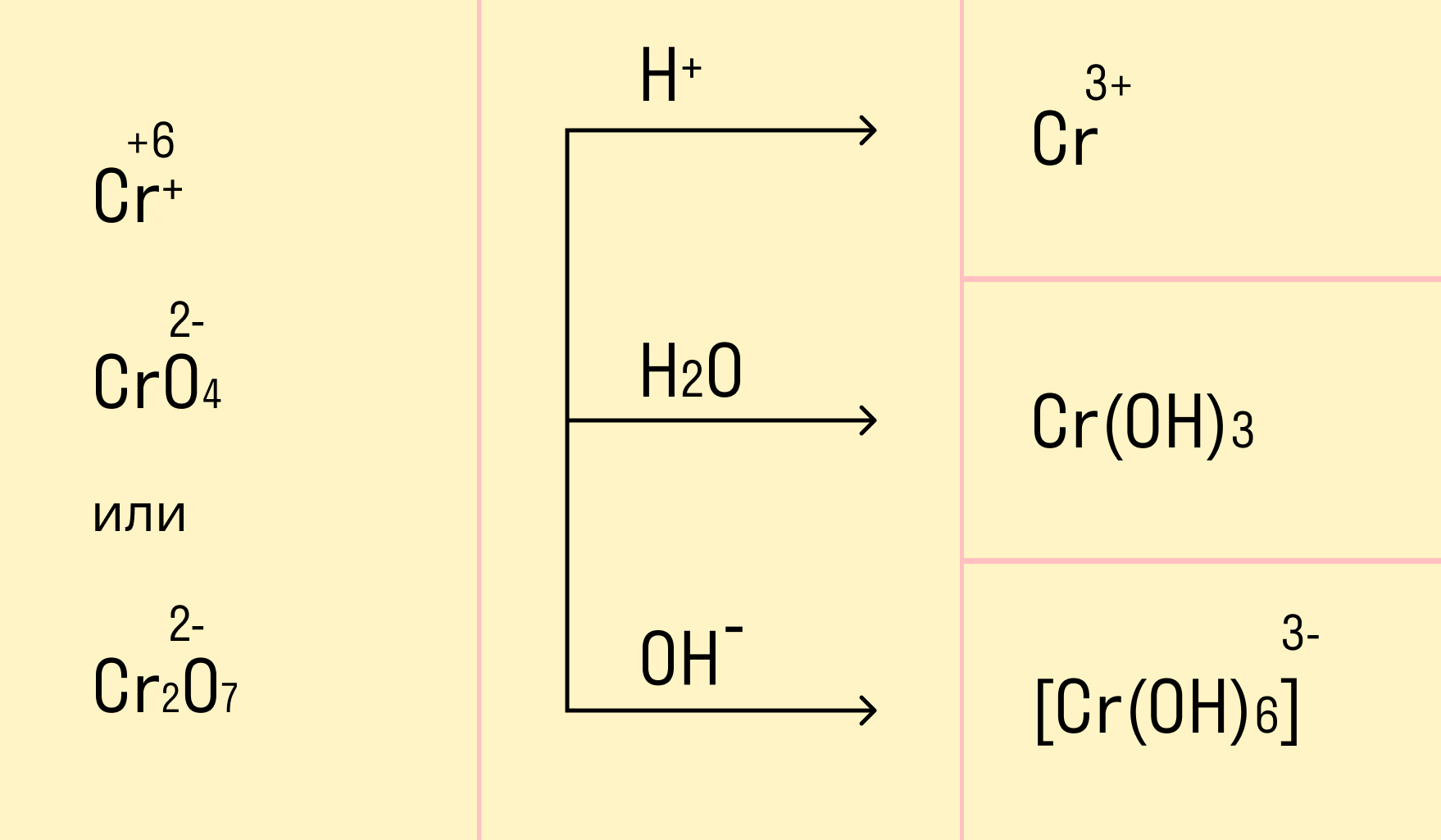
И марганец, и хром в кислой среде (H+) образуют соли той кислоты, которая образовывала среду. В нейтральной среде (H2O) марганец превращается в оксид бурого цвета, а хром — в серо-зеленый нерастворимый в воде гидроксид. В щелочной среде (OH−) марганец превращается в манганат (MnO42−), а хром — в комплексное соединение светло-зеленого цвета.
Только окислителями могут быть простые вещества-неметаллы. Например, представители VIIA группы — галогены. Проявляя окислительные свойства в кислой среде, галогены восстанавливаются до соответствующих им галогеноводородных кислот: HF, HCl, HBr, HI. В щелочной среде образуются соли галогеноводородных кислот.
Кислород превращается в анион с устойчивой степенью окисления −2. А сера ведет себя как окислитель по отношению к водороду и металлам, образуя при этом сероводород и сульфиды.
Только окислителями могут быть и протон водорода (H+) и катионы металлов в их высших степенях окисления при нескольких возможных. Ион Н+ при взаимодействии с восстановителями переходит в газообразный водород (H2), а катионы металлов — в ионы с более низкой степенью окисления: 2CuCl2 + 2KI = CuCl + 2KCl + I2.
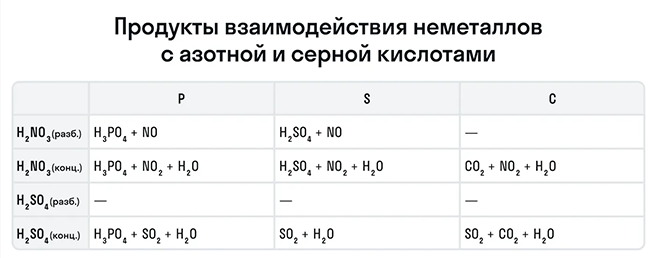
Рассмотрим как ведут себя сильные кислоты-окислители — азотная и серная. В зависимости от их концентрации меняются и продукты реакции.
Запоминаем!
Разбавленная азотная кислота никогда не реагирует с металлами с выделением водорода в отличие от разбавленной серной кислоты. Обе эти кислоты реагируют с металлами, стоящими в ряду активности после водорода.
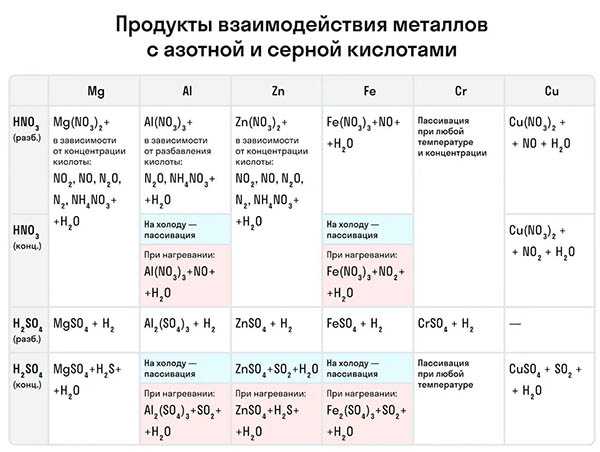
Эти кислоты проявляют окислительные способности и с некоторыми неметаллами, окисляя их до соответствующих кислот в высшей степени окисления неметалла-восстановителя.
Для удобства мы собрали цвета переходов важнейших веществ-окислителей в одном месте.
Выберите идеального репетитора по химии
15 000+ проверенных преподавателей со средним рейтингом 4,8. Учтём ваш график и цель обучения
Выбрать!

Коррозия металлов и способы защиты от нее
Коррозией металла называют процесс его самопроизвольного разрушения в результате контакта с окружающей средой.
Коррозия бывает химическая и электрохимическая.
Химическая коррозия — вид коррозии, при котором металл разрушается из-за его взаимодействия с газами или жидкостями, не проводящими электрический ток. Так, например, к химической коррозии относится образование окалины при взаимодействии железа с кислородом при высоких температурах, а также разрушение металлического оборудования под действием нефтяных фракций, содержащих сернистые соединения.
Электрохимической коррозией называют разрушение металла в растворе электролита вследствие возникновения в данной системе электрических токов. Электрические токи, способствующие коррозии, возникают в тех случаях, когда в растворе электролита изделие из металла контактирует с другим менее активным металлом. Также такие токи могут появляться из-за химической неоднородности металлического материала, из которого выполнено изделие.
Так, например, из-за электрохимической коррозии страдают подводные части судов, паровые котлы, трубопроводы, металлические конструкции в почве и т.д.
Способы защиты металлов от коррозии
1) Контроль условий, в которых эксплуатируется металлическое оборудование. Например, хранение и использование изделий из стали на открытом воздухе нежелательно и этого, по возможности, следует избегать. Эксплуатация металлического оборудования в помещениях с низкой влажностью существенно продлит его срок службы.
2) Создание защитных покрытий, изолирующих металлоконструкцию от контакта с окружающей средой. Среди таких покрытий различают:
— неметаллические покрытия — всевозможные краски, лаки, эмали, а также пленки из таких полимеров, как полиэтилен, поливинилхлорид и т.д.;
— химические покрытия (оксидные, нитридные, фосфатные и т.д.) (Такие покрытия получают специальной химической обработкой поверхности металла.);
— металлические покрытия.
Металлические покрытия получают нанесением на защищаемую металлическую конструкцию тонкого слоя другого металла (чаще всего с помощью процесса электролиза).
При этом, если в качестве покрытия используется менее активный металл, то такое покрытие будет защищать металлоконструкцию только при условии его целостности. В случае, если целостность такого покрытия будет нарушена, защищаемый металл будет ускоренно корродировать.
Также широко используется покрытие металлоконструкций более активным металлом. Например, распространено использование так называемого оцинкованного железа. Такое покрытие защищает металлические объекты даже при нарушении его целостности, поскольку пока практически полностью не исчезнет слой покрытия из более активного металла, коррозия металла, из которого сделан защищаемый объект, не начнется.
3) Электрохимические методы защиты:
— катодная защита — вид защиты, при котором металлический объект подключается с помощью проводников к катоду внешнего источника тока либо же приводится в контакт с более активным металлом.
Частный случай катодной защиты, при котором металлическая конструкция приводится в контакт с более активным металлом, называют протекторной защитой.
4) Изменение химических свойств среды, в которой эксплуатируется металлическое изделие, в частности:
— добавление в среду веществ, замедляющих коррозию (ингибиторов коррозии).
— дегазация среды (удаление растворенных в ней газов, в частности, кислорода). Например, такой метод работает для защиты от ржавления железа, поскольку в процессе ржавления железа активное участие принимает не только вода, но и кислород:
4Fe + 6H2O + 3O2 = 4Fe(OH)3
Сильные или слабые окислители и восстановители: как определить
Часто говорят: сильный окислитель, слабый окислитель, сильный восстановитель, слабый восстановитель. А что это значит? И как определить эту самую силу?
Мерой окислительно-восстановительной способности вещества служит значение стандартного электродного потенциала: чем оно больше, тем и окислительные свойства проявляются сильнее.
Обратимся к таблице стандартных электродных потенциалов. В ней значения потенциалов расположены в порядке уменьшения:Значения восстановительных стандартных потенциалов фтора и лития таковы:
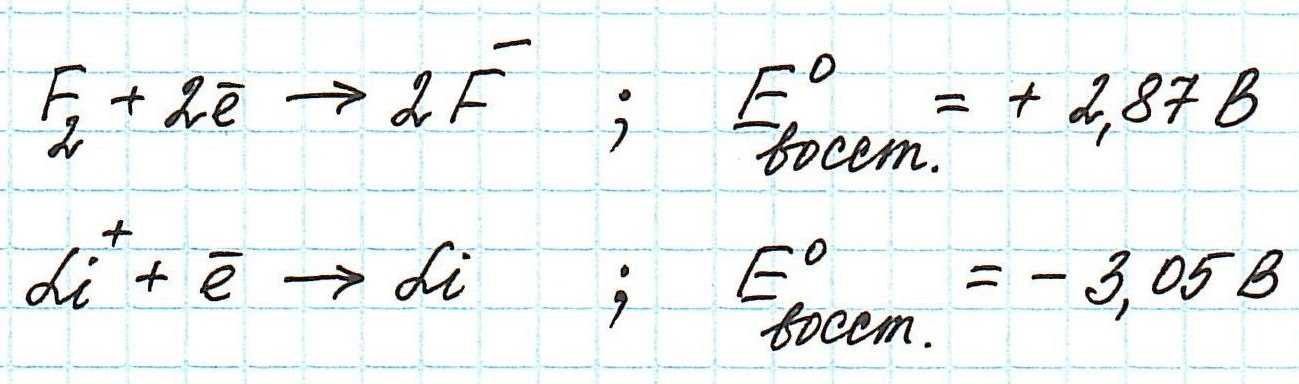 Анализируя эти полуреакции и значения восстановительных потенциалов, приходим к выводу, что сильнее других окисляют атомы фтора: они, восстанавливаясь, легче других принимают электроны. А ионы лития восстанавливаются с большим трудом.
Анализируя эти полуреакции и значения восстановительных потенциалов, приходим к выводу, что сильнее других окисляют атомы фтора: они, восстанавливаясь, легче других принимают электроны. А ионы лития восстанавливаются с большим трудом.
Окислительные потенциалы фтора и лития будут иметь противоположные значения.
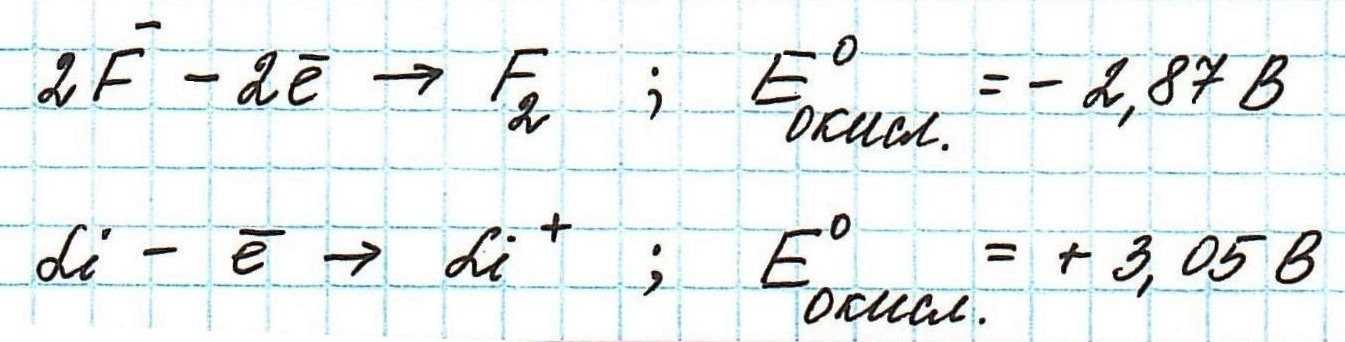 А говорить они будут о том, что ион фтора окисляется с очень большим трудом, а атом лития, наоборот, легко превращается при окислении в ион.
А говорить они будут о том, что ион фтора окисляется с очень большим трудом, а атом лития, наоборот, легко превращается при окислении в ион.
Пример. Используя таблицу стандартных электродных потенциалов, определите, какая из частиц проявляет более сильные окислительные свойства:
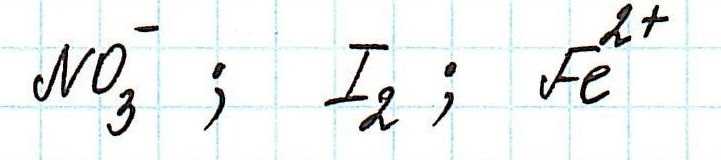 Решение:
Решение:
Наиболее сильным окислителем будет та частица, которая лучше всего восстанавливается, а, значит, имеет более высокий восстановительный электродный потенциал.
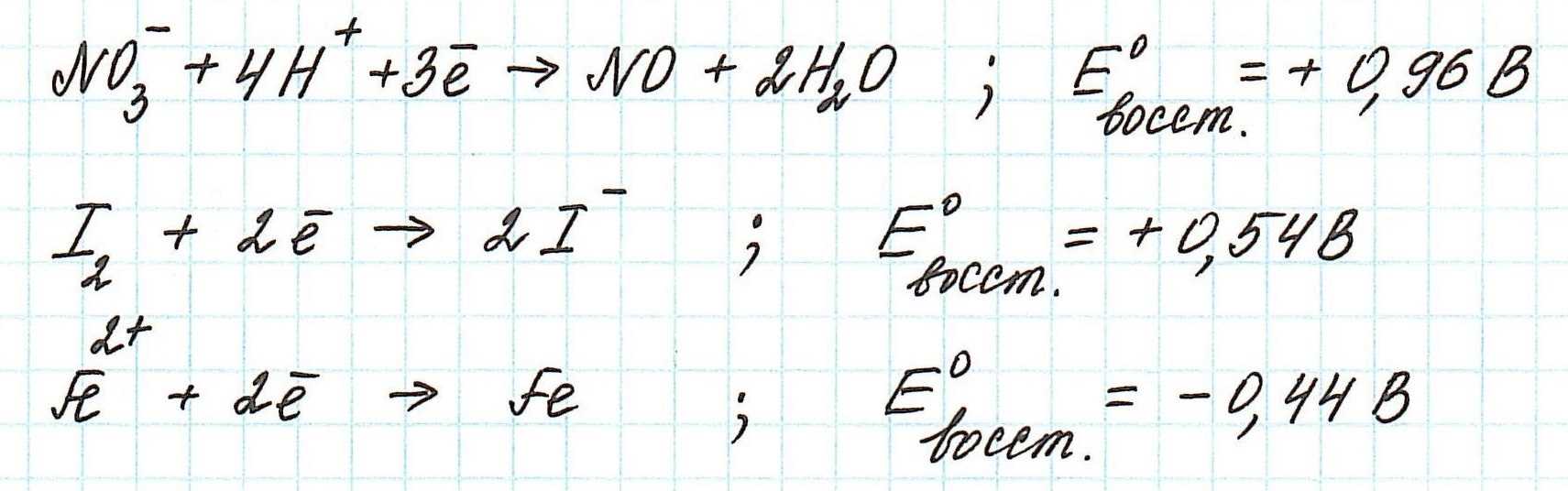
Сравним значения восстановительных потенциалов:
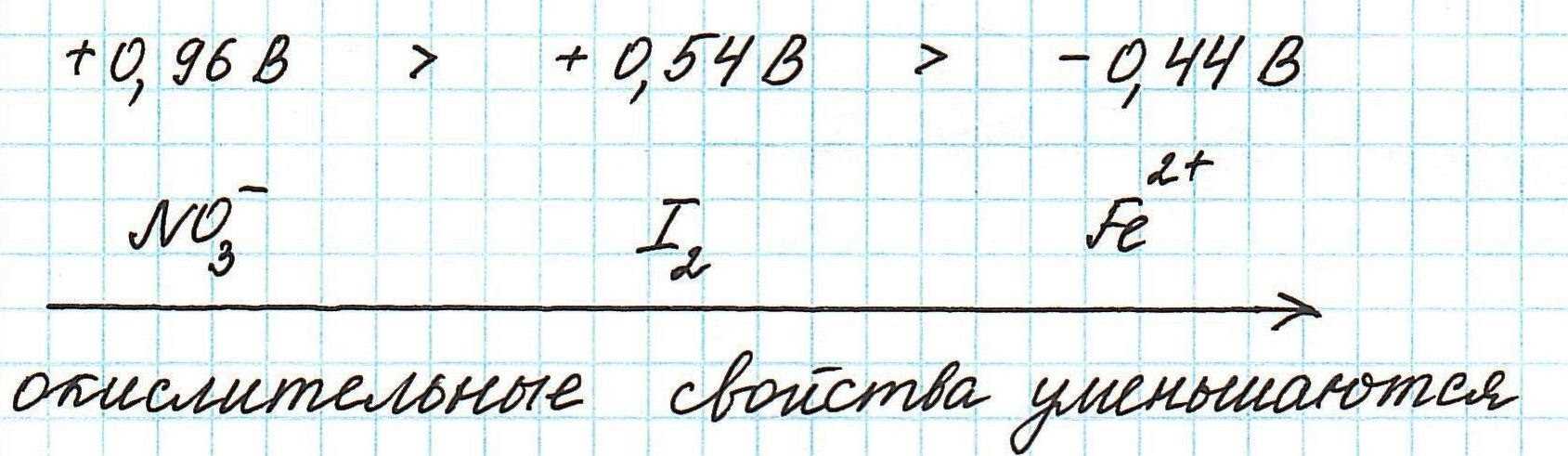
Таким образом, наиболее сильным окислителем из представленных является нитрат-ион.
Окислительно-восстановительная двойственность
Окислительно-восстановительная двойственность — это способность атома проявлять как свойства окислителя, так и свойства восстановителя в зависимости от условия протекания химической реакции.
Разберем вещества, атомы которых обладают окислительно-восстановительной двойственностью.
Сера
По отношению к водороду и металлам сера играет роль окислителя: S + H2 = H2S.
При взаимодействии с сильными окислителями повышает свою степень окисления до +4 или +6: S + KMnO4 = K2SO4 + MnO2.
Кислородсодержащие соединения серы в степени окисления +4
Сера в сульфитах и сернистой кислоте при взаимодействии с сильными окислителями повышает степень окисления до +6: SO2 + 2HNO3 (конц) = H2SO4 + 2NO2.
С восстановителями соединения серы проявляют окислительные свойства, восстанавливаясь до степени окисления 0 или −2: SO2 + C = CO2 + S.
Пероксид водорода
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии восстановителей может понижать степень окисления до –2: 4H2O2 + PbS = PbSO4 + 4H2O.
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии окислителей может повышать степень окисления до 0: 3H2O2 + 2KMnO4 = 3O2 + 2MnO2 + 2KOH + 2H2O.
Простое вещество йод
Окислительная способность проявляется у йода в реакции с такими восстановителями, как сероводород, фосфор и металлы: I2 + H2S = S + 2HI.
Йод при взаимодействии с более сильными окислителями играет роль восстановителя: I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
Азотистая кислота и нитриты
При взаимодействии с более сильными окислителями азот повышает степень окисления до +5 и превращается либо в азотную кислоту из азотистой, либо в нитрат-анион из нитрит-аниона: 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
При взаимодействии с сильными восстановителями обычно происходит восстановление до NO (иногда до других соединений азота в более низких степенях окисления): 2HNO2 + 2HI = 2NO + I2 + 2H2O.
Для удобства мы собрали представителей типичных окислителей и восстановителей в одну схему.