Строение и свойства кислот
В основном кислоты состоят из атомов водорода и кислотного остатка. Учитывая тип кислотного остатка, эти соединения делятся на кислородсодержащие и бескислородные кислоты. Соответственно, кислородсодержащие кислоты – это те, которые содержат один или несколько атомов кислорода в кислотном остатке. Бескислородные кислоты его не содержат. Чтобы узнать больше о первой из этих групп, мы рекомендуем ознакомиться со статьей о кислородсодержащих кислотах.
Кислоты также можно разделить на монопротонные (содержат один атом водорода в молекуле) и многопротонные (содержат более одного атома водорода). Следует помнить, что многопротонные кислоты в водных растворах подвергаются постепенной электролитической диссоциации. В результате этого процесса образуются кислые соли.
Как следует из названия, бескислородные кислоты не содержат в своей структуре атомов кислорода. Простейшие из этих соединений представляют собой комбинации атомов водорода и неметаллов. При составлении правильной общей формулы следует учитывать валентность атома водорода, а также присутствующий кислотный остаток.
Как образуются названия отдельных кислот? Сначала они содержат слово «кислота», за которым следует кислотный остаток, например:
- Хлористоводородная кислота, HCl;
- Сероводородная кислота, H2S;
- Бромистоводородная кислота, HBr, и т. д.
Кислоты в водных растворах подвергаются электролитической диссоциации, т.е. распадаются на ионы — катионы водорода и анионы кислотного остатка. Благодаря этому они способны переносить в растворе электрические заряды, то есть проводить ток.
В водных растворах проявляют кислую реакцию, обусловленную присутствием ионов водорода. Их содержание можно определить, например, путем измерения pH или визуально оценить с помощью индикаторных тест-полосок, которые изменяют цвет в зависимости от значения pH раствора (в случае сильной кислоты будет красный цвет, а слабой кислоты — оранжевый).
Получение бескислородных кислот заключается в растворении соответствующего газа в воде. Например, при абсорбции хлороводорода (газообразного вещества) в воде образуется хлористоводородная кислота. Таким образом, наиболее важными бескислородными кислотами являются водные растворы гидридов. Гидриды, в свою очередь, получают прямым синтезом из элементов или выделяют из соли, которую обрабатывают сильной кислотой. Растворимость этих газов в воде относительно велика, что позволяет получать кислоты высокой концентрации.
Первая помощь при отравлении синильной кислотой

Именно от своевременной и грамотной первой помощи зависит дальнейшее протекание отравления. Рекомендуется немедленно отстранить пострадавшего от ядовитого источника и обеспечить поток свежего воздуха.
Синильная кислота мгновенно распространяется по всему организму, отравляя его ядовитыми соединениями и оказывая отрицательное воздействие. Во избежание этого требуется немедленно положить человека в горизонтальное положение и нейтрализовать кислоту подручными антидотами во избежание ее дальнейшего распространения.
Для этих целей можно воспользоваться пищевой содой, активированным углем, сахарным раствором или парами нашатыря.
Если оказанные процедуры дали положительный эффект, будет не лишним перевернуть больного на бок и вызвать рвотный рефлекс — таким способом можно избежать попадания жидких масс в дыхательные пути.
В этом положении следует промыть желудок слабым раствором марганцовки или раствором тиосульфата натрия (5%) и гидрокарбоната натрия (2%). При этом человек обязательно должен быть в сознании, в ином случае данная процедура противопоказана.
Если оказанные процедуры наоборот не дали ожидаемого эффекта, без промедления обращаться в ближайшую больницу для принятия срочных реанимационных мер. В случае возникновения признаков клинической смерти (отсутствие сознания, дыхания, пульса и реакции зрачков на свет), реанимационные меры требуется проводить собственноручно.
Для этого необходимо максимально аккуратно избавить больного от одежды, а пораженные кислотой участки тела осторожно вытереть тряпкой, смоченной мыльным раствором. Запрещено размазывать ядовитые вещества по телу — в таком случае увеличится скорость распространения по организму, что усугубит ситуацию
Классификация
Основная формула минеральных кислот – HnAc, где Ac – кислотный остаток. В зависимости от состава кислотного остатка выделяют два типа кислот:
- кислородные, содержащие кислород;
- бескислородные, состоящие только из водорода и неметалла.
Основной список неорганических кислот в соответствии с типом представлен в таблице.
|
Тип |
Название |
Формула |
|
Кислородные |
Азотная |
HNO3 |
|
Азотистая |
HNO2 |
|
|
Борная |
H3BO3 |
|
|
Дихромовая |
H2Cr2O7 |
|
|
Йодная |
H5IO6 |
|
|
Йодноватая |
HIO3 |
|
|
Кремниевые – метакремниевая и ортокремниевая |
H2SiO3 и H4SiO4 |
|
|
Марганцовая |
HMnO4 |
|
|
Марганцовистая |
H2MnO4 |
|
|
Метафосфорная |
HPO3 |
|
|
Мышьяковая |
H3AsO4 |
|
|
Ортофосфорная |
H3PO4 |
|
|
Серная |
H2SO4 |
|
|
Сернистая |
H2SO3 |
|
|
Тиосерная |
H2S2O3 |
|
|
Тетратионовая |
H2S4O6 |
|
|
Угольная |
H2CO3 |
|
|
Фосфористая |
H3PO3 |
|
|
Фосфорноватистая |
H3PO2 |
|
|
Хлорная |
HClO4 |
|
|
Хлорноватая |
HClO3 |
|
|
Хлористая |
HClO2 |
|
|
Хлорноватистая |
HClO |
|
|
Хромовая |
H2CrO4 |
|
|
Циановая |
HOCN |
|
|
Бескислородные |
Фтороводородная (плавиковая) |
HF |
|
Хлороводородная (соляная) |
HCl |
|
|
Бромоводородная |
HBr |
|
|
Йодоводородная |
HI |
|
|
Сероводородная |
H2S |
|
|
Циановодородная |
HCN |
Кроме того, в соответствии со свойствами кислоты классифицируются по следующим признакам:
- растворимость: растворимые (HNO3, HCl) и нерастворимые (H2SiO3);
- летучесть: летучие (H2S, HCl) и нелетучие (H2SO4, H3PO4);
- степень диссоциации: сильные (HNO3) и слабые (H2CO3).
Рис. 1. Схема классификации кислот.
Для обозначения минеральных кислот используются традиционные и тривиальные названия. Традиционные названия соответствуют наименованию элемента, который образует кислоту с добавлением морфем -ная, -овая, а также -истая, -новатая, -новатистая для обозначения степени окисления.
Окисление альдегидов и кетонов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
|
При окислении альдегиды превращаются в карбоновые кислоты.
Альдегид → карбоновая кислота |
|
Метаналь окисляется сначала в муравьиную кислоту, затем в углекислый газ:
Формальдегид→ муравьиная кислота→ углекислый газ |
|
Вторичные спирты окисляются в кетоны:
вторичные спирты → кетоны |
Типичные окислители — гидроксид меди (II), перманганат калия KMnO4, K2Cr2O7, аммиачный раствор оксида серебра (I).
Кетоны окисляются только при действии сильных окислителей и нагревании.
2.1. Окисление гидроксидом меди (II)
Происходит при нагревании альдегидов со свежеосажденным гидроксидом меди, при этом образуется красно-кирпичный осадок оксида меди (I) Cu2O. Это — одна из качественных реакций на альдегиды.
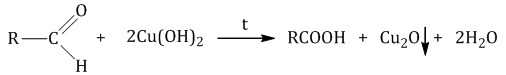
| Например, муравьиный альдегид окисляется гидроксидом меди (II) |
HCHO + 2Cu(OH)2 = 2Cu + CO2 + 3H2O
Чаще в этой реакции образуется оксид меди (I):
CH3CHO + 2Cu(OH)2 = Cu2O + CH3COOH + 2H2O
2.2. Окисление аммиачным раствором оксида серебра
Альдегиды окисляются аммиачным раствором оксида серебра (реакция «серебряного зеркала»).

Поскольку раствор содержит избыток аммиака, продуктом окисления альдегида будет соль аммония карбоновой кислоты.
| Например, при окислении муравьиного альдегида аммиачным раствором оксида серебра (I) образуется карбонат аммония |

| Например, при окислении уксусного альдегида аммиачным раствором оксида серебра образуется ацетат аммония |
Образование осадка серебра при взаимодействии с аммиачным раствором оксида серебра — качественная реакция на альдегиды.
Упрощенный вариант реакции:
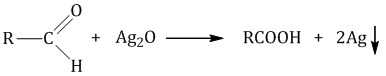
2.3. Жесткое окисление
При окислении под действием перманганатов или соединений хрома (VI) альдегиды окисляются до карбоновых кислот или до солей карбоновых кислот (в нейтральной среде). Муравьиный альдегид окисляется до углекислого газа или до солей угольной кислоты (в нейтральной среде).
| Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота |
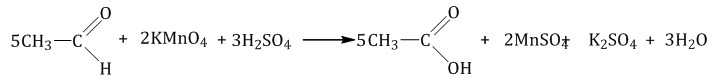
Кетоны окисляются только в очень жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов.
Реакция протекает с разрывом С–С-связей (соседних с карбонильной группой) и с образованием смеси карбоновых кислот с меньшей молекулярной массой или СО2.
| Карбонильное соединение/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метаналь СН2О | CO2 | K2CO3 |
| Альдегид R-СНО | R-COOH | R-COOK |
| Кетон | R-COOH/ СО2 | R-COOK/ K2СО3 |
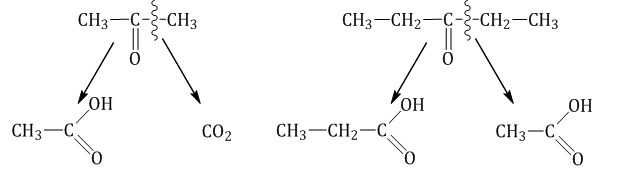
2.4. Горение карбонильных соединений
При горении карбонильных соединений образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2nО + (3n-1)/2O2 → nCO2 + nH2O + Q
| Например, уравнение сгорания метаналя: |
CH2O + O2 = CO2 + H2O
Какая доза смертельно опасна для организма
По словам ученых и результатам длительных экспериментов, удалось выяснить, что человеческий организм и организм теплокровных животных более восприимчив к воздействию данного вещества. в организме хладнокровных существ его соединения разрушаются естественным путем, не приводят к отравлению.
Не стоит забывать, что приготовленное вино из плодов и ягод, которые не были отделены от косточек, является очень опасным, может вызвать не только острое отравление, но и привести к летальному исходу.
Если говорить о компотах и вареньях, дела обстоят иначе. При большой концентрации сахара в этих блюдах синильная кислота обезвреживается, поскольку он является ее антидотом.
Клинические проявления
В тканях организма содержится цитохромоксидаза. Это фермент, который передает электроны на молекулы кислорода и превращает его в атомарный. Только в таком виде газ усваивается клетками тканей.
Нервная система повреждается в первую очередь, так как ее клетки особо чувствительны к недостатку кислорода.
Отравление цианидами происходит через кожу, желудочно-кишечный тракт или легкие. Скорость проявления признаков отравления кислотами будет отличаться, но симптомы одинаковы:
- саднит в горле;
- покраснение слизистых оболочек и кожи;
- учащение сердцебиения;
- тошнота;
- рвота с кровью;
- кал черного цвета с примесью крови;
- головокружение;
- обильное слюноотделение;
- запах миндаля изо рта.
Если отравившемуся человеку вовремя не оказать медицинскую помощь, наступает паралич, потом — смерть.
Причины
Цианистый водород (HCN) имеет повышенную летучесть. Его хорошо поглощают водные и спиртовые растворители. Цвет у химического вещества отсутствует. Запах схож с запахом горького миндаля. Чтоб наступил летальный исход, достаточно 0,05 г яда. Почему синильная кислота так вредна
?
Попадая в организм, цианистый водород связывается с железом и создает нарушение всасывания кислорода и наступает кислородное голодание. Вследствие чего разрушается головной и спинной мозг, дефицит кислорода в тканях провоцирует учащенное дыхание, потом оно становится поверхностным и через некоторое время может прекратиться вовсе. Также кислородное голодание опасно для сердечно-сосудистой системы. Кроме того, меняется и сам состав крови: в ней присутствует много неусвоенного кислорода и понижена концентрация диоксида углерода.
Отравление синильной кислотой и ее производными, а также парами кислоты происходит по следующим причинам:
- халатное обращение с ядохимикатами: средствами для борьбы с насекомыми и грызунами, а также химическими стимуляторами роста растений, содержащими цианиды;
- несоблюдение техники безопасности при применении солей синильной кислоты на некоторых производствах: добыча драгметаллов из руды, изготовление пластика, стекла, резины, изготовление искусственных ароматизаторов и прочие;
- поглощение косточек плодов: вишни, абрикоса, черешни, персика, сливы. Также может быть опасен компот на основе этих плодов с косточками, если он стоит более года;
- если вдыхать пары летучего ядовитого вещества.
Яд проникает в организм человека через:
- пищеварительную систему;
- повреждения и поры на коже;
- слизистые оболочки;
- дыхательные пути яды проникают наиболее быстро. Частое вдыхание ядовитых паров кислоты на производствах ведет к хроническому отравлению синильной кислотой.
Симптомы
Клиника отравления синильной кислотой и особенности проявления симптомов зависят от количества и концентрации потребленного яда, а также от пути его проникновения в организм. В наиболее тяжелой степени и очень быстро проявляются признаки отравления синильной кислотой после вдыхания ее высококонцентрированных ядовитых испарений. В случае проникновения с дыханием в организм смертельной дозы синильной кислоты она очень быстро начинает действовать и человек погибает уже в первые минуты.
Если отравиться синильной кислотой через пищеварительную систему, на начальном этапе интоксикации организма возникнет симптоматика:
- тошнота;
- режущая боль в области желудка;
- озноб;
- першение в горле;
- повышенное пото- и слюноотделение;
- горьковатый привкус во рту;
При повышении концентрации яда в организме у отравившегося человека могут добавиться следующие симптомы отравления синильной кислотой:
- сильная головная боль;
- рвота;
- слабость, головокружение;
- недостаток воздуха, одышка;
- судороги;
- пониженное АД и сердечные боли;
- расширенные зрачки;
- лихорадка;
- гиперемия кожи, она становится красного цвета, слизистые также приобретают красноватую окраску. Такие перемены связаны с невозможностью клеток усваивать молекулярный кислород;
- потеря сознания;
- непроизвольные акты дефекации и мочеиспускания;
- смертельный исход.
При большой дозе потребленного цианистого водорода вероятность быстрой смерти очень даже высока, поэтому важно не терять ни секунды и как можно скорее оказать первую помощь и провести правильную терапию
Свойства
Цианиды щелочных и щелочноземельных металлов — ионные соединения, хорошо растворимые в воде. Их водные растворы вследствие гидролиза имеют щелочную реакцию, и при использовании в промышленности в растворы цианидов щелочных металлов в качестве стабилизатора добавляют соответствующие гидроксиды. Цианиды щелочных металлов во влажном воздухе разлагаются с выделением синильной кислоты и образованием соответствующего карбоната.
При нагревании водные растворы ионных цианидов разлагаются с образованием формиата и аммиака:
Под действием мягких окислителей (в том числе и при действии кислорода воздуха) цианиды щелочных металлов легко окисляются до цианатов:
Механизм присоединения циановодородной кислоты
Главной чертой взаимодействия карбонильных соединений с углеродными нуклеофилами типа циановодородной кислоты является образование между ними новой углерод-углеродной связи. Такое взаимодействие происходит путем как простого присоединения, так и как присоединение-отщепление.
Механизм присоединения циановодородной кислоты был установлен Лепуортом в 1904 г. Фактически это была первая органическая реакция, для которой был детально изучен механизм превращения. Лепуортом было обнаружено, что реакция присоединения циановодородной кислоты обратима, а ее скорость напрямую зависит от концентрации карбонильных соединений, циановодорода и основания. Цианистый водород (синильная кислота) представляет собой слабую кислоту с $pK_a$ 9,2. Образующиеся при ее депротонировании цианид-ионы присоединяются к карбонильным углеродам с образованием анионных интермедиатов, протонирование которых приводит к циангидринам:
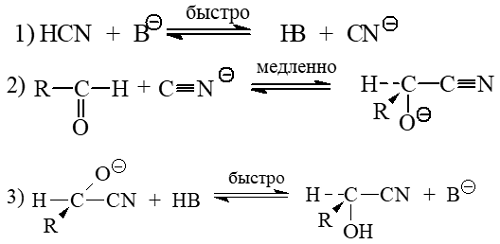 Рисунок 6.
Рисунок 6.
То, что скорость реакции зависит от концентрации всех трех компонентов указывает на то, что лимитирующей стадией процесса является присоединение цианид-ионов к карбонильным группам. В лабораторных условиях циановодородную кислоту получают добавлением одного эквивалента какой либо минеральной кислоты к смеси состоящей из избытка цианида калия или натрия и исследуемого карбонильного соединения. Эту реакцию также можно провести при действии жидкого циановодорода (т.кип. = 26 $^\circ$С) напрямую на карбонильное соединение.
Отравление синильной кислотой

Интоксикация организма происходит несколькими путями: посредством вдыхания паров или заражения химическим веществом открытого участка кожного покрова, попадания концентрированного аэрозоля желудочно-кишечный тракт, употребление большой дозы семян некоторых фруктов и ягод или употребление домашних настоек, вин, изготовленных без отсеивания косточек.
Как и у любого заболевания, об отравлении синильной кислотой организм сигнализирует рядом симптомов, на основании которых следует делать выводы и принимать соответствующее решение. Тяжесть и скорость протекания реакции организма на ядовитое вещество различно и от проникновения цианистого водорода внутрь.
Проникновение ядовитых паров посредством дыхательных путей человек переносит в разы тяжелее, а первые симптомы можно наблюдать уже по прошествии нескольких минут. Употребление большой дозы вышеупомянутых орехов пищеварительный тракт выдерживает не больше часа, чем начинает подавать предупреждающие сигналы о произошедшем сбое.
О лёгкой степени отравления может свидетельствовать наличие покраснения слизистых оболочек, судороги, одышка, общая слабость, першение и увеличение слюноотделения, тошнота и частые позывы в туалет.
Зафиксировано нарушение ритма дыхания и психоэмоциональное возбуждение? Это первые признаки того, что отравление проходит в тяжелой форме.
Не редко отравлению сопутствует возникновение таких симптомов, как головокружение, паническое состояние, расширение зрачков, нетвердость походки и внезапное возникновение головной боли. В дальнейшем состояние больного будет ухудшаться все больше вплоть до мгновенной потери сознания, наступления комы и летального исхода.
Симптомы отравления синильной кислотой
Признаки отравления синильной кислотой можно наблюдать при употреблении яда внутрь, при вдыхании его паров и при контакте с кожей. От того, каким путём ядовитое вещество проникло в организм, зависит скорость его воздействия и появление клинической симптоматики. Тяжелейшие отравления наблюдаются при попадании паров в дыхательную систему. В этом случае симптомы отравления синильной кислотой могут появиться в первые минуты после контакта. Если концентрация отравляющего вещества очень высока, то летальный исход можно наблюдать через считаные минуты.
В пищеварительной системе цианистоводородная кислота может провести некоторое время никак себя не проявляя. Медленнее всего интоксикация развивается при попадании кислоты через кожные покровы. Этот процесс активнее протекает при повышении температуры в помещении, при физической активности, что приводит к интенсивному потоотделению. При этом скрытый период может составлять до 90 минут.
Основные признаки отравления синильной кислотой следующие.
Циановодородная кислота
Циановодородная кислота существует в свободном виде и в растворах.
Циановодородная кислота присоединяется к альдегидам и кетонам. Таким образом, C4HgO — карбонильное соединение; какое именно, на основании данных задачи однозначно установить нельзя.
Сама циановодородная кислота HCN мало диссоциирована. Поэтому реакцию проводят в щелочной среде, где образуется цианид-ион, являющийся активной нуклеофильной частицей.
Циановодородную кислоту ( водный раствор циановодорода HCN) раньше называли синильной — от синькалий; такой термин в старину применялся по отношению к желтой кровяной соли, гексацианофер-рату ( П) калия. Циановодородная кислота — сильнейший яд: уже 50 мг ее вызывают почти мгновенную смерть. С гидроксидом калия цианово-дородная кислота реагирует с образованием цианида калия KCN, а с карбонатом калия не взаимодействует. Циановодородная кислота — более слабая, чем угольная, поэтому HCN не может вытеснять Н2СО3 из солей-карбонатов.
Остаток циановодородной кислоты ( группа — CN или — C N) называется нитрильной группой или цианогруппой, остаток — изо-циановодородной кислоты ( группа — NC) — изоцианогруппой.
Соли циановодородной кислоты называются цианидами, например KCN — цианид калия. Синильная кислота и ее соли сильно ядовиты.
Кроме циановодородной кислоты, в виде гликозидов бывают связаны и другие токсины высших растений. Например, в растениях рода астрагала содержится 0-гликозид 3-нитропропанола — мизеротоксин, являющийся причиной падежа скота. Образующийся в результате гидролиза его 3-нитропропанол МО2СЙ2СН2СН2ОН поражает в головном мозге центры, ответственные за дыхание и мышечное сокращение.
В этой равновесной смеси резко преобладает циановодородная кислота.
Цепи углерод-углеродные 429 Цепные реакции 453 Циановодородная кислота 39 Циклоалканы 464 ел.
Определение основано на образовании роданида натрия при взаимодействии циановодородной кислоты с тетратионатом натрия с последующей реакцией с хлоридом железа.
Определение основано на образовании роданида натрия при взаимодействии циановодородной кислоты с тетратионатом натрия с последующей реакцией с хлоридом железа.
Феноксицианбензиловый спирт легко получается из 3-фен-оксибензальдегида взаимодействием с циановодородной кислотой или ее солями.
Тиоцианат аммония в значительных количествах получается при очистке коксового газа от циановодородной кислоты. Обычно технический продукт содержит примесь сульфата аммония, который не препятствует использованию тиоцианата аммония в качестве гербицида и десиканта, а также тиосульфата аммония.
|
Хроматограмма триазинов ( хлорсодержащие производные триазина, использующихся в качестве гербицидов, полученная на стеклянной капиллярной колонке WCOT ( 25 м х 0 22 мм с СР Sil 7 при программировании температуры в интервале 100 — 220 С с ТИД ( газ-носитель водород. 1 — симазин. 2 — атразин. 3 — пропазин. 4 — аметрин. 5 — прометрин. |
Термоионный детектор почти не имеет конкурентов при обнаружении в воздухе следовых количеств циановодородной кислоты и ее производных, селективном детектировании алифатических и ароматических аминов и определении очень низких содержаний N-нитрозаминов, обладающих выраженной канцерогенной активностью.
Последствия и осложнения отравления
Степень выраженности последствий отравления HCN зависит от следующих факторов:
- своевременность оказания помощи пострадавшему;
- путь отравления (при попадании через дыхательные пути симптомы проявляются быстрее, чем при проникновении яда через кожу);
- количество отравляющего вещества, попавшего в организм (при высоком содержании токсина в крови развивается молниеносная форма);
- степень физического здоровья (ослабленный организм справляется с отравлением хуже).
 Атаксия
Атаксия
Последствия отравления:
- продолжительные головные боли (в течение 2 и более недель после отравления);
- психические расстройства;
- дискоординация движений;
- слабость, сонливость;
- невнятная речь;
- паралич отдельных мышц;
- нарушения со стороны сердечно-сосудистой и дыхательной систем.
Токсикология
Все (неорганические) цианиды очень ядовиты. Цианиды в XX веке применялись как отравляющее вещество против грызунов в сельском хозяйстве. В начале XX века синильная кислота использовалась французами как боевое отравляющее вещество (ОВ) как например хлорциан.
Цианид-анион является ингибитором фермента цитохром с-оксидаза в IV комплексе дыхательной цепи переноса электронов (у эукариот локализована на внутренней мембране митохондрий). Связывается с железом, входящим в состав фермента, чем препятствует переносу электронов между цитохром с-оксидазой и кислородом. В результате нарушается транспорт электронов, и, следовательно, прекращается аэробный синтез АТФ.
Наиболее токсичным цианидом является синильная кислота.
Обезвреживание цианидов в сточных водах предприятий
Промывные воды гальванических участков, в которых используются цианиды, относительно легко обезвреживаются с помощью окислителей. В связи с этим в 80-х — 90-х гг. XX века был приостановлен массовый переход на «нецианистые электролиты» — оказалось, что несмотря на меньшую токсичность, они сложнее в обезвреживании и часто менее технологичны.
Наиболее часто применяются гипохлориты (хлорная известь, гипохлорит натрия).
Меры при отравлении цианидами
Противоцианидные антидоты вводят внутривенно или перорально. Их можно разделить на три основных класса. Первый — сахара (прежде всего глюкоза), необратимо связывающие цианиды в нетоксичные циангидрины. Постоянно присутствуют в крови, собственно, и обеспечивая максимальную несмертельную дозу в десятки миллиграммов.
Из второй группы можно назвать тиосульфат натрия, который реагирует с цианидами, превращая их в роданиды, которые также безвредны. Третья группа антидотов — вещества, превращающие гемоглобин крови в метгемоглобин. Он не способен переносить кислород, но быстро связывает цианиды с образованием цианметгемоглобина, который впоследствии выводится из организма. К этой группе относятся некоторые красители (например, метиленовый синий), органические и неорганические нитриты.
Метгемоглобинобразователи наиболее эффективны из всех антидотов, так как действуют быстрее других, но в то же время они и опасны сами по себе: при их передозировке кровь теряет способность переносить кислород. Кроме того, реакция образования цианметгемоглобина обратима, и со временем часть цианида будет высвобождаться обратно. Поэтому антидоты этой группы применяют обычно в сочетании с антидотами других групп.
К третьей группе относятся амилнитрит и нитроглицерин.




























