Сложные эфиры
Номенклатура и классификация
Название создается следующим образом: вначале указывается группа R, присоединенная к кислоте, затем – название кислоты с суффиксом -ат (например, бутилпропионат).
Строение и физические свойства
Эфиры низших карбоновых кислот и низших одноатомных спиртов имеют приятный запах цветов, ягод и фруктов. Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
CH3(CH2)14–CO–O–(CH2)29CH3
Химические свойства
Гидролиз эфиров сложных протекает как в кислой, так и в щелочной среде (водные или спиртовые растворы NaOH, КОН):
C2H5COOH + CH3OH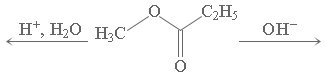 C2H5COO– + CH3OH.
C2H5COO– + CH3OH.
Эфиры сложные устойчивы к действию окислителей.
Восстановление сложных эфиров приводит к альдегидам, но обычно восстановление идет дальше – до первичного спирта:
RCOOR’ RCH2OH + R’OH.
Методы получения
Получают сложные эфиры: этерификация – взаимодействие кислот и спиртов в условиях кислотного катализа (например, получение этилацетата из уксусной кислоты и этилового спирта):
СН3COOH + C2H5OH = СН3COOC2H5 + H2O,
взаимодействие ангидридов или галогенангидридов карбоновых кислот со спиртами (например, получение этилацетата из уксусного ангидрида и этилового спирта):
(CH3CO)2O + 2C2H5OH = 2 СН3COOC2H5 + H2O,
взаимодействие солей кислот с алкилгалогенидами:
RCOOMe + R’Hal = RCOOR’ + MeHal.
Классификация по строению углеводородного радикала
- Предельные карбоновые кислоты – карбоксильная группа СООН соединена с предельным радикалом. Например, этановая кислота СН3–СООН.
- Непредельные карбоновые кислоты – карбоксильная группа СООН соединена с непредельным радикалом. Например, акриловая кислота: СН2=СН–СООН.
- Ароматические кислоты — карбоксильная группа СООН соединена с непредельным радикалом. Например, бензойная кислота: С6Н5СООН.
- Циклические кислоты — карбоксильная группа СООН соединена с углеводородным циклом. Например, циклопропанкарбоновая кислота: С3Н5СООН.
Строение карбоновых кислот
Карбоксильная группа сочетает в себе две функциональные группы – карбонил и гидроксил, взаимно влияющие друг на друга.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность смещена к более электроотрицательному атому кислорода.
Атом углерода карбоксильной группы находится в состоянии sp2-гибридизации, образует три σ-связи и одну π-связь.
Водородные связи и физические свойства карбоновых кислот
В жидком состоянии и в растворах молекулы карбоновых кислот образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул карбоновых кислот.
Молекулы карбоновых кислот с помощью водородных связей соединены в димеры.
Это приводит к увеличению растворимости в воде и высоким температурам кипения низших карбоновых кислот.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Номенклатура карбоновых кислот
Предельные одноосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Муравьиная | Метановая | Формиат (метаноат) | HCOOH |
| Уксусная | Этановая | Ацетат (этаноат) | CH3COOH |
| Пропионовая | Пропановая | Пропионат (пропаноат) | CH3CH2COOH |
| Масляная | Бутановая | Бутират (бутаноат) | CH3(CH2)2COOH |
| Валериановая | Пентановая | Пентаноат | CH3(CH2)3COOH |
| Капроновая | Гексановая | Гексаноат | CH3(CH2)4COOH |
| Пальмитиновая | Гексадекановая | Пальмитат | С15Н31СООН |
| Стеариновая | Октадекановая | Стеарат | С17Н35СООН |
Таблица. Непредельные одноосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Акриловая | Пропеновая | Акрилат | CH2=CH–COOH |
| Метакриловая | 2-Метилпропеновая | Метакрилат | CH2=C(СH3)–COOH |
| Кротоновая | транс-2-Бутеновая | Кротонат | СН3 -CH=CH–COOH |
| Олеиновая | 9- цис-Октадеценовая | Олеат |
СН3(СН2)7СН=СН(СН2)7СООН |
| Линолевая | 9,12-цис-Октадекадиеновая | Линолеат | СН3(СН2)4(СН=СНСН2)2(СН2)6СООН |
| Линоленовая | 9,12,15-цис-Октадекатриеновая | Линоленоат | СН3СН2(СН=СНСН2)3(СН2)6СООН |
Таблица. Двухосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Щавелевая | Этандиовая | Оксалат | НООС – COOH |
| Малоновая | Пропандиовая | Малонат | НООС-СН2-СООН |
| Янтарная | Бутандиовая | Сукцинат | НООС-(СН2)2-СООН |
| Глутаровая | Пентандиовая | Глутарат | НООС-(СН2)3-СООН |
| Адипиновая | Гександиовая | Адипинат | НООС-(СН2)4-СООН |
| Малеиновая | цис-Бутендиовая | Малеинат | цис-НООССН=СНСООН |
| Фумаровая | транс-Бутендиовая | Фумарат | транс-НООССН=СНСООН |
Таблица. Ароматические карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Бензойная | Фенилкарбоновая | Бензоат | |
| Фталевая | Бензол-1,2-дикарбоновая кислота | Фталат | |
| Изофталевая | Бензол-1,3-дикарбоновая кислота | Изофталат | |
| Терефталевая | Бензол-1,4-дикарбоновая кислота | Терефталат |
Реакции замещения группы ОН
| Для карбоновых кислот характерны реакции нуклеофильного замещения группы ОН с образованием функциональных производных карбоновых кислот: сложных эфиров, амидов, ангидридов и галогенангидридов. |
2.1. Образование галогенангидридов
Под действием галогенагидридов минеральных кислот-гидроксидов (пента- или трихлорид фосфора) происходит замещение группы ОН на галоген.
| Например, уксусная кислота реагирует с пентахлоридом фосфора с образованием хлорангидрида уксусной кислоты |
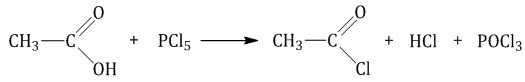
2.2. Взаимодействие с аммиаком
При взаимодействии аммиака с карбоновыми кислотами образуются соли аммония:
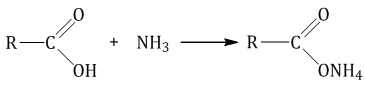
При нагревании карбоновые соли аммония разлагаются на амид и воду:
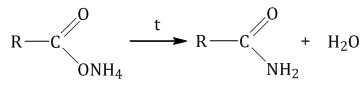
2.3. Этерификация (образование сложных эфиров)
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.
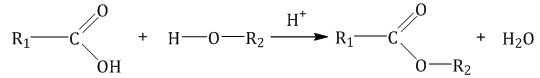
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
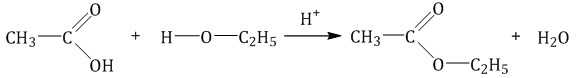
При этом фенол не вступает в реакцию этерификации с карбоновыми кислотами. Сложные эфиры фенола получают косвенными способами.
2.4. Получение ангидридов
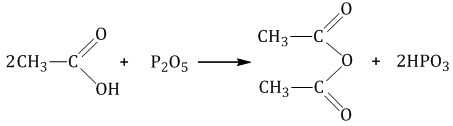
С помощью оксида фосфора (V) можно дегидратировать (то есть отщепить воду) карбоновую кислоту – в результате образуется ангидрид карбоновой кислоты.
| Например, при дегидратации уксусной кислоты под действием оксида фосфора образуется ангидрид уксусной кислоты |
Жиры
Жиры – сложные эфиры глицерина и высших одноосновных карбоновых кислот.
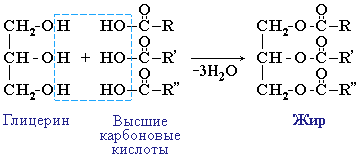
Номенклатура и классификация
Общее название жиров – триацилглицерины или триглицериды, ацил – остаток карбоновой кислоты –C(O)R. В природные триглицериды входят остатки в основном насыщенных (предельных) кислот (стеариновой C17H35COOH, пальмитиновой C15H31COOH, и др.), а также непредельных кислот (линолевой C17H31COOH, олеиновой C17H33COOH, линоленовой C15H29COOH и др.).
Жиры можно найти во всех животных и растениях. По составу они являются смесями полных сложных эфиров глицерина и не имеют чётко выраженной температуры плавления.
Физические свойства
Животные жиры (свиной, говяжий, бараний и т. п.) большей частью являются твердыми веществами, но с невысокой температурой плавления (исключениеием является рыбий жир – жидкость). В твёрдых жирах в основном остатки насыщенных кислот.
Растительные жиры – масла (кукурузное, подсолнечное, соевое, хлопковое и др.) – это жидкости (исключение – кокосовое масло и масло какао-бобов). Масла включают в себя остатки ненасыщенных кислот.
Жидкие жиры превращаются в твердые путем реакции гидрогенизации (гидрирования). При этом водород присоединяется по двойной связи, содержащейся в углеводородном радикале молекул масел.
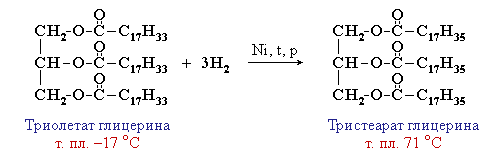
Продукт гидрогенизации масел – твердый жир (искусственное сало, саломас). Маргарин – это пищевой жир, состоящий из смеси гидрогенизированных масел (подсолнечного, кукурузного, хлопкового и др.), а также животных жиров, молока и вкусовых добавок (соли, сахара, витаминов и др.).
Для жиров, как сложных эфиров, характерна обратимая реакция гидролиза (катализатор – минеральные кислоты). В присутствии щелочей (или карбонатов натрия или калия) гидролиз жиров протекает необратимо. Продуктами в этом случае являются мыла – соли высших карбоновых кислот и щелочных металлов:
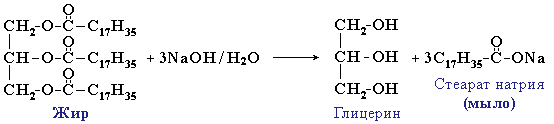
Натриевые соли – твердые мыла, калиевые – жидкие. Реакция щелочного гидролиза жиров, и вообще всех сложных эфиров, называется также омылением.
Высшие карбоновые кислоты можно выделить из мыла действием более сильных кислот.
Жиры, содержащие остатки ненасыщенных кислот, способны к окислению по связям С=С.
Важное значение имеют так называемые высыхающие масла (льняное, тунговое и др.), которые входят в состав красок и лаков (в частности, олифы). Эти масла отличаются высоким содержанием остатков кислот с двумя или тремя двойными связями и способны к образованию на окрашиваемой поверхности прочной пленки за счет полимеризации по кратным связям под действием кислорода воздуха
Ангидриды карбоновых кислот
Классификация. Номенклатура
Ангидриды являются продуктами дегидратации карбоновых кислот. Различают линейные и циклические ангидриды карбоновых кислот: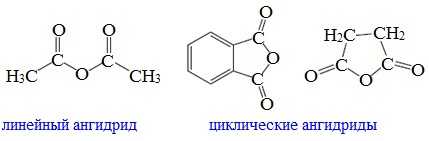
Линейные ангидриды, в молекулу которых входят остатки разных кислот, в том числе и минеральных, называются смешанными ангидридами.
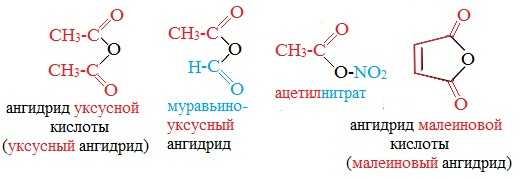
Названия ангидридов образуют из тривиальных названий соответствующих кислот:
Способы получения
1. Дегидратация карбоновых кислот
Линейный ангидриды можно получить из карбоновых кислот при взаимодействии с сильными водоотнимающими реагентами (P2O5, ангидрид трифторуксусной кислоты С4F6O3).Циклические ангидриды получают отщеплением воды от дикарбоновых кислот при их нагревании: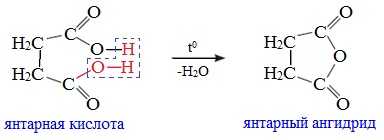
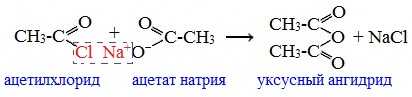
2. Взаимодействием галогенангидридов с солями карбоновых кислот
Линейные ангидриды получают взаимодействием хлорангидридов с натриевыми или калиевыми солями карбоновых кислот: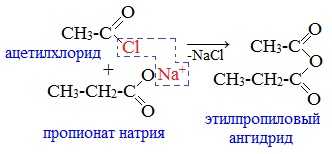
3. Взаимодействие карбоновых кислот с кетенами
Ангидриды получают при взаимодействии карбоновых кислот с кетенами:
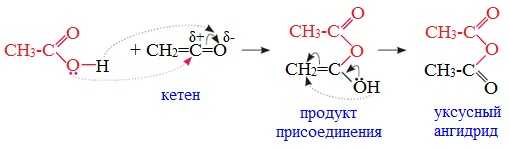
Данный метод используется в промышленности для получения уксусного ангидрида.
Первый представитель гомологического ряда – ангидрид муравьиной кислоты – нестабилен.
Физические свойства
Ангидриды карбоновых кислот представляют собой бесцветные жидкости или кристаллические вещества. Низшие представители гомологического ряда обладают раздражающим запахом. Ангидриды карбоновых кислот малорастворимы в воде и медленно с ней реагируют.
Характеристика реакционной способности
Ангидриды карбоновых кислот, подобно галогенангидридам, являются весьма активными электрофильными реагентами. Связи в молекулах ангидридов карбоновых кислот сильно поляризованы.
Ангидриды карбоновых кислот имеют менее выраженный электрофильный характер, чем галогенангидриды, но проявляют большую электрофильность по сравнению с карбоновыми кислотами, поскольку у них атом кислорода, проявляющий +М-эффект, приходится на две ацильные группы:
Ангидриды карбоновых кислот легко реагируют с различными нуклеофильными реагентами и используются для введения в их структуру ацильных групп.
Химические свойства
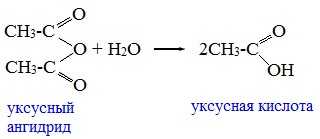
1. Взаимодействие с водой (гидролиз)
При взаимодействии с водой ангидриды медленно гидролизуются с образованием соответствующих кислот:
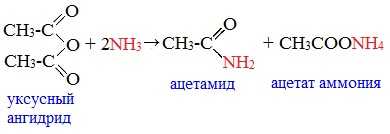
2. Взаимодействие с аммиаком (аммонолиз)
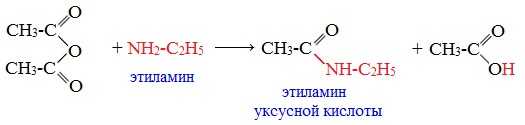
При взаимодействии линейных ангидридов с аммиаком, первичными или вторичными аминами образуются амиды карбоновых кислот:
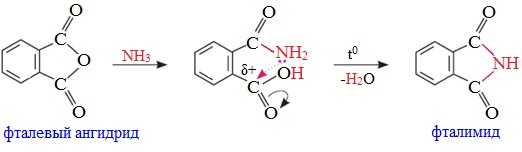
 Циклические ангидриды реагируют с аммиаком и первичными аминами с образованием неполных амидов дикарбоновых кислот, которые при нагревании циклизуются в имиды:
Циклические ангидриды реагируют с аммиаком и первичными аминами с образованием неполных амидов дикарбоновых кислот, которые при нагревании циклизуются в имиды:
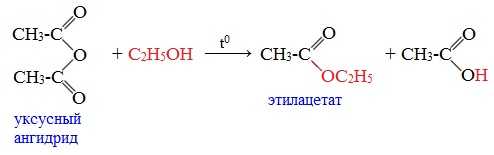
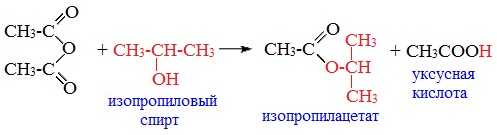
3. Взаимодействие со спиртами (алкоголиз)
При обработке линейных ангидридов спиртами образуются сложные эфиры:
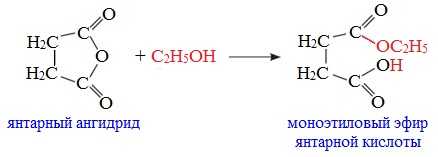
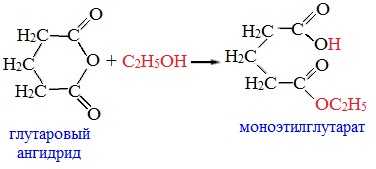
Циклические ангидриды реагируют со спиртами с образованием неполных (кислых) эфиров дикарбоновых кислот:
4. Реакции α-водородного атома
Как и в случае карбоновых кислот, в молекулах ангидридов атомы водорода при α-углеродных атомах подвижны. С участием связи С-Н в α-положении ангидриды карбоновых кислот в присутствии оснований (соли карбоновых кислот, третичные амины) вступают в реакцию конденсации с ароматическими альдегидами, образуя ненасыщенные аренкарбоновые кислоты.
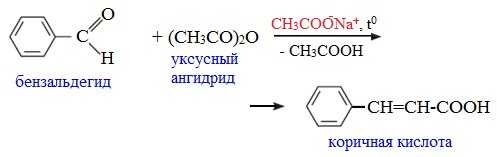
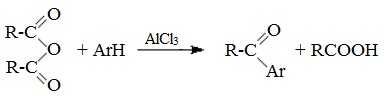
5. Образование ароматических кетонов
При взаимодействии ангидридов с аренами в присутствии хлорида алюминия образуются кетоны (реакция Фриделя-Крафтса):
Отдельные представители
Уксусный ангидрид (CH3CO)2O — бесцветная жидкость с резким запахом (т.кип.140С), раздражает слизистые оболочки глаз и дыхательных путей, вызывает ожоги кожи. С водой медленно реагирует, образуя уксусную кислоту, растворяется в этаноле, эфире, бензоле, уксусной кислоте.
Применяется в качестве ацетилирующего реагента в производстве ацетилцеллюлозы, винилацетата, диметилацетамида, лекарственных средств (ацетилсалициловой кислоты и др.).
Фталевый ангидрид — белое кристаллическое вещество (т.пл.130,8С), легко возгоняется, растворим в этаноле. Обладает свойствами ароматических соединений. Легко реагирует с фенолами и их производными.
Используют в синтезе лекарственных препаратов (фталазол, фтазин и др.), в производстве алкидных смол, пластификаторов, красителей.
Рубрики: ОРГАНИЧЕСКАЯ ХИМИЯ
Свойства муравьиной кислоты
| Особенности свойств муравьиной кислоты обусловлены ее строением, она содержит не только карбоксильную, но и альдегидную группу и проявляет все свойства альдегидов. |
4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
Как и альдегиды, муравьиная кислота окисляется аммиачным раствором оксида серебра. При этом образуется осадок из металлического серебра.
При окислении муравьиной кислоты гидроксидом меди (II) образуется осадок оксида меди (I):
Муравьиная кислота окисляется хлором до углекислого газа.
4.3. Окисление перманганатом калия
Муравьиная кислота окисляется перманганатом калия до углекислого газа:
5HCOOH + 2KMnO4 + 3H2SO4 → 5CO2 + 2MnSO4 + K2SO4 + 8H2O































