Ксантопротеиновая реакция
Наша пероксидаза дает определенно положительную биуретовую и ксантопротеиновую реакцию, но не дает реакции Миллона. При нагревании в пробирке из нее выделяется пиррол и резко щелочное основание. Пиррол образуется также при озолении пероксидазы в платиновом тигле. В настоящее время мы не можем еще точно определить, какая зависимость существует между пероксидазой и белками.
Если реакция Миллона или ксантопротеиновая реакция характерны только для тех белков, которые содержат соответственные аминокислоты, то ниигидриповая реакция более универсальна и получается со всеми без исключения белками. Объясняется это тем, что нингидрин дает окрашивание ( обычно сине-фиолетовое) с любой — аминокислотой, а любой белок содержит именно а-аминокислотные остатки. На основе нингидриновой реакции разработан метод количественного определения белков и аминокислот.
Какие аминокислоты обнаруживают в белках ксантопротеиновой реакцией.
Следует учитывать, что в отличие от биуретовой реакции ксантопротеиновую реакцию дают не все белки, поскольку в некоторых из них может и не быть а-аминокислот, содержащих группировки ароматических соединений; например, чистая желатина ( см.) не дает ксантопротеиновой реакции.
К важнейшим из них относятся: биуретовая реакция ( пептидные связи), ксантопротеиновая реакция ( ароматич. Миллона реакция ( фенильная группа тирозина), Адамкевича реакция ( индольное кольцо триптофана), Паули реакция ( имидазольное кольцо ги-стидина), сулъфгидрилъная реакция ( серусодержащие остатки аминокислот), Сакаеучи реакция ( гуанидино-вая группа аргинина), нингидриновая реакция, пикриновая реакция.
Чистый желатин не содержит многих аминокислот, в том числе перечисленных выше, и не дает ксантопротеиновой реакции.
Чистый желатин не содержит многих аминокислот, в том числе и перечисленных выше — и не дает ксантопротеиновой реакции.
В настоящее время широко известно, что желтая окраска, появляющаяся при действии азотной кислоты на белки ( ксантопротеиновая реакция), зависит от присутствия в белках триптофановой или тирозиновой групп. В качестве эталона сравнения принято пользоваться растворами ж-нитрсфенола. Этот метод дает хорошие результаты, но только в том случае, если обе упомянутые кислоты присутствуют в чистом виде; метод недостаточно точен для исследования тех смесей, где присутствуют и другие продукты гидролиза белков.
Окрашивание белковых тел, в частности кожи, в желтый цвет при их контакте с концентрированной азот-ной кислотой — ксантопротеиновая реакция — также является процессом нитрования.
В пробирку с пленочкой, снятой с кипяченого молока ( см. выше), прибавляют немного концентрированной азотной кислоты, наблюдают ксантопротеиновую реакцию.
Следует заметить, что при добавлении реактива Миллона раствор окрашивается в желтый цвет вследствие взаимодействия фенольных групп с НМО3, дающей ксантопротеиновую реакцию, которая маскирует реакцию Миллона.
Следует избегать прибавления избытка реактива Миллона, так как этот реактив содержит азотную кислоту, которая может дать желтое окрашивание ( ксантопротеиновую реакцию), маскирующее реакцию Миллона.
Следует учитывать, что в отличие от биуретовой реакции ксантопротеиновую реакцию дают не все белки, поскольку в некоторых из них может и не быть а-аминокислот, содержащих группировки ароматических соединений; например, чистая желатина ( см.) не дает ксантопротеиновой реакции.
Биуретовая, реакция состоит в том, что при нагревании раствора белка со щелочью в присутствии нескольких капель сульфата меди появляется фиолетовое окрашивание. Ксантопротеиновая реакция отличается появлением желтого окрашивания при действии на белок азотной кислоты. Наконец, реакция Миллона дает розово-красное окрашивание при нагревании белков с концентрированным раствором нитрата ртути в азотной кислоте.
При осторожном прибавлении к реакционной смеси раствора NH3 или другой щелочи появляется красно-оранжевая окраска, обусловленная образованием нитроновых кислот. Ксантопротеиновая реакция обладает высокой чувствительностью.
Структура протеинов
Отличительной чертой данных веществ по сравнению с низкомолекулярными пептидами является их развитое пространственное трехмерное строение, поддерживаемое влияниями с разной степенью притяжения. Белки обладают четырехуровневой структурой. Для каждого из них присущи свои характеристики.
За основу первичной организации их молекул взята аминокислотная последовательность, строение которых распознает ксантопротеиновая реакция на белок. Такая структура представляет собой периодически повторяющуюся пептидную связь -HN-CH-CO-, а избирательной частью являются радикалы боковой цепочки в аминокарбоновых кислотах. Именно они определяют в дальнейшем свойства вещества в целом.
Первичную белковую структуру считают достаточно прочной, это обусловлено наличием сильных ковалентных взаимодействий в пептидных связях. Образование последующих уровней происходит в зависимости от признаков, установленных на начальном этапе.
Формирование вторичной структуры возможно благодаря скручиванию аминокислотной последовательности в спираль, в которой между витками устанавливаются водородные связи.
Третичный уровень организации молекулы образуется при наложении одной части спирали на другие фрагменты с возникновением между ними всевозможных связей, с водородным, дисульфидным, ковалентным или ионным соединением. В результате получаются ассоциации в виде глобул.
Пространственное расположение третичных структур с образованием химических связей между ними приводит к формированию конечного вида молекулы или четвертичному уровню.
Качественные реакции органических веществ
В органической химии качественные реакции позволяют за считанные минуты определить класс соединения — узнать, относится ли исследуемый объект к спиртам, углеводам, альдегидам и т. д. По внешним эффектам судят о присутствии функциональных групп органических соединений в смеси или в растворе.
Белковые соединения при горении издают запах жженой шерсти. При добавлении концентрированной азотной кислоты они окрашивают раствор в ярко-желтый цвет, также характерно образование желтого осадка (ксантопротеиновая реакция). А если соединить в растворе белки со свежеосажденным гидроксидом меди (II), получится сине-фиолетовая смесь.
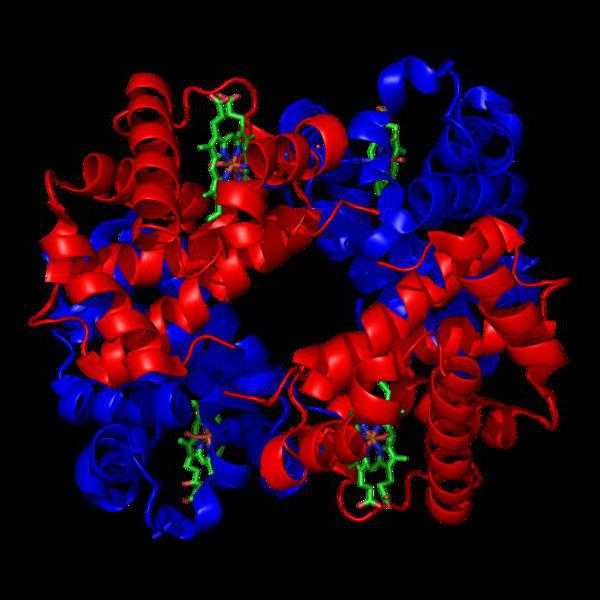
Глюкоза благодаря содержанию альдегидной группы в реакции с аммиачным раствором оксида серебра образует на стенках пробирки «серебряное зеркало». Вместе со свежеосажденным гидроксидом меди (II) она окрашивает раствор в синий цвет, а если данный раствор нагреть — происходит образование красно-оранжевого осадка.
СН2ОН — (СНОН)4 — СОН + Ag2O = СН2ОН — (СНОН)4 — СООН + 2Ag↓ — реакция «серебряного зеркала».
HOСН2 — (СНOH)4 — СН = O + 2Cu(OH)2 ⇒ HOСН2 — (СНOH)4 — СOOH + Cu2O + 2H2O — реакция глюкозы с гидроксидом меди (II).
Фенол с бромной водой образует белый осадок. Также он вступает в качественную реакцию с раствором соли трехвалентного железа — окрашивает его в фиолетовый цвет.
C6H5OH + 2Br2 ⇒ C6H2Br3OH + 3HBr — реакция с бромной водой.
3C6H5OH + FeCl3 ⇒ (C6H5O)3Fe + 3HCl — реакция с хлоридом железа (III).
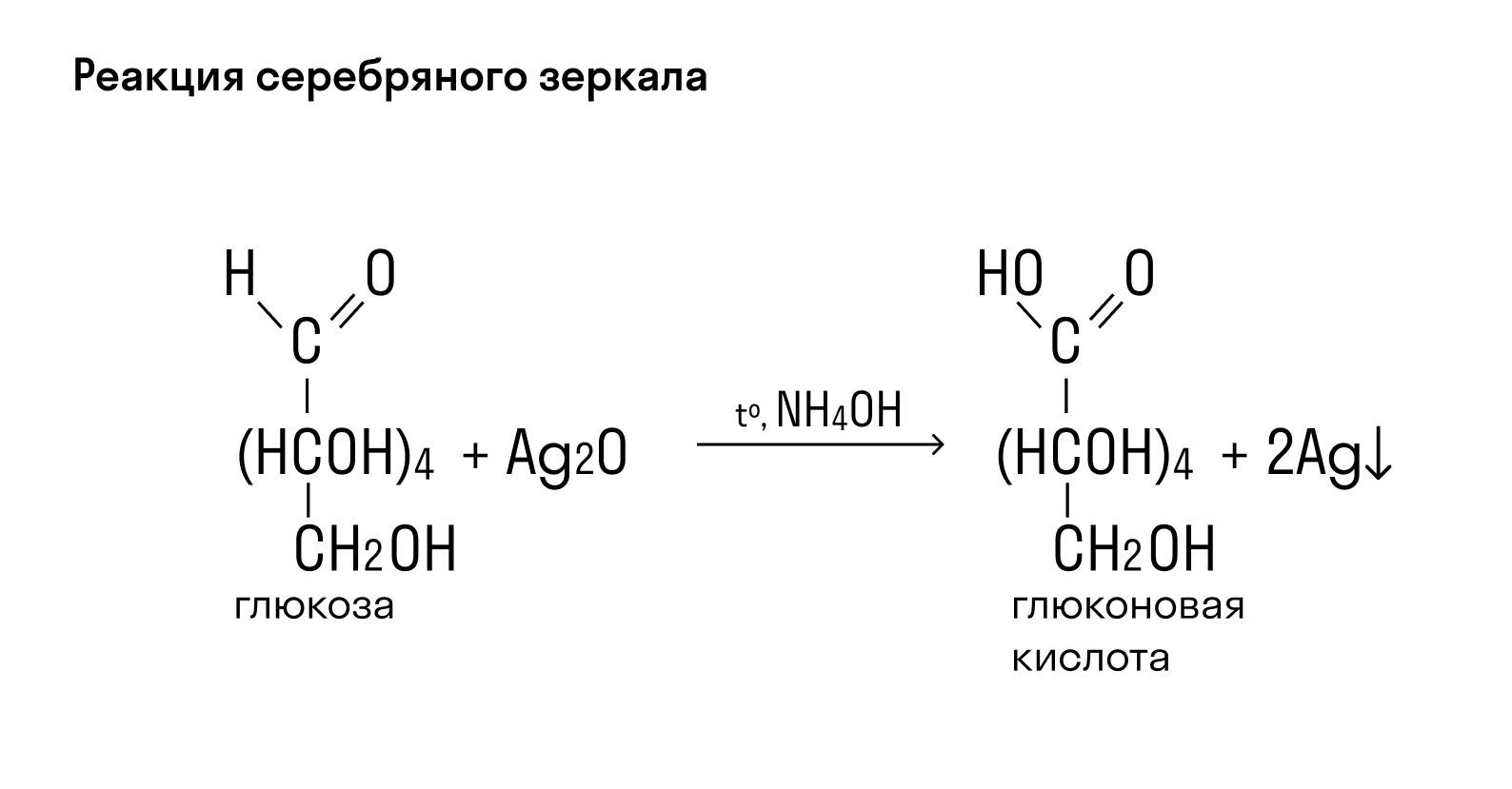
Углеводы с содержанием крахмала можно узнать по синему цвету раствора при добавлении йода. После нагревания такой раствор теряет цвет, но при охлаждении снова становится синим. Фруктозу можно идентифицировать по реакции с резорцином в растворе c соляной кислотой — смесь приобретает вишневый цвет (проба Селиванова).
I2 + (C6H10O5)n ⇒ I2(C6H10O5)n— качественная реакция крахмала с йодом.
Ссылки
- «Ксантопротеиновая реакция»Википедия, свободная энциклопедия. 2 сен 2019, 17:49 UTC. 21 окт 2019, 20:31 wikipedia.org/
- Васкес-Хорхе И., Герра-Молина Л., Кинтана-Тамайо Дж., Рамирес-Арсуага Дж., Фернандо-Баллестерос Р., Васкес-Хорхе Ю. Физико-химическая характеристика и содержание белка в жидких экстрактах мангровых устриц (Крассостреяризофоры). Кубинский Преподаватель Химии, 2014; 26 (1): 66-74. Доступно в Redalyc.
- Рохас Э., Вальбуэна Э., Торрес Дж., Гарсия А., Пиньеро М., Галиндо Л. Выделение и выполнение GMP путем осаждения сыворотки трихлоруксусной кислотой. Cient. (Маракайбо) 2009 г .; 19 (3): 295-302. Доступно на: ve.scielo.
- Васкес А. Ксантопротеиновая реакция. Испанский клинический журнал. 1949; 35 (5): 326-327. Доступно по адресу: Elsevier
- Gálvez I, Gárate O. Реакции Бехера и Эндрюса в хирургии мочевыводящих путей. Урологическая служба испанской больницы. Аргентинский урологический журнал 395-404
Химические уравнения
В две стадии проходит ксантопротеиновая реакция на белки. Формула первого этапа описывает процесс нитрования аминокислотной молекулы с помощью кислоты азотной концентрированной.
Примером может служить присоединение нитрогруппы к тирозину с образованием нитротирозина и динитротирозина. В первом случае к бензольному кольцу прикрепляется один NO2-радикал, а во втором соединении уже два атома водорода замещается на NO2. Химическая формула ксантопротеиновой реакции представлена взаимодействием тирозина с азотной кислотой с образованием молекулы нитротирозина.
Процесс нитрования сопровождается переходом бесцветной окраски в желтый тон. При проведении подобной реакции с белками, содержащими аминокислотные остатки триптофана или фенилаланина, цвет раствора также изменяется.
На втором этапе происходит взаимодействие продуктов нитрования молекулы тирозина, в частности нитротирозина, с аммония или натрия гидроксидом. В результате получается натриевая или аммонийная соль, у которых цвет желто-оранжевый. Такая реакция связана с возможностью молекулы нитротирозина переходить в хиноидную форму. В дальнейшем из нее образуется соль нитроновой кислоты, у которой имеется хиноновая система из двойных сопряженных связей.
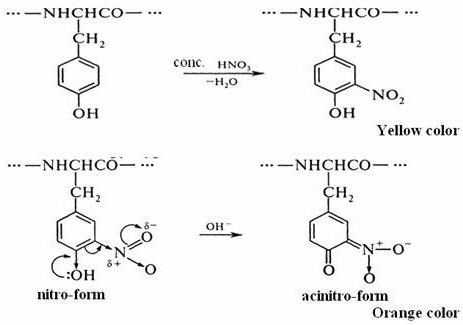
Так заканчивается ксантопротеиновая реакция на белки. Уравнение второй стадии представлено выше.
Белки
Молекулы белков построены из остатков α-аминокислот:
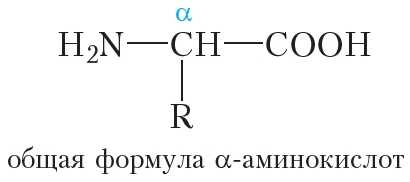
Образование молекулы белка из α-аминокислот можно представить следующей схемой: 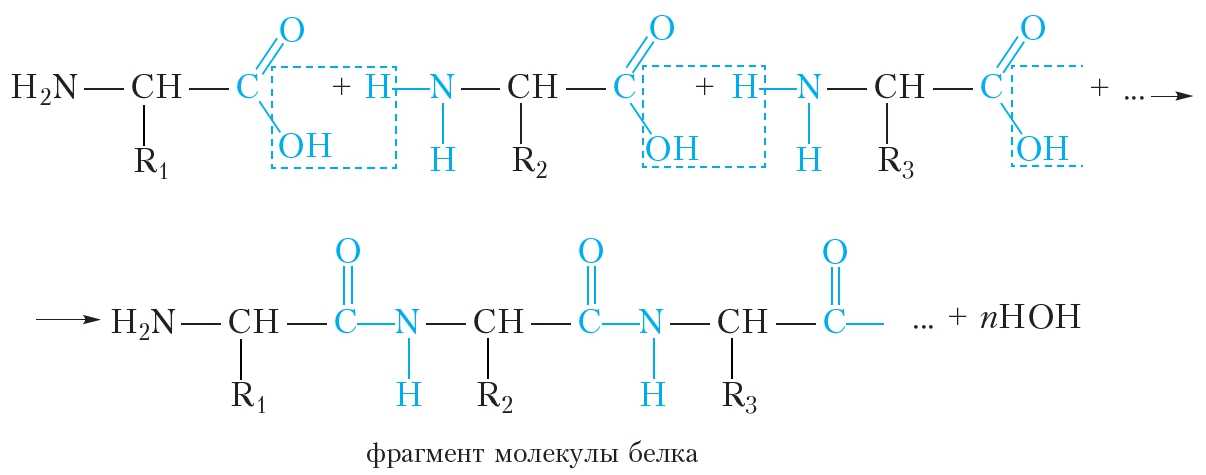
Видно, что в молекулах белков аминокислотные остатки соединены пептидными связями, следовательно, белки являются полипептидами.
Молекулы белков обычно содержат сотни и даже тысячи аминокислотных остатков. При этом наиболее часто в составе белков встречаются остатки 20 разных аминокислот (табл. 48.1).
Таблица 48.1. Некоторые аминокислоты, остатки которых входят в состав белков
|
Формула |
Название |
Обозначение |
| глицин | гли | |
|
аланин |
ала |
|
| фенилаланин | фен | |
|
серин |
сер |
|
|
цистеин |
цис |
|
| тирозин | тир |
Остатки этих аминокислот расположены в макромолекуле белка в строго определённой последовательности (рис. 48.1).
 Из рисунка 48.1 видно, что молекула белка инсулина состоит из двух полипептидных цепей, соединённых двумя дисульфидными мостиками (—S—S—). Каждая полипептидная цепь характеризуется строго определённой последовательностью аминокислотных остатков, причём остатки многих аминокислот встречаются в молекуле инсулина несколько раз. Например, из рисунка 48.1 видно, что остаток глицина (гли) встречается в молекуле инсулина дважды.
Из рисунка 48.1 видно, что молекула белка инсулина состоит из двух полипептидных цепей, соединённых двумя дисульфидными мостиками (—S—S—). Каждая полипептидная цепь характеризуется строго определённой последовательностью аминокислотных остатков, причём остатки многих аминокислот встречаются в молекуле инсулина несколько раз. Например, из рисунка 48.1 видно, что остаток глицина (гли) встречается в молекуле инсулина дважды.
Какие используют реактивы
Для проведения ксантопротеиновой реакции потребуется приготовить 1%-й раствор протеина яичного или растительного происхождения.
Обычно используют куриное яйцо, которое разбивают для дальнейшего отделения белка от желтка. Для получения раствора 1%-й протеин разводят в десятикратном количестве очищенной воды. После растворения белка полученную жидкость необходимо отфильтровать через несколько слоев марли. Такой раствор следует хранить в холодном месте.
Можно проводить реакцию с растительным белком. Для приготовления раствора используют муку пшеничную в количестве 0,04 кг. Добавляют 0,16 л очищенной воды. Ингредиенты смешивают в колбе, которую ставят на 24 часа в холодное место с температурой около +1°С. По истечении суток раствор взбалтывают, после чего проводят его фильтрацию сначала с помощью ваты, а затем − бумажного складчатого фильтра. Полученную жидкость держат в холодном месте. В таком растворе присутствует в основном альбуминовая фракция.
Для проведения ксантопротеиновой реакции в качестве основного реактива используют азотную кислоту концентрированную. Дополнительными реагентами является раствор 10%-го гидроксида натрия или аммиака, желатиновый раствор и неконцентрированный фенол.
Ксантопротеиновая реакция
|
Колориметр Дюбоска. |
Ксантопротеиновая реакция обусловливается наличием в протеиновом комплексе циклических аминокислот — тирозина и триптофана, — способных образовывать нитросоединения.
|
Схема электродиализатора. |
Ксантопротеиновая реакция, Белок с концентрированной азотной кислотой дает желтое окрашивание.
Ксантопротеиновая реакция — появление желтого окрашивания при действии на белок, содержащий бензольное кольцо, концентрированной азотной кислотой. При добавлении щелочи желтый цвет переходит в оранжевый.
Ксантопротеиновая реакция не является строго специфичной. Поскольку она обусловлена нитрованием ароматического кольца, то ее дают многие циклические соединения, не являющиеся аминокислотами, например фенол.
Ксантопротеиновая реакция связана с наличием в белках ароматических аминокислот. Желтое окрашивание появляется как результат нитрования ароматических ядер. Появление оранжевой окраски определяется образованием более интенсивно окрашенных анионов.
Ксантопротеиновая реакция обусловлена наличием в белках ароматических аминокислот. Желтое окрашивание появляется как результат нитрования ароматических ядер. Появление оранжевой окраски определяется образованием более интенсивно окрашенных анионов.
Ксантопротеиновая реакция, а) К раствору белка в пробирке приливают немного концентрированной азотной кислоты. Белок свертывается и медленно окрашивается в желтый цвет. При нагревании окрашивание наступает быстрее. При прибавлении избытка аммиака окраска переходит в оранжевую.
Ксантопротеиновая реакция является широко известной, однако для получения нитропроизводных белков часто применялись более целесообразные методы. Принято считать, что при ксанто-протеиновой реакции происходит нитрование бензольного кольца, сопровождающееся, однако, рядом побочных процессов.
Ксантопротеиновая реакция может идти и при низкой температуре, но медленно; если на кожу попадают капли концентрированной азотной кислоты, они вызывают появление желтых пятен.
Ксантопротеиновая реакция открывает наличие в белках циклических аминокислот — триптофана, фенилаланина, тирозина, содержащих бензольное ядро. Большинство белков при нагревании с концентрированной азотной кислотой дает желтое окрашивание, переходящее в оранжевое при подщелачивании. Реакция обусловлена нитрованием бензольного кольца этих аминокислот с образованием нитросоединений желтого цвета.
Ксантопротеиновая реакция — появление желтого окрашивания при действии на белок, содержащий бензольное кольцо, концентрированной азотной кислотой. При Добавлении щелочи желтый цвет переходит в оранжевый.
Ксантопротеиновая реакция позволяет обнаруживать и белки, состав которых входят остатки ароматических аминокислот.
Ксантопротеиновой реакцией определяют не только свободные, но и связанные в белках циклические аминокислоты. Большинство белков под действием концентрированной HNO3 окрашиваются в желтый цвет.
Вопросы и задания
1. Укажите число пептидных связей в молекуле вещества, формула которого:
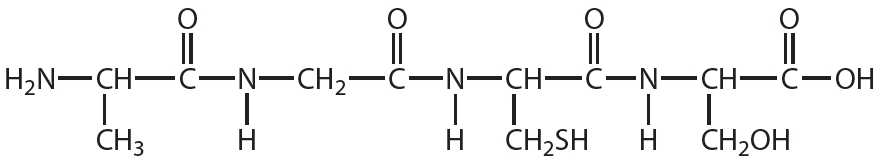
2. Напишите уравнение реакции гидролиза вещества, формула которого:
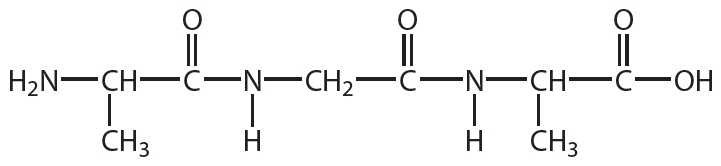
3. При полном гидролизе трипептида получена смесь аланина и фенилаланина в мольном соотношении 2 : 1. Составьте все возможные формулы трипептида.
4. При полном гидролизе трипептида получена смесь глицина, аланина и фенилаланина. Составьте все возможные формулы трипептида.
5. В молекуле инсулина человека содержится 6 атомов серы (рис. 48.1). Массовая доля серы в инсулине равна 3,3 %. Оцените молярную массу инсулина.
6. При полном гидролизе 16,5 г дипептида образовалась только одна аминокислота. Её масса равна 18,75 г. Установите строение дипептида.
7. При щелочном гидролизе 16,0 г дипептида образовалось только одно органическое вещество — натриевая соль одной из аминокислот. Масса этой соли равна 22,2 г. Установите строение дипептида.
8*. При полном кислотном гидролизе некоторого пентапептида получены триаминокислоты — глицин, аланин и фенилаланин в мольном отношении 3 : 1 : 1. При частичном гидролизе этого же пентапептида были выделены три трипептида и три дипептида. Определение N-концевых аминокислот в трёх трипептидах показало, что в двух ими является глицин, а в третьей — аланин. Определите последовательность аминокислот в молекуле пентапетида и напишите его структурную формулу.
Свойства белков
Как мы уже убедились, возможно существование огромного множества различных белков. В зависимости от строения аминокислотных остатков и их последовательности в полипептидной цепи свойства белков могут существенно различаться. Например, белок куриного яйца альбумин растворяется в воде, в то же время белки кератины, входящие в состав волос и ногтей, нерастворимы в воде. Рассмотрим некоторые химические свойства белков.
1. Гидролиз
Белки подвергаются гидролизу. При этом происходит постепенное расщепление молекулы белка. Сначала образуются продукты частичного расщепления — пептиды, имеющие молекулярную массу меньшую, чем у исходного белка. Конечными продуктами гидролиза являются α-аминокислоты, из которых построена молекула белка. Рассмотрим реакцию гидролиза на примере трипептида, состоящего из остатков фенилаланина, аланина и глицина:
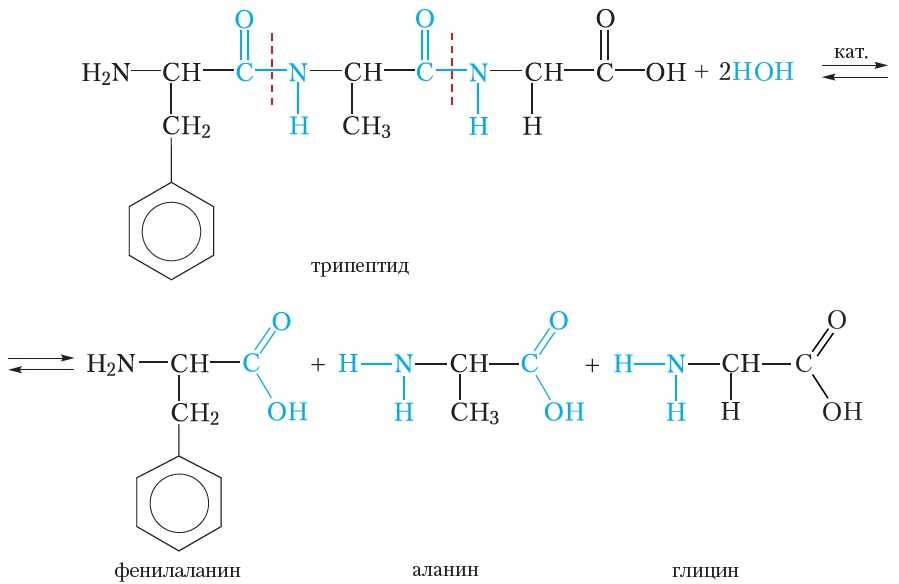
При гидролизе происходит разрыв пептидных связей в молекуле белка. В качестве катализаторов реакции гидролиза белка можно использовать кислоты или щёлочи. В живых организмах гидролиз белков катализируют ферменты.
2. Денатурация
Под действием различных факторов (нагревание, действие кислот, щелочей и др.) может произойти нарушение пространственной структуры молекулы белка (рис. 48.2). Такой процесс называется денатурацией. Например, денатурация белка происходит при варке яиц. В результате денатурации белок утрачивает присущие ему биохимические свойства. 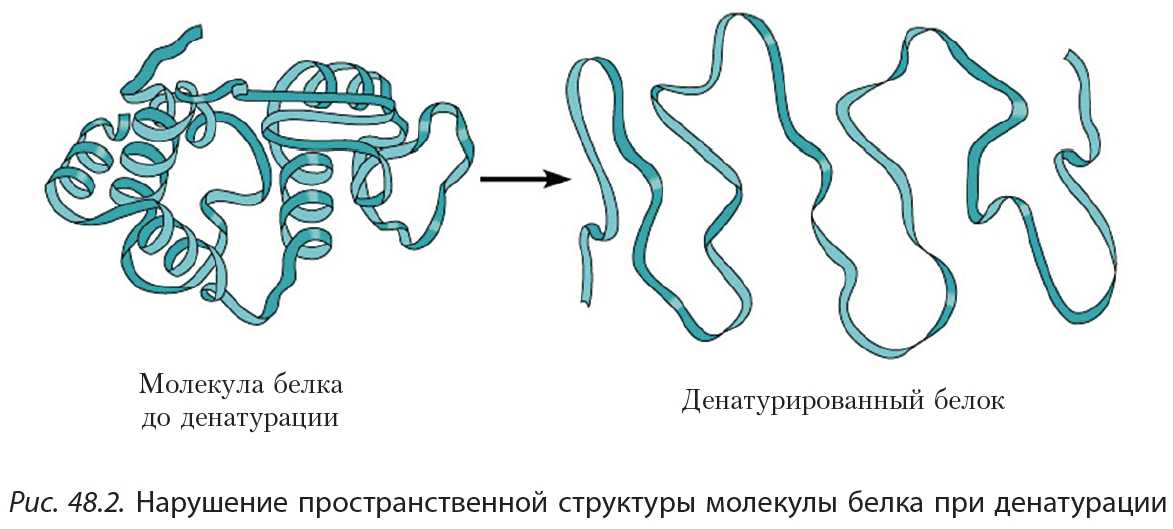
3. Биуретовая реакция (качественная реакция на белки)
Видео 48.1. Цветные реакции белков
Биуретовая реакция является качественной реакцией на белки. Если к водному раствору белка, содержащему немного щёлочи, добавить раствор сульфата меди(II), то образуется сложное комплексное соединение и раствор приобретает красно-фиолетовую окраску. В биуретовую реакцию вступают вещества, содержащие пептидные связи.
4. Ксантопротеиновая реакция
Ксантопротеиновая реакция позволяет обнаружить в белках остатки аминокислот, содержащих бензольное кольцо, например, фенилаланина и тирозина (табл. 48.1). При действии концентрированной азотной кислоты происходит нитрование бензольных колец молекул таких аминокислот:
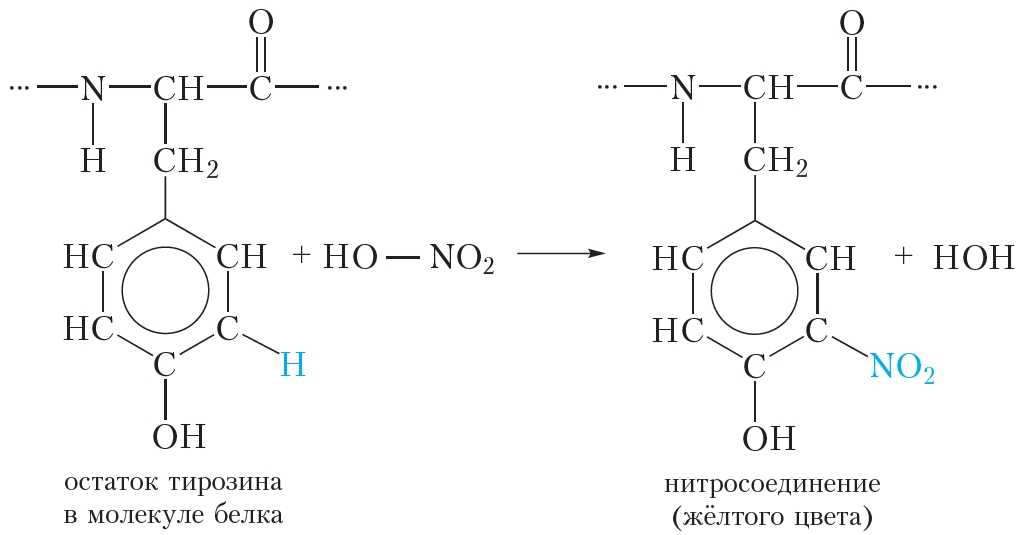
В результате реакции атомы водорода в бензольных кольцах фенилаланина и тирозина замещаются на нитрогруппы —NO2, и появляется жёлтая окраска.
В белках кожи содержится большое число остатков ароматических аминокислот. Поэтому при попадании азотной кислоты на кожу на ней появляются жёлтые пятна.
Белки в живом организме выполняют множество функций. Из белков состоят ткани органов. Катализаторами и регуляторами биохимических процессов выступают ферменты и гормоны — белковые молекулы, каждый вид которых регулирует отдельный процесс. Высокая избирательность фермента обусловлена его уникальным строением.
Белок инсулин выполняет важную роль в обмене веществ — он регулирует углеводный обмен. Недостаточная выработка этого белка поджелудочной железой приводит к тяжелому заболеванию — сахарному диабету.
Белки — важнейший компонент пищи. Если основными источниками энергии для живого организма являются жиры и углеводы, белковый компонент служит в первую очередь источником аминокислот для биосинтеза белков. При этом белки пищи расщепляются на отдельные аминокислоты, из которых затем осуществляется биосинтез. В связи с этим различают заменимые и незаменимые аминокислоты. Заменимые аминокислоты могут быть синтезированы в организме человека из других компонентов пищи, незаменимые не могут быть синтезированы, поэтому обязательно должны поступать в организм с пищей. Примеры заменимых аминокислот — глицин и аланин; незаменимых — фенилаланин и цистеин (табл. 48.1).
В заключение отметим, что, осуществляя знакомство с органической химией, мы прошли путь от простейших органических веществ — углеводородов — к белкам. Дальнейшее изучение органической химии и биологии позволит приоткрыть ещё много тайн живого мира.
Меры предосторожности
Этот тест должен выполняться обученными профессионалами. Необходимо учитывать все правила биобезопасности, поскольку используемые реагенты являются едкими кислотами и основаниями.
Если случайно на кожу или ногти упадет несколько капель азотной кислоты, они пожелтеют, так как обе структуры содержат белки. Кроме того, на коже и слизистых оболочках он вызывает сильные ожоги.
В случае контакта с кожей следует немедленно промыть пораженный участок водой с мылом в течение примерно 20 минут.
Если брызги попали в глаза, их следует промыть большим количеством пресной воды, стараясь держать глаза открытыми.
Качественный анализ
Определение состава того или иного вещества с помощью качественной реакции называют качественным анализом. В химии он часто используется перед количественным анализом, а также для того, чтобы понять, как можно разделить смесь.
Исследуемые объекты могут представлять собой твердые, жидкие или газообразные вещества, и в зависимости от этого качественный анализ проводится разными методами:
-
сухим способом — например, если внести пробу вещества в пламя горелки и отследить, как изменился цвет пламени;
-
мокрым способом — путем преобразования вещества в раствор.
Русский химик Ф. М. Флавицкий также предложил сухой метод растирания твердого исследуемого объекта с реактивом. Если реакция будет качественной, появятся характерные признаки: изменение цвета смеси, выделение газа и т. д.
Выберите идеального репетитора по химии
15 000+ проверенных преподавателей со средним рейтингом 4,8. Учтём ваш график и цель обучения
Выбрать!
































