Правило Вант- Гоффа. Уравнение Аррениуса.
для студентов направления 6070104 «Морской и речной транспорт»
«Эксплуатация судового электрооборудования и средств автоматики»,
направления 6.050702 «Электромеханика» специальности
«Электрические системы и комплексы транспортных средств»,
«Электромеханические системы автоматизации и электропривод»
дневной и заочной форм обучения
Тираж_____экз. Подписано к печати_____________.
Заказ №________. Объем 1,08 п.л.
Изд-во “Керченский государственный морской технологический университет”
98309 г. Керчь, Орджоникидзе, 82.
Правило Вант- Гоффа. Уравнение Аррениуса.
Согласно эмпирическому правилу Вант — Гоффа, сформулированному около 1880г., скорость большинства реакций увеличивается в 2-4 раза при повышении температуры на 10 градусов, если реакция проводится при температуре, близкой к комнатной. Например, время полуразложения газообразного оксида азота (V) при 35°С составляет около 85мин., при 45°С-около 22мин. и при 55°С — около 8мин.
Мы уже знаем, что при любой постоянной температуре скорость реакции описывается эмпирическим кинетическим уравнением, представляющим в большинстве случаев (за исключением реакции с весьма сложным механизмом) произведение константы скорости на концентрации реагентов в степенях, равных порядкам реакции. Концентрации реагентов практически не зависят от температуры, порядки, как показывает опыт,- тоже. Следовательно, за резкую зависимость скорости реакции от температуры ответственны константы скоростей. Зависимость константы скорости от температуры принято характеризовать температурным коэффициентом скорости реакции, которыйпредставляет собой отношение констант скорости при температурах, отличающихся на 10 градусов
; ; = ; =
=
и который по правилу Вант — Гоффа равен приблизительно 2-4.
Попытаемся объяснить наблюдаемые высокие значения температурных коэффициентов скоростей реакции на примере гомогенной реакции в газовой фазе с позиций молекулярно-кинетической теории газов. Чтобы молекулы взаимодействующих газов прореагировали друг с другом, необходимо их столкновение, при котором одни связи рвутся, а другие образуются, в результате чего и появляется новая молекула — молекула продукта реакции. Следовательно, скорость реакции зависит от числа столкновений молекул реагентов, а число столкновений, в частности, — от скорости хаотического теплового движения молекул. Скорость молекул и соответственно число столкновений растут с температурой. Однако только повышение скорости молекул не объясняет столь быстрого роста скоростей реакций с температурой. Действительно, согласно молекулярно-кинетической теории газов средняя скорость молекул пропорциональна квадратному корню из абсолютной температуры, т.е, при повышении температуры системы на 10 градусов, скажем, от 300 до 310К, средняя скорость молекул возрастет лишь в 310/300 = 1,02 раза — гораздо меньше, чем требует правило Вант -Гоффа.
Таким образом, одним только увеличением числа столкновений нельзя объяснить зависимость констант скоростей реакции от температуры. Очевидно, здесь действует еще какой-то важный фактор. Чтобы вскрыть его, обратимся к более подробному анализу поведения большого числа частиц при различных температурах. До сих пор мы говорили о средней скорости теплового движения молекул и ее изменении с температурой, но если число частиц в системе велико, то по законам статистики отдельные частицы могут иметь скорость и соответственно киетическую энергию, в большей или меньшей степени отклоняющуюся от среднего значения для данной температуры. Эта ситуация изображена на рис. (3.2), который
показывает, как распределены части-

3.2. Распределение частиц по кинетической энергии при различных температурах:
2-Т2; 3-Т3; Ti / — энергия активации химической реакции с участием катализатора.
Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором .
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например , для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
Энергия активации, уравнение Аррениуса. Катализ
Принципиальную возможность протекания реакции предсказывает химическая термодинамика (при условии (DG 0 0 = –237 кДж/моль)
Данная реакция должна принципиально осуществляется при стандартных условиях, но в действительности она не протекает вследствие наличия энергетического барьера, которым является энергия активации Еа.
Энергия активации является энергетическим барьером для начала реакции, который необходимо преодолеть реагентам, чтобы превратиться в конечный продукт реакции.
Зависимость скорости реакции от энергии активации и температуры описывается уравнением Аррениуса:
В логарифмической форме: lnКv= –(Еа/RT) + lnA,
где Кn-константа скорости реакции—, А — предэкспоненциальный множитель, R – универсальная газовая постоянная, Т — температура.
Для двух температур:
где К2, К1 – константы скорости при Т2,Т1, соответственно.
Одним из наиболее распространенных в химической практике методов ускорения химических реакций (в частности достижения явления химического равновесия) является катализ. В присутствии катализаторов изменяется путь, по которому проходит суммарная реакция, а потому изменяется ее скорость.
Катализаторы — это вещества, изменяющие скорость реакции за счет участия в промежуточном химическом взаимодействии с компонентами реакции, но восстанавливающие после каждого цикла промежуточного взаимодействия свой химический состав. Увеличение скорости катализируемой реакции связано с меньшей энергией Гиббса активации нового пути реакции.
Особенностью катализаторов является отсутствие их влияния на термодинамику реакции, т.е. происходит влияние на ΔН 0 , ΔG 0 реакции. Катализаторы ускоряют наступление химического равновесия, ускоряя одновременно скорость и прямой и обратной реакции, оставляя неизменной константу равновесия (Кр). Имеются некоторые общие закономерности каталитических процессов, позволяющих предсказывать направление реакции. В настоящее время общепризнано, что катализаторы понижают полную энергию активации процесса.
Механизм катализа объясняется, исходя из теории промежуточных соединений (основатели теории П. Сабатье, и Н. Зелинский). Допустим, между веществами А и В возможно взаимодействие с образованием соединения АВ (DG
Но в силу высокой энергии Гиббса активации эта реакция протекает с очень малой, практически равной нулю скоростью. Пусть, найдено такое третье вещество К (катализатор), которое легко вступает во взаимодействие с А (в силу другой природы реагирующих веществ, а следовательно, другой, меньшей, энергии Гиббса активации), образуя соединение АК (см. рис. 14):
Соединение АК легко взаимодействует с веществом В (опять-таки в силу иной природы веществ и малой энергии активации), образуя вещества АВ и К;
В + АК В. АК АВ + К
Согласно теории, реакция разложения активированного комплекса является лимитирующей стадией, что приводит к понижению энергии активации процесса. Суммируя два последних уравнения, получим
т.е. в результате реакции катализатор остался без изменения.
На рис. 13 показана энергетическая диаграмма хода реакции в отсутствие (кривая 1) и в присутствии (кривая 2) катализатора. Очевидно, в присутствии катализатора энергия Гиббса активации реакции снижается, т.е. ΔGакт.
Следовательно, обычно применяют катализаторы с развитой поверхностью или катализаторы, нанесенные на подложки с большой площадью поверхности (пористые угли, силикаты и др.). Механизм данных реакций очень сложен и зависит от природы реакции. Такие реакции включают стадии адсорбции и десорбции.
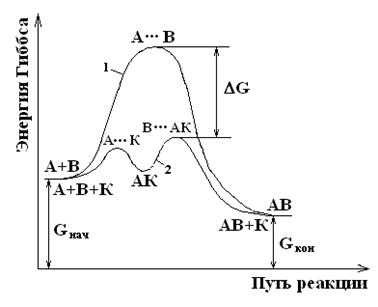
Рисунок 13. Энергетическая схема хода реакции в отсутствие и в присутствии катализатора
Предполагают, что реакции идут не на всей поверхности катализатора, а на активных центрах, т.е. участках, на которых обеспечиваются оптимальные условия реакции. Число активных центров определяется составом поверхностного слоя, способом приготовления катализатора, обработкой его поверхности. Обычно применяют тонкоизмельченные порошки. Подбор катализаторов для тех или иных реакций – дело очень сложное, т.к. необходимы активные, стабильные, а иногда селективные катализаторы, устойчивые к каталитическим ядам. К наиболее распространенным промышленным катализаторам относятся d-металлы и их оксиды. Применение катализаторов позволяет решать многие проблемы, в том числе и экологические (очистка сточных вод и промстоков). Гетерогенно-каталитическими являются процессы синтеза аммиака (катализатор железо), окисления SО2 до SО3 (катализатор платина или оксид ванадия) и т.д.






























