Спектр и его виды
Термин «спектр» был введен И. Ньютоном в трактате «Оптика». Так была названа радужная полоска, в которую разлагается белый свет, проходя через призму.
В дальнейшем выяснилось, что различные вещества дают различные спектры, и, изучая спектр, можно получить много информации об излучающем веществе. Для таких исследований используют специальные аппараты – спектрографы и спектроскопы. Эти аппараты позволяют оценить распределение энергии излучения в спектре, и либо давать визуальную картину этого распределения, либо прямо строить график.
В зависимости от рассматриваемых критериев, можно выделить следующие типы оптических спектров.
Спектры излучения и поглощения
Возбужденные атомы вещества излучают, возвращаясь в исходное состояние. Спектр, полученный таким способом, называется спектром излучения. Чаще всего, речь идет именно о таких спектрах.
Однако, если для возбуждения атомов вещества пользоваться внешним облучением, можно заметить, что разные длины волн возбуждают атомы (поглощаясь при этом) по-разному. Если белый свет пропускать через холодный газ, то после прохождения газа в спектре такого света появятся темные зоны. Такой спектр называется спектром поглощения.
Непрерывные и линейчатые спектры
Обычный тепловой спектр представляет собой непрерывную радужную полосу. Интенсивность различных частот в нем различна, однако, меняется она плавно, без резких скачков. Такой спектр называется непрерывным. Непрерывными являются большинство спектров, получаемых при нагревании твердых или жидких веществ.
Рис. 1. Непрерывный спектр.
Но, существуют и спектры другого типа. Например, если взять кусочек обычной поваренной соли, и внести его в пламя газовой горелки – пламя окрасится в интенсивный желтый цвет. Если излучение этого пламени разложить в спектр, можно будет заметить, что энергия спектра в зоне желтых цветов резко, почти скачком, увеличивается, хотя во всех остальных зонах – она будет меняться плавно. Это свойство спектру придают атомы натрия. Если взять другие вещества – можно получить резкое усиление других цветов.
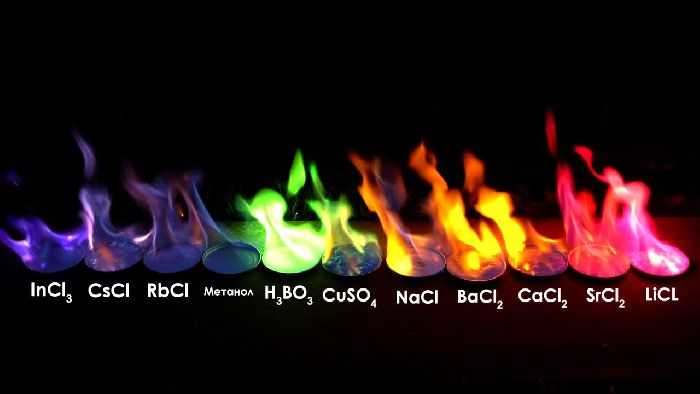 Рис. 2. Цвет пламени различных веществ.
Рис. 2. Цвет пламени различных веществ.
Проба на пламени горелки часто используется в лабораториях для грубой оценки химического состава веществ.
В спектрах, получаемых таким образом, наряду с непрерывной «тепловой» составляющей будут одна или несколько ярких полос, где интенсивность излучения резко увеличивается. Спектры такого типа называются линейчатыми.
Линейчатые спектры излучают атомы газообразных веществ при не очень больших давлениях. Это основной тип спектров. Атомы каждого вещества дают строго определенный линейчатый спектр, и по нему можно однозначно идентифицировать излучающее вещество.
Особым видом линейчатых спектров являются полосатые спектры. Линейчатый спектр излучают атомы, слабо взаимодействующие друг с другом. Когда же атомы взаимодействуют сильно (например, газ под большим давлением, или излучают целые молекулы, составленные из многих атомов), в спектре появляются широкие полосы, каждая из которых состоит из множества обычных тонких полос полосатого спектра.
 Рис. 3. Линейчатые и полосатые спектры.
Рис. 3. Линейчатые и полосатые спектры.
Что мы узнали?
По природе возникновения спектры делятся на спектры излучения и поглощения. По виду спектры делятся на непрерывные и линейчатые. Особым видом линейчатых спектров являются полосатые спектры.
-
/5
Вопрос 1 из 5
Типы спектров[]
Файл:Spectra.Classical&Function.jpg
Два представления оптического спектра: сверху «естественное» (видимое в спектроскопе), снизу — как зависимость интенсивности от длины волны. Показан комбинированный спектр излучения солнца. Отмечены линии поглощения бальмеровской серии водорода.
По характеру распределения значений физической величины спектры могут быть дискретными (линейчатыми), непрерывными (сплошными), а также представлять комбинацию (наложение) дискретных и непрерывных спектров.
Примерами линейчатых спектров могут служить масс-спектры и спектры связанно-связанных электронных переходов атома; примерами непрерывных спектров — спектр электромагнитного излучения нагретого твердого тела и спектр свободно-свободных электронных переходов атома; примерами комбинированных спектров — спектры излучения звёзд, где на сплошной спектр фотосферы накладываются хромосферные линии поглощения или большинство звуковых спектров.
Другим критерием типизации спектров служат физические процессы, лежащие в основе их получения. Так, по типу взаимодействия излучения с материей, спектры делятся на эмиссионные (спектры излучения), адсорбционные (спектры поглощения) и спектры рассеивания.
Восприятие спектра цветов[]
Рис.3,Схема спектра основных цветов и их смешения
Впервые непрерывный спектр цветов был открыт великим учёным Исааком Ньютоном. Именно Исаак Ньютон впервые обнаружил, что белый свет, пройдя через призму диспергирует (распадается) на непрерывный спектр (рис.3). Он также заметил, если все цвета полученного спектра опять смешать, то они в итоге образуют «белый» свет. Ньютон, находясь под действием европейской нумерологии и основываясь на аналогии с семью нотами в октаве (сравните: 7 металлов, 7 планет…) разделил непрерывный спектр на составляющие его 7 основных цветов. Это разбиение во многом случайно и условно.
Сейчас эти цвета называются:
- Красный
- Оранжевый
- Жёлтый
- Зелёный
- Голубой
- Синий
- Фиолетовый
Эти основные 7 цветов спектра достаточно хорошо различимы. (См. рис.3). Глаз может отличить до нескольких сотен оттенков, когда «смешаны» различные чистые спектральные цвета, или «разбавлены» белым светом. Тренированный глаз может различать значительно больше оттенков.
Физика 9 кл. Типы оптических спектров
- Подробности
- Обновлено 18.06.2019 17:31
- Просмотров: 354
1. Как выглядит сплошной спектр?
Сплошной (иначе непрерывный) спектр — это сплошная полоса, в которой представлены все цвета, плавно переходящие один в другой.
Например:
При пропускании солнечного света через призму получался спектр в виде сплошной полосы.
В ней были представлены все цвета (т. е. волны всех частот) видимого диапазона), плавно переходящие один в другой.
2. Какие тела дают сплошной спектр? Приведите примеры.
Сплошной спектр характерен для твёрдых и жидких излучающих тел, имеющих температуру порядка нескольких тысяч градусов Цельсия. Сплошной спектр дают также светящиеся газы и пары, если они находятся под очень высоким давлением (т. е. если силы взаимодействия между их молекулами достаточно велики).
Например:
Свет от раскаленной нити электрической лампы, светящаяся поверхность расплавленного металла, пламя свечи.
3. Как выглядят линейчатые спектры?
Линейчатые спектры представляют собой наборы отдельных линий определенных цветов.
Разные химические элементы дают свои собственные наборы отдельных линий.
5. Каким образом можно получить линейчатый спектр испускания натрия?
Если внести в пламя спиртовки кусочек поваренной соли, то пламя окрасится в жёлтый цвет, а в спектре, наблюдаемом с помощью спектроскопа, будут видны две близко расположенные жёлтые линии, характерные для спектра паров натрия.
Под действием высокой температуры молекулы NaCl распались на атомы натрия и хлора.
Свечение атомов хлора возбудить гораздо труднее, чем атомов натрия, поэтому в данном опыте линии хлора не видны.
6. От каких источников света получаются линейчатые спектры?
Линейчатые спектры получают от газов и паров малой плотности, при которой свет излучается изолированными атомами.
7. Каков механизм получения линейчатых спектров поглощения (т. е. что нужно сделать, чтобы получить их)?
Линейчатые спектры поглощения дают газы малой плотности, состоящие из изолированных атомов, когда сквозь них проходит свет от яркого и более горячего (по сравнению с температурой самих газов) источника, дающего непрерывный спектр.
8. Как получить линейчатый спектр поглощения натрия и как он выглядит?
Линейчатый спектр поглощения натрия можно получить, если пропустить свет от лампы накаливания через сосуд с парами натрия, температура которых ниже температуры нити лампы накаливания.
В этом случае в сплошном спектре света от лампы появится узкая чёрная линия как раз в том месте, где располагается жёлтая линия в спектре испускания натрия.
Это и будет линейчатый спектр поглощения натрия.
Линии поглощения атомов натрия точно соответствуют его линиям испускания.
8. В чем заключается суть закона Кирхгофа, касающегося линейчатых спектров излучения и поглощения?
Общий для всех химических элементов закон был открыт в середине XIX в. немецким физиком Густавом Кирхгофом: Атомы данного элемента поглощают световые волны тех же самых частот, на которых они излучают.
Спектр атомов каждого химического элемента уникален.
Не существует двух химических элементов, атомы которых излучали бы одинаковый набор спектральных линий.
Следующая страница — смотреть
Назад в «Оглавление» — смотреть
История[]
Исторически раньше всех прочих спектров было начато исследование оптических спектров. Первым был Исаак Ньютон, который и ввёл в научный обиход термин «спектр» для обозначения полученной им в опытах над солнечным светом многоцветной полосы, похожей на радугу. В своём труде «Оптика», вышедшем в 1704 году, опубликовал результаты своих опытов разложения с помощью треугольной стеклянной призмы белого видимого света на отдельные компоненты различной цветности и преломляемости, то есть получил спектры солнечного излучения, и объяснил их природу, показав, что цвет есть собственное свойство света, а не вносятся призмой, как утверждал Роджер Бэкон в XIII веке. Фактически, Ньютон заложил основы оптической спектроскопии: в «Оптике» он описал все три используемых поныне метода разложения света — преломление, интерференцию и дифракцию, а его призма с коллиматором, щелью и линзой была первым спектроскопом.
Следующий этап наступил через 100 лет, когда Уильям Волластон в 1802 году наблюдал тёмные линии в солнечном спектре, но не придал своим наблюдениям значения. В 1814 году эти линии независимо обнаружил и подробно описал Фраунгофер (сейчас линии поглощения в солнечном спектре называются линиями Фраунгофера), но не смог объяснить их природу. Фраунгофер описал свыше 500 линий в солнечном спектре и отметил, что положение линии D близко к положению яркой жёлтой линии в спектре пламени.
В 1854 году Кирхгоф и Бунзен начали изучать спектры пламени, окрашенного парами металлических солей, и в результате ими были заложены основы спектрального анализа, первого из инструментальных спектральных методов — одних из самых мощных методов экспериментальной науки.
В 1859 году Кирхгоф опубликовал в журнале «Ежемесячные сообщения Берлинской академии наук» небольшую статью «О фраунгоферовых линиях». В ней он писал:
Спектроскоп Кирхгофа-Бунзена, Annalen der Physik und der Chemie (Poggendorff), Vol. 110 (1860).
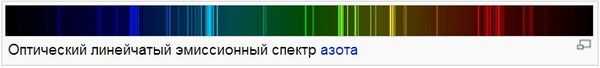
Оптический линейчатый эмиссионный спектр азота
Примечательно, что эта работа Кирхгофа неожиданно приобрела и философское значение: ранее, в 1842 году, основоположник позитивизма и социологии Огюст Конт в качестве примера непознаваемого привёл именно химический состав Солнца и звёзд:
Работа Кирхгофа позволила объяснить природу фраунгоферовых линий в спектре Солнца и определить химический (или, точнее, элементный) состав его атмосферы.
Спектральный анализ открыл новую эпоху в развитии науки — исследование спектров как наблюдаемых наборов значений функции состояния объекта или системы оказалось чрезвычайно плодотворным и, в конечном итоге, привело к появлению квантовой механики: Планк пришёл к идее кванта в процессе работы над теорией спектра абсолютно чёрного тела.
В 1910 году были получены первые неэлектромагнитные спектры: Дж. Дж. Томсон получил первые масс-спектры, а затем в 1919 году Астон построил первый масс-спектрометр.
С середины XX века, с развитием радиотехники, получили развитие радиоспектроскопические, в первую очередь магнито-резонансные методы — спектроскопии ядерного магнитного резонанса (ЯМР-спектроскопия, являющаяся сейчас одним из основных методов установления и подтверждения пространственной структуры органических соединений), электронного парамагнитного резонанса (ЭПР), циклотронного резонанса (ЦР), ферромагнитного (ФР) и антиферромагнитного резонанса (АФР).
Другим направлением спектральных исследований, связанным с развитием радиотехники, стала обработка и анализ первоначально звуковых, а потом и любых произвольных сигналов.
Спектры произвольных сигналов: частотное и временное представления[]
Файл:FT-NMR.Spectra.png
Спектр ядерного магнитного резонанса (1H), полученный методом Фурье-спектроскопии ЯМР. Красным показан исходный временной спектр (интенсивность-время), синим — частотный (интенсивность-частота), полученный Фурье-преобразованием.
В 1822 Фурье, занимавшийся теорией распространения тепла в твёрдом теле, опубликовал работу «Аналитическая теория тепла», сыгравшую значительную роль в последующей истории математики. В этой работе он описал метод разделения переменных (преобразование Фурье), основанный на представлении функций тригонометрическими рядами (ряды Фурье). Фурье также сделал попытку доказать возможность разложения в тригонометрический ряд любой произвольной функции, и, хоть его попытка оказалась неудачна, она, фактически, стала основой современной цифровой обработки сигналов.
Оптические спектры, например, Ньютоновский, количественно описываются функцией зависимости интенсивности излучения от его длины волны f(λ){\displaystyle f(\lambda )} или, что эквивалентно, от частоты f(ω){\displaystyle f(\omega )}, то есть функция f(ω){\displaystyle f(\omega )} задана на частотной области (frequency domain). Частотное разложение в этом случае выполняется анализатором спектроскопа — призмой или дифракционной решеткой.
В случае акустики или аналоговых электрических сигналов ситуация другая: результатом измерения является функция зависимости интенсивности от времени j(τ){\displaystyle j(\tau )}, то есть эта функция задана на временной области (time domain). Но, как известно, звуковой сигнал является суперпозицией звуковых колебаний различных частот, то есть такой сигнал можно представить и в виде «классического» спектра, описываемого f(ω){\displaystyle f(\omega )}.
Именно преобразование Фурье однозначно определяет соответствие между j(τ){\displaystyle j(\tau )} и f(ω){\displaystyle f(\omega )} и лежит в основе
Фурье-спектроскопии.






























