Содержание
В аденилатциклаза или аденилциклаза это фермент, ответственный за преобразование АТФ, молекулы с высокой энергией, в циклический АМФ, важную сигнальную молекулу, которая активирует различные циклически зависимые белки АМФ с важными физиологическими функциями.
Его активность контролируется различными факторами, такими как, например, согласованное действие гормонов, нейротрансмиттеров и других регуляторных молекул разной природы (двухвалентные ионы кальция и G-белки).
Основное значение этого фермента заключается в важности продукта реакции, которую он катализирует, циклического АМФ, поскольку он участвует в контроле многих клеточных явлений, связанных с метаболизмом и развитием, а также в ответе на различные внешние раздражители. В природе как одноклеточные организмы (относительно простые), так и крупные и сложные многоклеточные животные используют циклический АМФ в качестве вторичного посредника и, следовательно, ферменты, которые его производят
В природе как одноклеточные организмы (относительно простые), так и крупные и сложные многоклеточные животные используют циклический АМФ в качестве вторичного посредника и, следовательно, ферменты, которые его производят.
Филогенетические исследования устанавливают, что эти ферменты произошли от общего предка до разделения эубактерий и эукариот, предполагая, что циклический АМФ имел разные функции, возможно, связанные с производством АТФ.
С таким утверждением можно согласиться, поскольку реакция, катализируемая аденилатциклазой, легко обратима, что можно увидеть по константе равновесия для синтеза АТФ (Kэкв ≈ 2.1 ± 0.2 10-9 M2).
Биология — Передача сигнала в клетке — Аденилатциклазная система
Передача сигнала в клетке
Протеинкиназа А и киназа фосфорилазы
Киназа фосфорилазы, гликогенфосфорилаза и гликоген
В данном случае аденилатциклазная система рассматривается на примере действия адреналина на клетки печени. Адреналин вызывает в организме эффект, называемый «fight or flight» усиливается тонус мышц, увеличивается частота сердечных сокращений. Для мобилизации организма требуется повышение концентрации глюкозы в крови. Связывание адреналина с рецепторами на поверхности клеток печени запускает распад гликогена, запасенного в клетках печени и высвобождение глюкозы.
Активация
- Адреналин связывается с β2-адренорецептором на плазматической мембране клеток печени. В результате связывания лиганда с внешней стороны плазматической мембраны, изменяется конформация всего адренорецептора и активируется сопряженный с адренорецептором, внутриклеточный G-белок.
- В неактивном состоянии G-белок связан с молекулой ГДФ. После активации ГДФ заменяется на ГТФ, а G-белок разделяется на две части.
- Активная часть G-белка присоединяется к ферменту аденилатциклазе и активирует ее. Аденилатциклаза катализирует превращение АТФ в цАМФ.
- цАМФ является вторичным посредником этой цепи передачи сигнала в клетке. Далее цАМФ распространяется по всей клетке и связывается с цАМФ-зависимой протеинкиназой А, причем с одной молекулой протеинкиназы связывается 4 молекулы цАМФ.
- Активированная протеинкиназа А разделяется на четыре части, две из которых обладают каталитическими активностями. Каждая из каталитических субъединиц способна фосфорилировать киназу фосфорилазы, активируя ее.
- Наконец, киназа фосфорилазы фосфорилирует гликогенфосфорилазу
- Активированная гликогенфосфорилаза расщепляет гликоген, при этом образуется глюкозо-1-фосфат, которая поступает в кровь.
Особенность этой системы передачи сигнала в клетке состоит в том, что сигнал на большинстве этапов усиливается, например, активированная аденилатциклаза синтезирует множество молекул цАМФ. В результате взаимодействия одной молекулы адреналина с рецептором в плазматической мембране клетки печени, в кровь выводится около 10 миллионов молекул глюкозы.
Инактивация
Для поддержания корректного уровня метаболизма требуется не только быстрое поступление глюкозы в кровь, но и механизм выключения этой системы. Для этого используется несколько способов.
- Когда концентрация адреналина в крови уменьшается, молекулы адреналина естественным образом отсоединяются от β2-адренорецептора
- Если адреналин не отсоединяется от β2-адренорецептора, то рецептор фосфорилируется киназой β2-адренорецептора, а затем инактивируется β-аррестином
- G-белок сам обладает ферментативной активностью и медленно превращает ГТФ в ГДФ. После этого он отходит от аденитциклазы, и она инактивируется
- Фермент фосфодиэстераза катализирует превращение цАМФ в АМФ
- Ферменты фосфатазы дефосфорилируют киназу фосфорилазы и гликогенфосфорилазу
Результат действия адреналина на другие типы клеток зависит от того, какие рецепторы находятся в их плазматических мембранах. Так, например, в результате связывания адреналина c альфа-2 адренорецептором, количество цАМФ внутри клетки уменьшается.
|
Информоны |
Протеинкиназы >>> |
Место расположения
Было определено, что, как и многие интегральные мембранные белки, такие как G-белки, белки с фосфатидилинозитольными якорями и многие другие, аденилциклазы обнаруживаются в особых мембранных областях или микродоменах, известных как «липидные рафты» (от английский «Липидный плот»).
Эти мембранные домены могут достигать сотен нанометров в диаметре и состоят в основном из холестерина и сфинголипидов с длинными цепями преимущественно насыщенных жирных кислот, что делает их менее текучими и позволяет размещать трансмембранные сегменты различных белки.
Аденилатциклазы также были обнаружены связанными с подобластями липидных рафтов, известными как «кавеолы» (от английского «кавеолы »), которые представляют собой скорее инвагинации мембраны, богатой холестерином и связанным с ним белком, называемым кавеолином.
Структурные характеристики
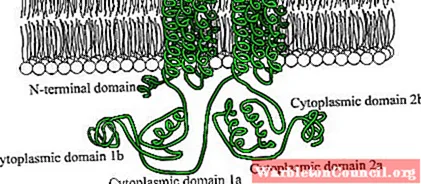
Это белки, состоящие из больших полипептидных цепей (из более чем 1000 аминокислотных остатков), которые 12 раз пересекают плазматическую мембрану через две области, состоящие из шести трансмембранных доменов конформации альфа-спирали.
Каждая трансмембранная область разделена большим цитозольным доменом, который отвечает за каталитическую активность.
Среди эукариотических организмов есть некоторые консервативные мотивы во фрагменте аминоконцевой области этих ферментов, а также в цитоплазматическом домене около 40 кДа, который ограничен гидрофобными участками.
Каталитический сайт
Реакция, которую катализируют эти ферменты, то есть образование диэфирной связи посредством нуклеофильной атаки группы ОН в положении 3 ‘на фосфатную группу нуклеозидтрифосфата в положении 5’, зависит от общего структурного мотива, известного как домен Пальма».
Эта область «ладони» состоит из мотива «βαβααβ«(« »Означает β-складчатые листы и« α »- альфа-спирали) и имеет два инвариантных остатка аспарагиновой кислоты, которые координируют два иона металла, ответственных за катализ, которые могут быть двухвалентными ионами магния или магния. цинк.
Многие исследования, связанные с четвертичной структурой этих ферментов, показали, что их каталитическая единица существует в виде димера, образование которого зависит от трансмембранных сегментов, которые соединяются в эндоплазматическом ретикулуме во время образования белка.
Регулирование
Большое структурное разнообразие аденилциклаз показывает большую подверженность множественным формам регуляции, что позволяет им интегрироваться в широкий спектр клеточных сигнальных путей.
Каталитическая активность некоторых из этих ферментов зависит от альфа-кетокислот, в то время как другие обладают гораздо более сложными регуляторными механизмами, включающими регуляторные субъединицы (путем стимуляции или ингибирования), которые зависят, например, от кальция и других обычно растворимых факторов, а также других белков.
Многие аденилатциклазы негативно регулируются субъединицами некоторых G-белков (ингибируют их функцию), в то время как другие обладают более активным действием.
Ссылки
- Купер, Д. М. Ф. (2003). Регулирование и организация аденилатциклаз и цАМФ. Биохимический журнал, 375, 517–529.
- Купер Д., Монс Н. и Карпен Дж. (1995). Аденилилциклазы и взаимодействие между передачей сигналов кальция и цАМФ. Природа, 374, 421–424.
- Данчин, А. (1993). Филогения аденилилциклазов. Достижения в исследованиях второго мессенджера и фосфопротеинов, 27, 109–135.
- Ханун Дж. И Дефер Н. (2001). Регуляция и роль изоформ аденилциклазы. Энн. Rev. Pharmacol. Toxicol., 41, 145–174.
- Линдер У. и Шульц Дж. Э. (2003). Аденилилциклазы класса III: многоцелевые сигнальные модули. Сотовая связь, 15, 1081–1089.
- Тан В. и Гилман А. Г. (1992). Аденилиловые циклазы. Ячейка, 70, 669–672.
Аденилатциклазы млекопитающих
У млекопитающих было клонировано и описано по крайней мере девять типов этих ферментов, кодируемых девятью независимыми генами и принадлежащих к классу аденилциклазы III.
У них общие сложные структуры и топология мембран, а также характерные для них дублированные каталитические домены.
Для млекопитающих номенклатура, используемая для обозначения изоформ, соответствует буквам AC (для аденилатциклаза) и числа от 1 до 9 (AC1 — AC9). Также сообщалось о двух вариантах фермента AC8.
Изоформы, присутствующие у этих животных, гомологичны в отношении последовательности первичной структуры их каталитических центров и трехмерной структуры. Включение одного из этих ферментов в каждый «тип» в основном связано с регуляторными механизмами, которые действуют на каждую изоформу.
У них есть паттерны экспрессии, которые часто зависят от ткани. Все изоформы можно найти в головном мозге, хотя некоторые из них ограничены определенными областями центральной нервной системы.
Характеристики
Основная функция ферментов, принадлежащих к семейству аденилатциклаз, заключается в превращении АТФ в циклический АМФ, и для этого они катализируют образование внутримолекулярной 3′-5′-диэфирной связи (реакция, аналогичная реакции, катализируемой ДНК-полимеразами). с выделением молекулы пирофосфата.
У млекопитающих различные варианты, которые могут быть достигнуты, связаны с пролиферацией клеток, этанольной зависимостью, синаптической пластичностью, лекарственной зависимостью, циркадным ритмом, обонятельной стимуляцией, обучением и памятью.
Некоторые авторы предположили, что аденилатциклазы могут выполнять дополнительную функцию как молекулы-переносчики или, что то же самое, канальные белки и переносчики ионов.
Однако эти гипотезы были проверены только на основе расположения или топологии трансмембранных сегментов этих ферментов, которые имеют некоторые гомологии или структурные сходства (но не последовательность) с определенными ионными транспортными каналами.
И циклический AMP, и PPi (пирофосфат), которые являются продуктами реакции, выполняют функции на клеточном уровне; но их важность зависит от организма, в котором они находятся





























