История открытия бензола. Строение молекулы
Бензол был открыт в начале прошлого века. Это было загадочное вещество. Многие учёные пытались разгадать его строение, объяснить его свойства, но не могли. Почему?
Дело в том, что было установлено: состав молекулы бензола выражается формулой
Задание 21.1. По составу молекулы определите, является ли это вещество предельным или непредельным углеводородом.
Если сравнить состав бензола с соответствующим алканом, легко видеть, что бензол — сильно ненасыщенное соединение. Для того чтобы превратиться в алкан, бензол должен присоединить 8 атомов (4 молекулы) водорода. Но оказалось, что бензол, присоединяя 3 молекулы водорода, превращается в вещество циклического строения:
Значит, и бензол имеет циклическое строение!
Теперь возникает вопрос: какие связи соединяют атомы углерода в молекуле бензола? В 1865 году немецкий химик Кекуле* предложил такую модель молекулы бензола:

Эта модель объясняла многие свойства бензола, но не объясняла особенности химических свойств этого соединения. Ведь если углеводород имеет три двойные связи, то он должен давать качественные реакции на двойную (кратную) связь.
Вопрос. Какие вы знаете качественные реакции на кратную связь?
Но оказалось, что бензол эти качественные реакции не даёт, т. е.
- не обесцвечивает бромную воду (при нормальных условиях);
- не обесцвечивает раствор перманганата калия.
Значит, двойных связей в молекуле бензола НЕТ!
Дальнейшие исследования показали, что в молекуле бензола существует особая, очень прочная ароматическая связь. Рассмотрим её образование на примере бензола.
Как уже было сказано, бензол имеет циклическое строение, причём атомы углерода соединены в правильный шестиугольник при помощи простых σ-связей. Такие σ-связи соединяют атомы углерода и водорода:
Вопрос. Сколько связей образовал каждый атом углерода? Сколько электронов участвует в образовании этих связей?
Поскольку каждый атом углерода имеет по четыре валентных электрона, а в образовании трёх простых σ-связей участвовало по три электрона каждого атома, — у каждого атома углерода осталось по одному «лишнему» электрону (•). Эти электроны объединяются и образуют единую электронную систему — ароматическую связь:
Задание. Соедините точки линией, не отрывая карандаш от бумаги. Что у Вас получилось? Окружность.
Ароматическая связь в молекулах обозначается кружочком:

Формулы (1) и (1а) отражают строение одного и того же вещества бензола, состава С6Н6. Записывая формулу бензола (1а), следует помнить, что:
- в вершинах этого правильного шестиугольника находится атом углерода;
- каждый атом углерода соединён с одним атомом водорода.
Химическое строение циклопарафинов
Циклопарафины – это соединения, состоящие из замкнутой цепи атомов углерода, образующих кольцо. Интересно, что структура этих соединений может быть очень разнообразной: от простых однокомпонентных кольцевых структур до сложных поликольцевых соединений, в которых кольца связаны между собой. Особенностью связей между атомами углерода в циклопарафинах является их необычайная устойчивость и жесткость, которая определяется геометрией молекул. Это свойство позволяет использовать циклопарафины в различных областях науки и техники, например, в качестве катализаторов, лубрикантов, материалов для оптических приборов и т.д. Кроме того, циклопарафины могут быть использованы в фармацевтической промышленности для создания новых лекарственных препаратов, так как они обладают низкой токсичностью и хорошей растворимостью.
Способы получения соединений, применение
Циклоалканы получают путем дегидрирования алканов. При этом алканы, у которых углеродный скелет удлинен, а количество углеродных атомов в главной цепи составляет от 5 и более, нагревают в присутствии металлов, катализирующих процесс. Процесс сопровождается образованием циклических соединений.
При дегидроциклизации отщепляется водород, и образуется замкнутый цикл. Пентан и его гомологи, которые содержат пять углеродных атомов в основной цепи, при нагреве над платиновым катализатором формируют циклопентан и его гомологи:
Алканы с углеродной цепью, в которой содержится 6 и более углеродных атомов в главной цепи, в процессе дегидрирования формируют стабильные шестиатомные (шестичленные) циклы. Таким образом, происходит образование циклогексана и его гомологов.
При увеличении температуры гексан в присутствии оксида хрома (III) в зависимости от условий способен формировать циклогексан и далее бензол:
В процессе дегидрирования гептан при наличии катализатора способен формировать метилциклогексан, а затем, толуол:
Дегидроциклизация алканов является наиболее распространенным методом синтеза циклоалканов в промышленных объемах.
Образование циклогексана в процессе гидрирования бензола при повышении температуры и наличии катализатора:
Гидрирование толуола с образованием метилциклогексана:
С помощью данного метода получают исключительно циклогексан и его гомологи с шестичленным кольцом.
Еще одним способом получения циклоалканов является дегалогенирование дигалогеналканов. Процесс протекает под действием активных металлов. Используют дигалогеналканы, в которых между атомами галогенов размещено от трех и более углеродных атомов.
Химическая реакция 1,4-дибромбутана с цинком сопровождается образованием циклобутана:
С помощью дегалогенирования дигалогеналканов синтезируют циклоалканы определенного строения, включая циклоалканы с малыми циклами .
На промышленных предприятиях нефтехимической отрасли применяют нафтены, как сырье для производства ароматических углеводородов с помощью каталитического риформинга. Наиболее ценным с практической точки зрения является циклогексан. Данное вещество используют в синтезе таких материалов, как:
- капролактам;
- адипиновая кислота;
- другие соединения, которые используют для получения синтетических волокон.
Циклопропан используют для наркоза. Применение данного соединения имеет некоторые ограничения по причине взрывоопасности.
Свойства циклоалканов
Физические свойства циклоалканов закономерно изменяются с ростом их молекулярной массы. Пpи ноpмальных условиях циклопpопан и циклобутан – газы, циклоалканы С 5 Н 10 – С 16 Н 32 – жидкости, начиная с С 17 Н 34 , – твердые вещества. Температуры кипения циклоалканов выше, чем у соответвующих алканов. Это связано с более плотной упаковкой и более сильными межмолекулярными взаимодействиями циклических структур.
Химические свойства циклоалканов сильно зависят от размера цикла, определяющего его устойчивость. Трех- и четырехчленные циклы ( малые циклы ), являясь насыщенными, тем не менее, резко отличаются от всех остальных предельных углеводородов. Валентные углы в циклопропане и циклобутане значительно меньше нормального тетраэдрического угла 10928’, свойственного sp 3 -гибридизованному атому углерода.
Это приводит к большой напряженности таких циклов и их стремлению к раскрытию под действием реагентов. Поэтому циклопропан, циклобутан и их производные вступают в реакции присоединения , проявляя характер ненасыщенных соединений. Легкость реакций присоединения уменьшается с уменьшением напряженности цикла в ряду:
циклопропан > циклобутан >> циклопентан.
Наиболее устойчивыми являются 6-членные циклы, в которых отсутствуют угловое и другие виды напряжения.
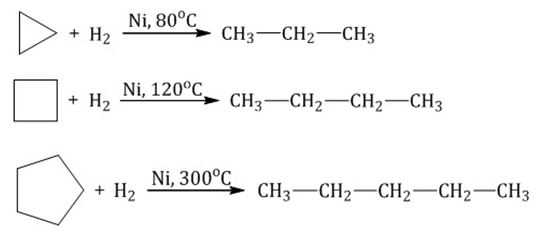
Малые циклы (С 3 Н 6 – С 4 Н 8 ) довольно легко вступают в реакции гидрирования:
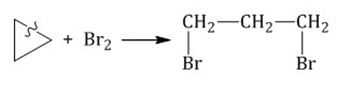
Циклопропан и его производные присоединяют галогены и галогеноводороды:
В других циклах (начиная с С 5 ) угловое напряжение снимается благодаря неплоскому строению молекул. Поэтому для циклоалканов (С 5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т.е. реакции замещения .
Эти соединения, подобно алканам, вступают также в реакции дегидрирования, окисления в присутствии катализатора и др.
Столь резкое отличие в свойствах циклоалканов в зависимости от размеров цикла приводит к необходимости рассматривать не общий гомологический ряд циклоалканов, а отдельные их ряды по размерам цикла. Например, в гомологический ряд циклопропана входят: циклопропан С 3 Н 6 , метилциклопропан С 4 Н 8 , этилциклопропан С 5 Н 10 и т.д.
Практическое значение циклопарафинов.
Циклопарафины находят широкое применение в различных отраслях науки и техники. Например, они используются в нефтехимической промышленности для производства бензина, дизельного топлива, смазочных материалов и других нефтепродуктов. Также циклопарафины играют важную роль в производстве пластиков и резиновых изделий. Они также применяются в медицине для создания лекарственных препаратов и других медицинских изделий.
Циклопарафины представляют собой интересный класс углеводородов, имеющих кольцевую структуру. Они обладают уникальными свойствами, такими как высокая термическая стабильность и низкая реакционная способность. В связи с этим циклопарафины находят широкое применение в нефтехимической промышленности, производстве пластиков и резиновых изделий, а также в медицине.
Изучение циклопарафинов является важным направлением современной химии, и многие ученые посвятили свою жизнь этому классу углеводородов. Среди них можно назвать Фридриха Августа Кекуле, который разработал теорию о строении бензольного кольца и открыл циклические углеводороды, а также Витторио Сильвестри, который провел многочисленные исследования в области синтеза циклопарафинов.
Некоторые свойства циклопарафинов
| Свойство | Описание |
|---|---|
| Точка плавления | Высокая точка плавления в сравнении с линейными углеводородами той же молекулярной массы |
| Точка кипения | Высокая точка кипения в сравнении с линейными углеводородами той же молекулярной массы |
| Растворимость | Плохая растворимость в воде, хорошая растворимость в органических растворителях |
| Химическая | Низкая реакционная способность, не реагируют с кислородом и щелочами, могут реагировать с кислотами и другими веществами |
Изучение циклопарафинов является ключевым элементом в науке и технике, а также для понимания основных принципов химических реакций и свойств углеводородов. Циклопарафины представляют собой класс соединений, обладающих уникальными свойствами и широким спектром применения в промышленности. Исследования в этой области позволяют улучшить процессы синтеза, повысить эффективность различных промышленных процессов и создать новые материалы с уникальными свойствами.
Циклопарафины находят широкое применение в качестве растворителей, а также в производстве пищевых добавок, косметических средств и лекарственных препаратов. Благодаря своим химическим свойствам, они также используются в качестве мономеров при синтезе полимеров.
Таким образом, изучение циклопарафинов является важным направлением научных исследований, которые способствуют развитию не только химии, но и промышленности в целом.
Изомерия и номенклатура
Изомерия циклоалканов может быть двух типов:
- структурная, возникающая вследствие различий в строении;
- пространственная, связанная с вариантами конфигурации одинаковых по строению молекул.
Виды структурной изомерии циклоалканов
- Существование изомеров из разных классов веществ
Гомологические ряды соединений, атомный состав которых описывается одной формулой – алкены и циклоалканы – обладают межклассовой изомерией по отношению друг к другу:

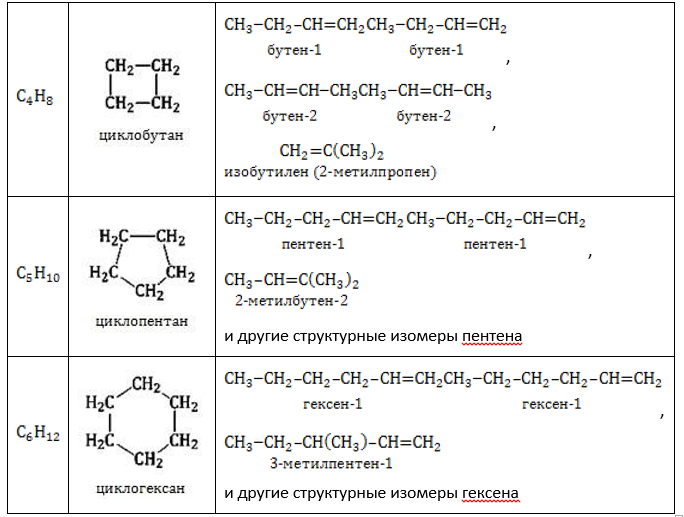
- Изомерия углеродного скелета
Возникновение изомеров данного вида зависит от трех факторов.
- размер цикла:
- строение радикала:
- расположение радикалов в цикле:
Пространственная изомерия
Циклоалканы способны образовывать геометрические изомеры. Они возникают вследствие невозможности вращения углеродных атомов в цикле вокруг их валентных связей. Положение стоящих при этих атомах радикалов тем самым зафиксировано в пространстве. Заместители у различных углеродных атомов могут находиться либо с одной стороны цикла (цис-изомер), либо с разных сторон (транс-изомер).
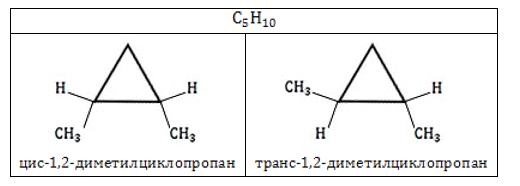
Номенклатура
Номенклатура циклоалканов основывается на наименованиях предельных углеводородов открытого строения – алканов. Приставка «цикло-» добавляется к названию алкана с , равным количеству звеньев в кольце циклоалкана.
Число радикалов одного состава указывается с помощью приставок «ди-», «три-», «тетра-». Старший радикал обозначается первым, а углеродные атомы нумеруют по наиболее короткому расстоянию между радикалами.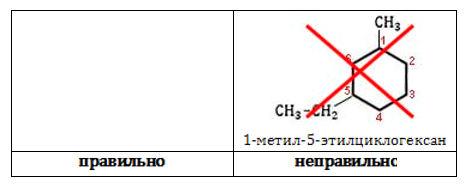
Применение
Наибольшее практическое значение имеют циклогексан, этилциклогексан. Циклогексан используется для получения циклогексанола, циклогексанона, адипиновой кислоты, капролактама, а также в качестве растворителя. Циклопропан используется в медицинской практике в качестве ингаляционного анестезирующего средства.
Список использованной литературы
1. Химия: Органическая химия: Учебное издание для 10 кл. сред. шк. – Москва, Просвещение, 1993
2. Глинка Н.Л. Общая химия. -25-е изд., испр. – Л.: Химия
3. Артеменко А.И. Органическая химия: учеб. для строит. спец. вузов. – М.: Высшая школа, 2000.
4. Березин Б.Д., Березин Д.Б. Курс современной органической химии. Учебное пособие для вузов. – М.: Высшая школа, 1999.
5. ХИМИЯ. Справочник школьника, – М., 1995.
6. ХИМИЯ. Энциклопедия для детей. АВАНТА, 2000.
7. Хомченко Г.П. Химия для поступающих в ВУЗы. – М., 1995 г.
8. «Органическая химия»., Просвещение, 1991
Получение циклоалканов
- Переработка нефти (получают циклогексан и его производные)
- Реакция отщепления.
При отщеплении от дигалогенпроизводных алканов двух атомов галогена получают трех- и четырехчленные циклоалканы:
Реакция пиролиза солей дикарбоновых кислот.
Методом Ружичка получают циклогексан и циклопентан. Метод основан на воздействии высоких температур без доступа воздуха на соли дикарбоновых кислот.
Реакция гидрирования ароматических углеводородов в присутствии катализатора каталитического.
При нагревании бензола или его гомологов и водорода в присутствии никелиевого катализатора получают циклогексан или его производные:
Строение циклоалканов
Сходство циклопарафинов с алканами проявляется в полном насыщении углеродного скелета молекулы водородом. Оно возникает благодаря тому, что каждый атом углерода формирует по четыре одинарных связи: либо и в соединениях с боковыми углеводородными цепочками. Это указывает на тип гибридизации углерода в циклоалканах: sp3.
В sp3-гибридизованном состоянии четыре равноценных валентности углеродного атома имеют тетраэдрическую направленность, а величина валентного угла составляет 109°28`109°28`. Но, в отличие от ациклических углеводородов, в молекулах циклоалканов может возникать напряжение, степень которого зависит от числа атомов, участвующих в образовании цикла.
Валентные углы углерода в циклоалканах подчинены геометрии цикла. Связи отклоняются от нормального направления, вследствие чего и возникает напряжение. Оно, в свою очередь, влияет на прочность молекулы.
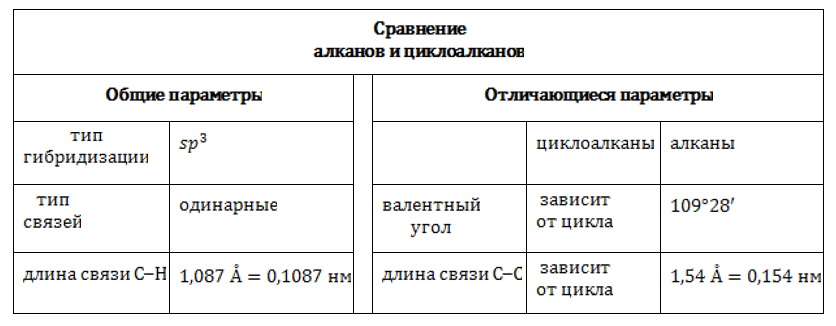
Изомерия
Для циклопарафинов, начиная с C 4 H 8 , характерны некоторые виды структурной изомерии, связанные:
a) с числом углеродных атомов в кольце – например, (этилциклопропан), (метилциклобутан);
b) с числом углеродных атомов в заместителях – (1-метил-2-пропилциклопентан), (1,2-диэтилциклопентан)
c) с положением заместителя в кольце – (1,1-диметилциклогексан), (1,2-диметилциклогексан)
Для циклоалканов характерна также межклассовая изомерия с алкенами.
При наличии двух заместителей в кольце у разных углеродных атомов возможна геометрическая цис-транс-изомерия, начиная с C 5 H 10 , и оптическая изомерия. Оптическая изомерия проявляется в том случае, если молекула не имеет плоскости симметрии.
Цис-транс-изомерия в циклических соединениях
При наличии двух заместителей в циклических соединениях также возможна цис-транс-изомерия. Метильные группы в приведенных примерах могут располагаться по одну сторону плоскости кольца (такой изомер называется цис-изомером) и по разные стороны (такой изомер называется транс-изомером).
Естественно, что при наложении друг на друга моделей цис- и транс- изомеров они не совмещаются. Взаимные изомеризации требуют разрыва цикла с последующим его замыканием или разрыва связи заместителя с углеродным атомом цикла и образованием новой связи с другой стороны цикла.
Следует отметить, что в циклических соединениях возможно возникновение не только цис-транс-, но и зеркальной изомерии. При наложении модели молекулы цис-изомера с одинаковыми заместителями и ее зеркального отражения они совмещаются, в то время как таковое невозможно для цис-изомера с различными заместителями. Для транс-изомеров совмещение модели молекулы и ее зеркального отражения невозможно как при одинаковых, так и различающихся заместителях.
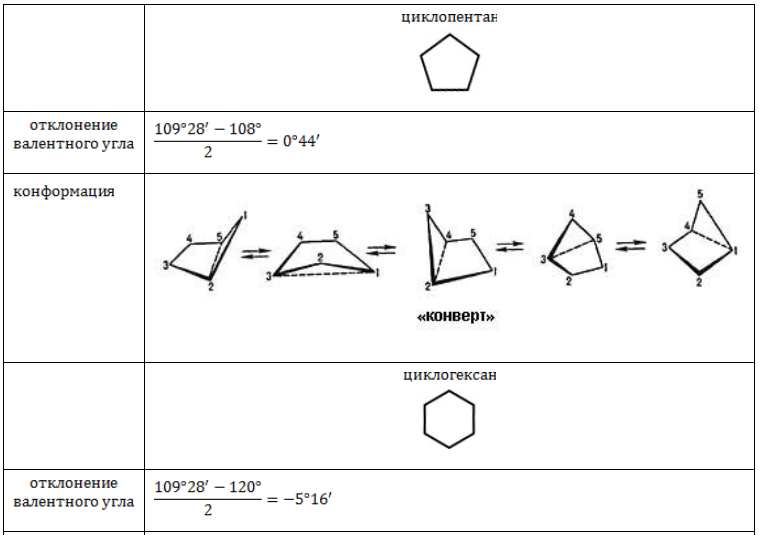
Циклобутан, циклопентан и их конформации
Циклические соединения – это такие органические соединения, в которых углеродные атомы составляют замкнутые цепи, т.е. циклы. Простейшими представителями таких соединений являются циклопарафины или циклоалканы.
Прочность связей в циклических соединениях зависит от числа атомов, участвующих в образовании цикла. Она определяется степенью его напряженности, обусловленной изменением валентных углов атомов цикла и отклонением этих атомов от нормального направления.
Для циклопропана межъядерные углы составляют 60º, как в равностороннем треугольнике, для циклобутана – 90º, как в квадрате, а в циклопентане – 108º, как в правильном пятиугольнике. Нормальный валентный угол для атома углерода – 109,5º. Поэтому при расположении в названных соединениях всех атомов углерода в одной плоскости уменьшение валентных углов составляет в циклопропане – 49,5º, в циклобутане – 19,5º, в циклопентане – 1,5º.
Чем больше отклонение валентного угла от нормального, тем более напряжены и, следовательно, непрочны циклы. Однако в отличие от циклопропана циклобутан и циклопентан имеют неплоские циклы. Один из атомов углерода непрерывно выходит из плоскости. Циклобутан существует в виде неплоских «сложенных» конформаций. Циклопентан характеризуется конформацией «конверт». Таким образом, обсуждаемые циклы находятся в колебательном движении, приводящем к уменьшению «заслоненности» атомов водорода у соседних углеродных атомов и снижению напряжения.
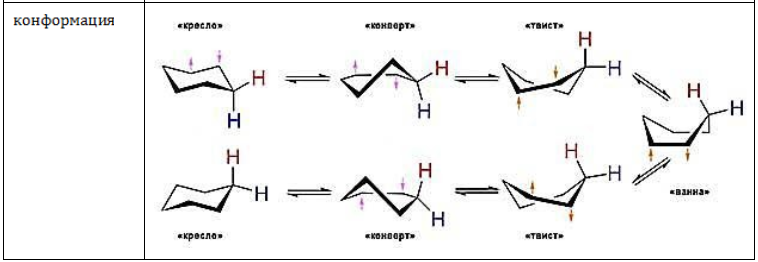
Циклогексан и его конформации
Для циклогексана, как правильного шестиугольника, межъядерные углы составляют 120º. Если бы молекула циклогексана имела плоское строение, то отклонение от нормального валентного угла атома углерода составляло: 109,5º-120º = 10,5º.
Однако циклогексан и большие циклы имеют неплоское строение. В рассматриваемой молекуле циклогексана сохраняются обычные валентные углы при условии его существования в двух конформациях «кресла» и «ванны». Конформация «кресла» менее напряжена, поэтому циклогексан существует преимущественно в виде конформеров I и III, причем цикл претерпевает непрерывную инверсию (inversio – с латинского переворачивание, перестановка) с промежуточным образованием конформера II:
ось симметрии II III I
Двенадцать связей C–H, которые имеются у циклогексана в конформации «кресла», делятся на два типа. Шесть связей направлены радиально от кольца к периферии молекулы и называются экваториальными связями (e – связи), остальные шесть связей направлены параллельно друг другу и оси симметрии и называются аксиальными (a – связи). Три аксиальные связи направлены в одну сторону от плоскости цикла, а три – в другую (имеется чередование: вверх-вниз).
Формула и строение циклоалканов
Углеродным атомам характерна sp3-гибридизация и формирование четырех сигма-связей (σ-связи) С-Н и С-С. От размеров цикла зависят свойства вещества. У первых двух представителей гомологического ряда валентный угол равен не 109˚35’, как в алканах, а меньше. Из-за возникающего напряжения в молекуле эти циклы имеют высокую реакционную способность.
«Банановые» σ-связи в циклопропане – особенность строения циклоалканов. Они расположены так, что соединяют ядра атомов углерода не прямой, а дугообразной линией. «Банановые» связи схожи с π-связями, т.к. легко рвутся. Они необходимы для уменьшения напряжения внутри цикла.
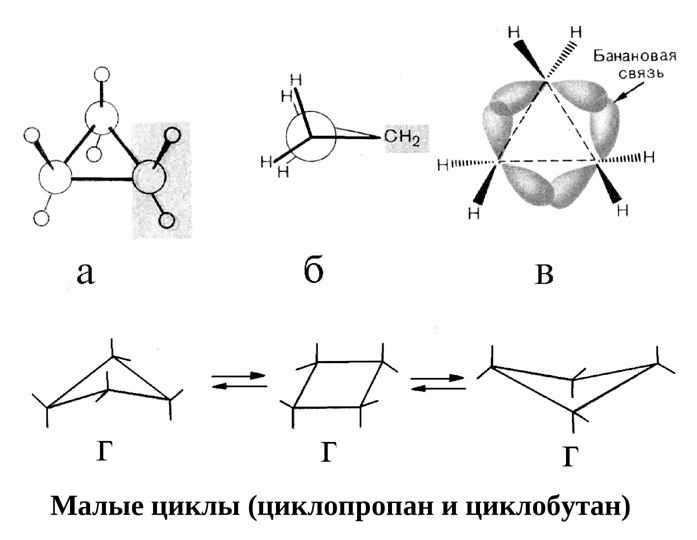 Рис. Малые циклопропаны. А, б, в – «банановые» связи циклоалканов; г – конформации циклоалканов. Источник
Рис. Малые циклопропаны. А, б, в – «банановые» связи циклоалканов; г – конформации циклоалканов. Источник
Другие нафтены имеют особенность – пространственное строение. В циклобутане есть перегиб между первым и третьим углеродным атомами. Циклопентан представлена в конформации «конверт», а циклогексан – в «кресло» и «ванна».
Общая формула циклоалканов: CnH2n, где n≥3.
Нахождение циклопарафинов в природе
Циклопарафины – это одни из наиболее распространенных углеводородов в природе. Они не только встречаются в нефти, природном газе, угле и других природных материалах, но также широко используются в различных отраслях промышленности. Например, циклопентан используется в качестве растворителя для клеев и лаков, а также в производстве полиуретановых пен. Циклогексан используется в качестве растворителя для красителей и лаков, а также в производстве нейлонов и других синтетических материалов. Циклогептан находит применение в производстве синтетических каучуков и пластиков. Кроме того, циклопарафины могут быть использованы в качестве топлива или вещества для охлаждения в ракетных двигателях и других космических технологиях. Таким образом, циклопарафины являются важными и полезными соединениями, играющими важную роль в промышленности и научных исследованиях. Наиболее распространенными циклопарафинами являются циклопентан, циклогексан и циклогептан.
Химические свойства циклоалканов
Свойства циклоалканов различны и меняются по мере изменения размеров молекулы. Малым циклам характерны реакции присоединения, а большим – замещения.
Реакции присоединения
Малые циклы хотя и проявляют насыщенность, но им не характерны свойства предельных углеводородов. Это связано с тем, что у первых двух простейших представителей циклоалканов валентные углы меньше. Для них свойственно напряжение внутри кольца и тяга к раскрытию при воздействии реагентов.
Гидрирование при воздействии катализатора и высоких температур
Галогенирование
Гидрогалогенирование при нагревании
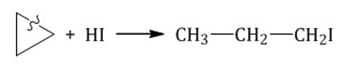
Реакции гидрогалогенирования гомологов циклоалканов осуществляется по правилу Марковникова.
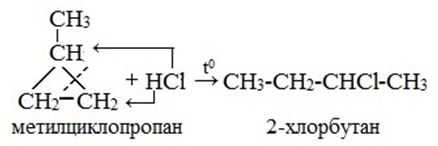
Реакции замещения
Циклы с шестью и более углеродными атомами наиболее устойчивы из-за отсутствия углового напряжения.
Галогенирование под действием света
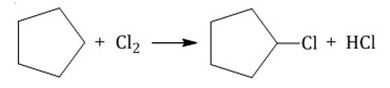
У гомологов циклоалканов галоген замещается у третичного атома углерода.
Химические свойства циклоалканов
Устойчивость, а, следовательно, и реакционная активность малых и обычных циклов сильно различаются.
Малые циклы, такие как циклопропан и циклобутан проявляют склонность к реакциям присоединения, тогда как для обычных циклов (циклопентан и циклогексан) более характерны реакции замещения.
Галогенирование:
Расщепление серной кислотой:
Взаимодействие с сильными карбоновыми кислотами:
Галогенирование при действии ультрафиолета:
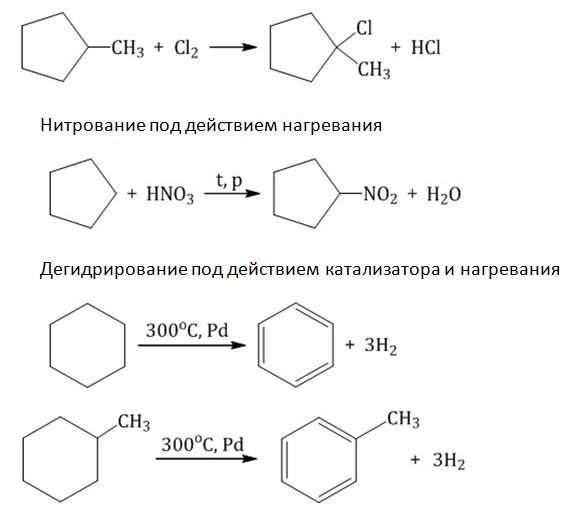
В присутствии катализатора ведет к образованию бензола:
4. Реакция окисления
Как малые, так и обычные циклы при окислении сильными окислителями (например, 50%-ной азотной кислоты, перманганат натрия, бихромат калия) раскрываются с образованием двухосновных карбоновых кислот:
Гомологический ряд и устойчивость циклоалканов
Для образования цикла необходимы как минимум три углеродных атома. Поэтому ряд начинается с соединения циклопропана
Важной особенностью ряда является внутренняя классификация соединений по типу циклов, от которого зависят их свойства

Малый цикл
Молекулы соединений малого цикла отличаются сильным угловым напряжением из-за большого отклонения тетраэдрического угла 109°28`109°28`. В трехчленной молекуле циклопропана, где валентные углы в трехчленном цикле должны составлять 60°60°, оно особенно велико:
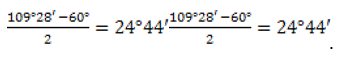
Это приводит к изгибанию связи, которая из-за характерной формы получила название «банановой». Перекрывание орбиталей в такой связи осуществляется не по прямой между центрами углеродных атомов, поэтому «банановая», или связь, слабее обычной связи.

Четырехчленная структура циклобутана позволяет ослабить напряжение:
Кроме того, один из четырех атомов в цикле на 25°25° отклоняется от плоскости, в результате чего молекула циклобутана колеблется между двумя равноправными конформациями, условно называемыми «бабочка»:
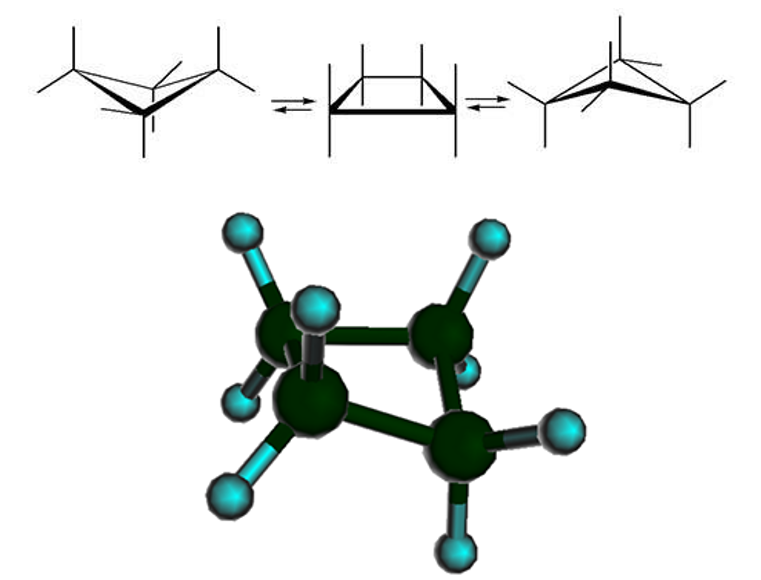
Средний цикл
Молекулы циклопентана и циклогексана гораздо устойчивее, чем малые циклы, благодаря незначительному отклонению валентного угла:
В циклогексане благодаря большому числу конформаций напряжение отсутствует.
Получение
1. Циклоалканы содержатся в значительных количествах в нефтях некоторых месторождений (отсюда произошло одно из их названий – нафтены ). При переработке нефти выделяют главным образом циклоалканы С 5 Н 10 – С 7 Н 14
2. Действие активных металлов на дигалогензамещенные алканы (реакция Вюрца) приводит к образованию различных циклоалканов:
(вместо металлического натрия используется также порошкообразный цинк).
Строение образующегося циклоалкана определяется структурой исходного дигалогеналкана. Этим путем можно получать циклоалканы заданного строения. Например, для синтеза 1,3-диметилциклопентана следует использовать 1,5-дигалоген – 2,4-диметилпентан:
Существуют и другие методы получения циклоалканов. Так, например, циклогексан и его алкильные производные получают гидрированием бензола и его гомологов, являющихся продуктами нефтепереработки.
*§ 11-1. Циклоалканы
Циклоалканы
Помимо линейных и разветвлённых цепей, атомы углерода могут образовывать циклы.
Интересно знать
Одним из первых идею о том, что атомы углерода могут образовывать циклы, высказал выдающийся немецкий химик Август Кекуле (1829–1896), разгадывая загадку строения молекулы бензола. Существует версия, что к этой идее учёного подтолкнул вид нескольких обезьян в зоопарке, схвативших друг друга за лапы и хвост. Другие историки считают, что Кекуле приснилась углеродная цепь как извивающаяся змея, которая ухватила себя за хвост, и так замерла… Это напоминает легенду о том, что Периодическую таблицу Менделеев также увидел во сне.
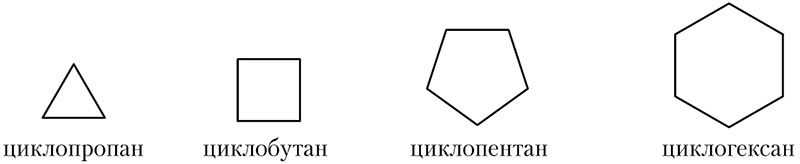
На схеме приведены формулы веществ, содержащих циклы из атомов углерода, связанных между собой одинарными ковалентными связями, эти вещества называются циклоалканами:
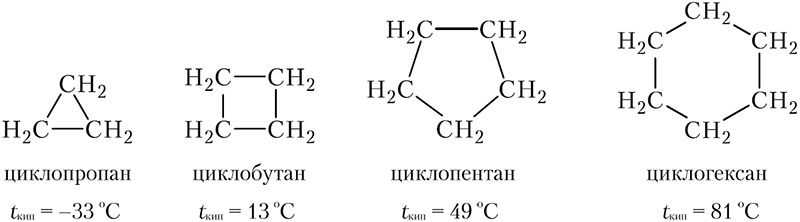
Скелетные формулы циклоалканов:
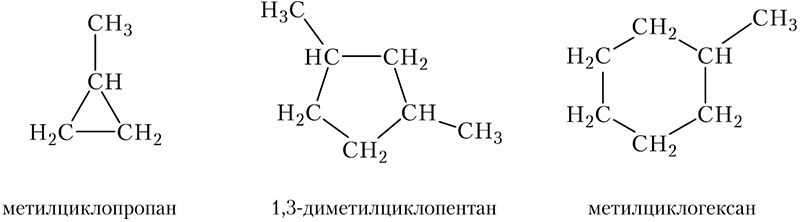
Молекулы циклоалканов могут содержать заместители, связанные с циклом:
Для замыкания открытой цепи атомов углерода в цикл необходимо отщепить от молекулы алкана два атома водорода:
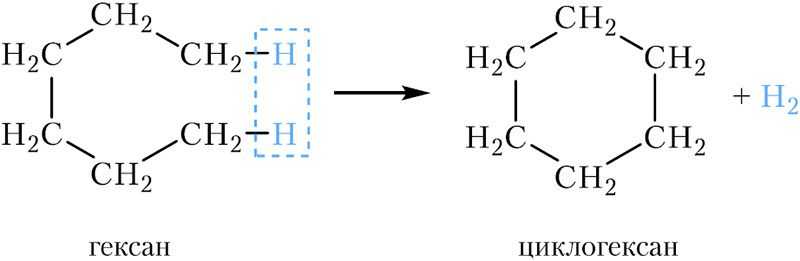
Вспомним общую формулу алканов: СnH2n+2. У циклоалканов на два атома водорода меньше, следовательно, их общая формула СnH2n+2.
Циклоалканы — органические соединения состава СnH2n, молекулы которых содержат цикл из атомов углерода, связанных между собой одинарными ковалентными связями.
Рассмотрим изомерию циклоалканов. Изомерные циклоалканы могут различаться количеством атомов углерода в цикле:

количеством заместителей в цикле и их строением:

положением заместителей в цикле:

Таким образом, у циклоалканов более широкие возможности изомерии, чем у алканов. Например, существует три изомерных алкана, содержащих пять атомов углерода в молекуле:
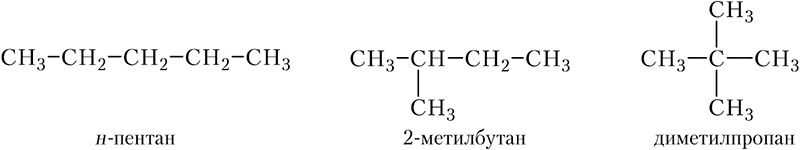
Определим число изомерных циклоалканов с тем же числом атомов углерода в молекуле, т. е. состава С5Н10. Из пяти атомов углерода можно составить пятичленный цикл:
В молекуле циклоалкана состава С5Н10 четыре атома углерода могут образовывать цикл, а один — входить в состав заместителя:
Существуют также изомерные циклоалканы состава С5Н10, молекулы которых включают цикл из трёх атомов углерода. В этом случае с циклом связаны либо две метильные группы, причём метильные группы могут находиться как у одного атома углерода, так и у соседних, либо одна этильная:
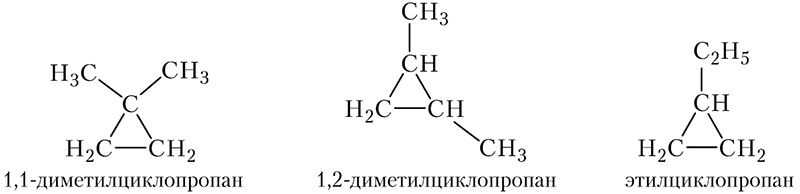
Таким образом, существуют 5 изомерных циклоалканов состава C5H12.
Рассмотрим номенклатуру циклоалканов. Основные принципы построения названий циклоалканов такие же, как и в случае алканов, только вместо наиболее длинной углеродной цепи в качестве главной цепи выбирают цикл. Атомы углерода в цикле нумеруют таким образом, чтобы заместители получили наименьшие номера. Принадлежность соединения к классу циклоалканов указывает приставка цикло- и суффикс -ан. Используя эти правила, назовём некоторые изомерные циклоалканы состава С8Н16:
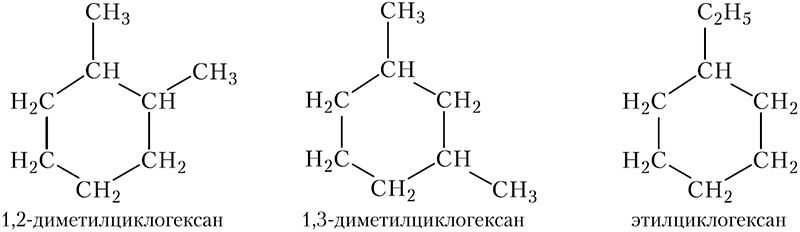
По своим физическим свойствам циклоалканы похожи на алканы. При комнатной температуре циклопропан и циклобутан — газы, циклоалканы от С5Н10 до С10Н20 — бесцветные жидкости со специфическим запахом, высшие циклоалканы являются твёрдыми веществами. Циклоалканы практически нерастворимы в воде.
Химические свойства циклоалканов с различным числом атомов углерода в цикле существенно различаются. Например, для циклопропана и циклобутана характерны реакции присоединения. Циклопентан и циклогексан, наоборот, по химическим свойствам близки к алканам: так же, как и алканы, они не реагируют с кислотами и щелочами, но для них характерны реакции замещения с галогенами. Рассмотрим химические свойства циклогексана.
1. Галогенирование. Как и алканы, на свету циклогексан вступает в реакцию замещения с хлором и бромом:
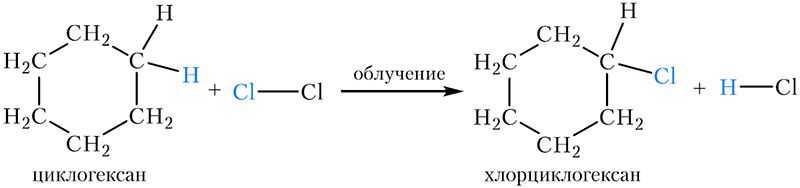
2. Дегидрирование (отщепление водорода). При пропускании паров циклогексана над нагретым никелевым, платиновым или палладиевым катализатором образуется бензол:
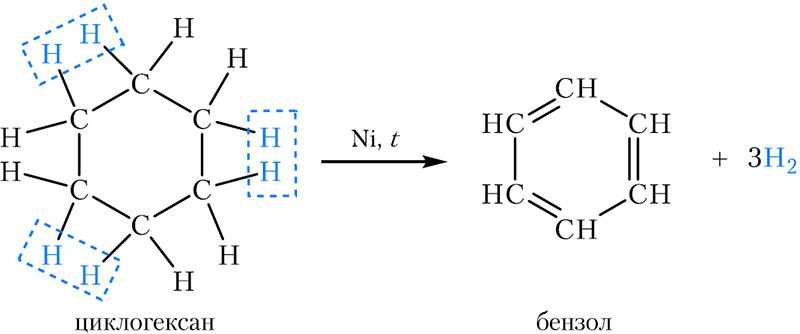
3. Окисление. Подобно алканам, циклогексан горит при поджигании:
C6H12 + 9O2 6CO2 + 6H2O
Циклоалканы встречаются в природе. Они входят в состав нефти, этим обусловлено ещё одно название данного класса углеводородов — нафтены. Из циклогексана получают капролактам — исходное вещество для синтеза капрона. Циклопропан применяется в медицине как обезболивающее средство.
Циклоалканы — органические соединения состава СnH2n, молекулы которых содержат цикл из атомов углерода, связанных между собой одинарными ковалентными связями.
Физические свойства циклоалканов подобные таковым для алканов.
Химические свойства циклопентана и циклогексана подобны свойствам алканов, например они вступают в реакции замещения с галогенами.
Циклоалканы встречаются в природе, они входят в состав нефти.

