Схема реактора алкилирования бензола высшими олефинами
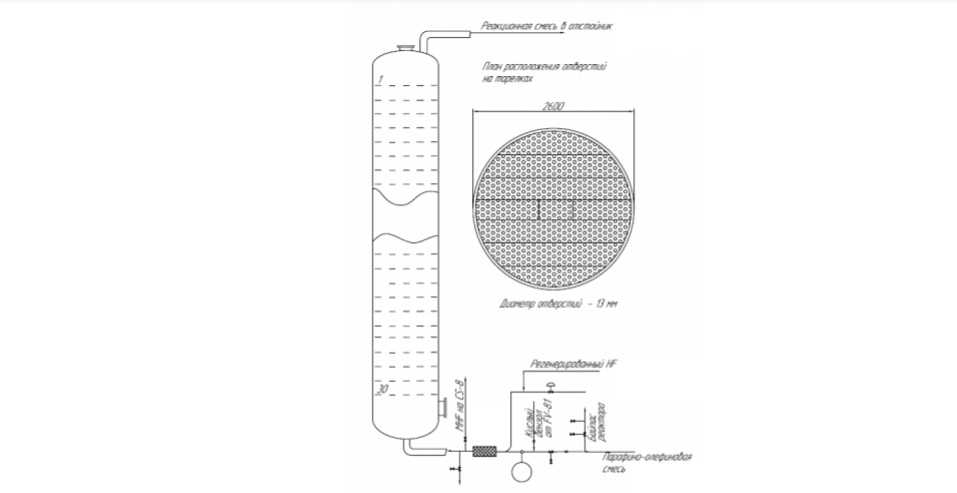
Реакционная смесь с верха реактора выводится в отстойник, в котором производится сепарация НF-кислоты от углеводородов. В процессе алкилирования бензола моноолефинами на цеолитных катализаторах возможно использование как секционированного реактора так и трубчатого реактора.
Реактор алкилирования бензола и изобутана олефинами на цеолитном катализаторе:
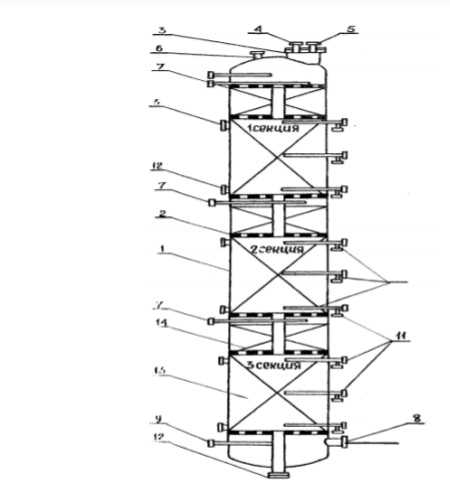
1 — корпус; 2 — перфорированная решетка; 3 — люк для загрузки катализатора; 4 -воздушник; 5 — штуцер для ввода инертного газа; 6 -штуцер для предохранительного клапана; 7 — штуцер входа газосырьевой смеси; 8 — штуцер выхода; 9 — муфта для манометра; 10 — штуцер с гильзой для термопары: 11 — штуцер для отбора проб; 12 — люк для выгрузки катализатора; 13 — катализатор; 14 — насадка
Секционирование реактора позволяет иметь высокое отношение бензол: олефины или изобутан: олефины в каждой секции при низком общем их соотношении в процессе, а также состав продуктов, близкий к получаемому на действующих промышленных установках.
В достоинства аппаратов такого типа входят: простота конструкции; непрерывная передача тепла от одного теплоносителя к другому; интенсивный теплообмен. Имеются также и недостатки: металлоемкость; температурные деформации; сложность разборки и чистки трубного пространства. Трубчатые реакторы позволяют эффективно регулировать температуру процесса, что существенно увеличивает селективность, продолжительность работы катализатора, а также выход целевых продуктов
Технология производства этилбензола
Производство этилбензола является самым крупнотоннажным коммерческим процессом по объему потребления и переработки бензола — почти 75 % получаемого в мире нефтехимического бензола приходится на производство этилбензола и изопропилбензола. Около 99% получаемого этилбензола используется в производстве стирола, оставшийся 1% этилбензола используется в качестве промежуточного продукта в химическом производстве. В настоящее время на многих нефтехимических предприятиях, в особенности в России и Китае, используется технология алкилирования бензола этиленом с использованием жидкофазных кислотных катализаторов (кислот Льюиса), в частности, широко применим хлорид алюминия. Одним из важнейших направлений интенсификации процесса алкилирования бензола этиленом является повышение эффективности совместной работы системы «реактор — смесительное оборудование» с целью уменьшения расхода коррозионноактивного катализаторного комплекса на основе хлорида алюминия при сохранении высокого выхода этилбензола. Определение оптимальных условий смешения реагентов перед каталитическим реактором направлено на увеличение скоростей химических реакций путем создания большей поверхности раздела фаз смешиваемых компонентов. В таком случае рассматриваемый классический процесс алкилирования бензола этиленом приближается по своей эффективности к технологии MonsantoLummus Crest, основанной на гомогенном алкилировании бензола этиленом в присутствии каталитического комплекса на основе хлористого алюминия, селективность которого по отношению к этилбензолу составляет около 99%.
Наиболее значительные результаты достигнуты в области использования твердых катализаторов, а также совершенствования аппаратурного оформления процессов с применением цеолитных катализаторов. В России же подобные процессы получения этилбензола на твердых катализаторах находятся в стадии разработки.
Производство этилбензола (ЭБ) является самым крупнотоннажным коммерческим процессом по объему потребления и переработки бензола — почти 75 % получаемого в мире нефтехимического бензола приходится на производство этилбензола и изопропилбензола. Рынок этилбензола в свою очередь тесно связан с производством стирола. Около 99 % получаемого этилбензола используется в производстве стирола, оставшийся 1% ЭБ используется в качестве промежуточного продукта в химическом производстве. Спрос на стирол на Ближнем Востоке приходится на регионы Арабского залива, Турции, Северо-Восточной Азии и Западной Европы. В России основными производителями ЭБ являются ОАО «Салаватнефтеоргсинтез», АО «Сибур-Химпром», ОАО Нижнекамскнефтехим и ОАО «Ангарский завод полимеров». Их суммарная мощность 849 000 тонн в год, что составляет 2,4 % от мирового объема.
В настоящее время разработкой, а также внедрением процессов производства этилбензола занимаются такие крупные компании как CDTECH, Mobil, PolimeriEuropa, UOP/Lummus, и др. Polimeri Europa разработала ряд катализаторов на основе β — цеолита под названием РВЕ-1 и РВЕ-2, а также собственную технологию, отличием которой является наличие секции для предварительной обработки, где свежий бензол подвергается отделению молекулярного кислорода и влаги. Неконденсируемые примеси в этиленовом сырье, а также легкие ароматические углеводороды, которые образуются в ходе реакции, удаляются в процессе. Запуск первой установки по такой технологии был осуществлен в 2005 г. Компании UOP/Lummus предложили использовать EBZ 500 катализатор в технологии «CDTECHEB» и «EBOne». Технология «CDTECHEB» совмещает газофазное и жидкофазное оформления реактора. Особенностью этого процесса является совмещение реактора с дистилляционной колонной. На сегодняшний день по данной технологии работает 6 установок получения этилбензола. Технология «EBOne» представляет собой процесс жидкофазного производства этилбензола. В настоящее время в мире функционирует около 26 установок, работающих по этой технологии. Компания Mobil Badger является мировым лидером по количеству проданных лицензий на получение этилбензола. В 1995 году ExxonMobil и Badger внедрили «EBmax» технологию, которая представляет из себя жидкофазный процесс с использованием уникальных катализаторов алкилирования МСМ-22 и трансалкилирования Trans-4. В настоящее время на долю технологий, разработанных компанией MobilBadger, приходится порядка 55% всего производимого этилбензола, более половины из которого получают по технологии «Ebmax».
Кислотные катализаторы алкилирования
Факт алкилирования бензола олефинами с ипользованием кислотного катализатора Фриделя — Крафтса — был опубликован в 1878 г. В качестве таких катализаторов применялись различные минеральные соли и кислоты Льюиса, такие как H2SO4, H3PO4, комплексы типа HF, BF3·H3PO4, 2BF3·H4P2O7, BF3·H2O, молибденовые и вольфрамовые гетерополикислоты. Для алкилирования бензола этиленом часто использовались комплексы AlCl3, в растворе бензола или алкилбензольной фракции (AlCl3 катализирует реакции трансалкилирования). Комплексы на основе катализаторов Фриделя-Крафтса из-за 31 технологических недостатков — токсичности, коррозии аппаратуры, что представляет опасность в обращении и при транспортировке, и большого количества сточных вод — уступают (в промышленных процессах) концентрированным кислотам, а в последние годы — твердым кислотным катализаторам. Процессы на основе хлорида алюминия имеют ряд и других существенных недостатков: быстрая дезактивация катализатора, необходимость осушки сырья, при промывке и нейтрализации алкилатов образуется хлористый водород и алюминий — хлоридные стоки. Кроме того, продукты реакции требуется отделять от кислотного катализатора, что является достаточно сложным с технической стороны и энергоемким процессом. Хлорид алюминия с исходным бензолом и продуктами алкилирования образует устойчивые комплексные соединения. В процессе алкилирования бензола непрерывно происходит распад одних комплексов и образование новых. Из хлорида алюминия готовится катализаторный комплекс (Густавсона), нагревая и пропуская этилхлорид через суспензию АlСl3 в смеси бензола и диэтилбензола. При использовании в качестве катализатора безводного хлорида алюминия активатором служит хлористый водород, поэтому при проведении процесса алкилирования в реакционную зону вводят алкил хлориды (например, хлористый этил), которые выделяют хлористый водород в результате взаимодействия с бензолом. В отдельных случаях к катализатору добавляется незначительное количество водяного пара или воды, что в свою очередь вызывает процесс гидролиза хлористого алюминия. В твердом виде хлорид алюминия практически не растворим в углеводородах и слабо катализирует реакционную массу. Однако по мере выделения HCl хлорид алюминия начинает превращаться в темную тяжелую маслянистую жидкость, ограниченно растворимую в бензоле, этилбензоле и их смеси. Этот комплекс обладает высокой каталитической активностью, и реакция постепенно начинает ускоряться.
Данный комплекс представляет из себя соединение АlСl3 и HCl с 1-6 молекулами ароматического углеводорода, одна из которых находится в виде положительно заряженного иона (σ-комплекс): Al2Cl6·C6H5R·HCl (где R=CnH2n+1). Данный активный катализаторный комплекс целесообразно готовить предварительно и затем подавать в реакционную массу во избежание медленного катализа твердым хлоридом алюминия. Кроме НСl его образованию также способствуют небольшое количество воды или соответствующего хлорпроизводного, роль которых заключается в генерации НСl. Целесообразней использовать HCl или RCl, так как вода разлагает катализатор и дезактивирует его. Другими катализаторными ядами являются многие соединения серы и аммиак, в меньшей степени — диены и ацетилен. Следует отметить, что металлоорганический катализаторный комплекс является сильно коррозионноспособным, крайне неустойчивым к воздействию воды, с которой при контакте образует гидроокись алюминия:
AlCl3 + 3H2O = Al(OH)3↓ + 3HCl.
Образовавшаяся гидроокись алюминия является малорастворимой, в результате чего забивает аппараты и трубопроводы на производстве, поэтому содержание влаги в бензоле, подаваемом на алкилирование должно быть не более 0,006 %. Перспективным решением существующих технологических проблем и недостатков в процессах алкилирования ароматических углеводородов является переход на гетерогенные цеолитсодержащие катализаторы.
Схема реактора алкилирования бензола высшими олефинами
Реакционная смесь с верха реактора выводится в отстойник, в котором производится сепарация НF-кислоты от углеводородов. В процессе алкилирования бензола моноолефинами на цеолитных катализаторах возможно использование как секционированного реактора так и трубчатого реактора.
Реактор алкилирования бензола и изобутана олефинами на цеолитном катализаторе:
1 — корпус; 2 — перфорированная решетка; 3 — люк для загрузки катализатора; 4 -воздушник; 5 — штуцер для ввода инертного газа; 6 -штуцер для предохранительного клапана; 7 — штуцер входа газосырьевой смеси; 8 — штуцер выхода; 9 — муфта для манометра; 10 — штуцер с гильзой для термопары: 11 — штуцер для отбора проб; 12 — люк для выгрузки катализатора; 13 — катализатор; 14 — насадка
Секционирование реактора позволяет иметь высокое отношение бензол: олефины или изобутан: олефины в каждой секции при низком общем их соотношении в процессе, а также состав продуктов, близкий к получаемому на действующих промышленных установках.
В достоинства аппаратов такого типа входят: простота конструкции; непрерывная передача тепла от одного теплоносителя к другому; интенсивный теплообмен. Имеются также и недостатки: металлоемкость; температурные деформации; сложность разборки и чистки трубного пространства. Трубчатые реакторы позволяют эффективно регулировать температуру процесса, что существенно увеличивает селективность, продолжительность работы катализатора, а также выход целевых продуктов
Нецеолитные катализаторы
Данный катализатор использовался американской фирмой «UOP» для получения этилбензола и для производства кумола (реакция алкилирования бензола с пропан-пропиленовой фракцией при температуре около 200 °С, давлении 3-4 МПа и высоком мольном отношении бензол: олефины — около (6 — 10) : 1. Срок службы катализатора при условии добавки промотора (воды) составляет от нескольких месяцев до трех лет. Особенностью работы катализатора является отсутствие реакций трансалкилирования образующихся побочных продуктов — полиалкилбензолов. Такая особенность требует строительства отдельного блока трансалкилирования с использованием хлоридов алюминия. Также фирмой «UOP» был использован более эффективный катализатор фторид бора, нанесенный на оксид алюминия. Ограничение по содержанию примесей диенов и воды в сырье, несмотря на необходимость подпитки BF3, обусловливает как стабильную работу катализатора, так и минимальную коррозию оборудования. Процесс осуществляется при температуре 125 — 150 °С, давлении 0,6 МПа и мольном отношении бензол: этилен, равном (5 — 6) : 1.
Список литературы
- Топчиев А.В. Избранные труды. Кн. 2. Алкилирование. М.: Наука, 1965.
- Олбрайт Л.Ф., Голдсби А.Р. Алкилирование. Исследование и промышленное оформление процесса. Пер. с англ. Под ред. Липовича В.Г. М.: Химия, 1982.
- Орехов В.С., Дьячкова Т.П., Субочева М.Ю., Колмакова М.А. Технология органических полупродуктов. Ч. 1. Тамбов: ТГТУ, 2007.
- Бесков В.С. Общая химическая технология. М.: Академкнига, 2005.
- Новые процессы органического синтеза/Под. Ред. Черных С.П. М.: Химия, 1989.
- Байрамов М.Р., Гаджиев М.М., Зейналов Н.Ю., Алиева Ф.Д., Гусейнова Р.А. Разработка технологии процесса алкилирования бензола олигомерами бутенов-1//Химия и химическая технология. 2006. Т. 49. Вып. 7.
- Серафимов Л.А., Тимофеев В.С., Тимошенко А.В. Принципы технологии основного органического и нефтехимического синтеза. М.: «Высшая школа», 2010.
- Гартман Т.Н., Советин Ф.С. Применение пакетов программ CHEMCAD для моделирования процессов многокомпонентной ректификации в тарельчатых колоннах при получении синтетического жидкого топлива//Химическая техника. 2010.№2.
- Советин Ф.С., Гартман Т.Н., Сафонова В.Д., Шумакова О.П., Тамбовцев И.И. Применение комплекса программ CHEMCAD для разработки компьютерной модели технологической схемы хлорирования бензола по Беркману//Химическая техника. 2014. №10.
- Гартман Т.Н., Клушин Д.В. Основы компьютерного моделирования химико-технологических процессов. М: Академкнига, 2008.
- Гартман Т.Н., Советин Ф.С. Аналитический обзор современных пакетов моделирующих программ для компьютерного моделирования химико-технологических систем//Успехи в химии и химической технологии. 2012. Т. 26. №11 (140).
- Ивашкина Е.Н., Хлебникова Е.С., Беккер А.В., Белинская Н.С., Ткачев В.В. Исследование процесса смешения реагентов в технологии алкилирования бензола этиленом с использованием методов вычислительной гидродинамики//Химическая промышленность сегодня. 2014. №8.
- Боровинская Е.С., Решетиловский В.П., Холоднов В.А. Интервальное оценивание параметров математического описания химико-технологических процессов на основе вычислительного эксперимента//Известия ОрелГТУ. Фундаментальные и прикладные проблемы техники и технологии: информационные системы и технологии. 2009. №2 (52)/563.
- Гартман Т.Н. Анализ и синтез непрерывной ректификации на основе автоматизированного накопления и классификации информации. Дис … д-ра техн. наук. М.: 2000.
- Советин Ф.С., Гартман Т.Н. Логико-вычислительные процедуры разработки блочных компьютерных моделей реакторных и ректификационных процессов//Изв. ТулГУ. Технические науки. 2011. Вып. 5. Ч. 3.
- Советин Ф.С. Разработка и применение методического обеспечения блочного компьютерного моделирования энергоресурсоемких химико-технологических систем c применением инструментальных комплексов программ. Дис. … канд. техн. наук. М.: РХТУ им. Д. И. Менделеева. 2011.
Катализаторы с микро-мезопористой структурой
Образование транспортных пор в цеолитном катализаторе позволяет повысить эффективность катализатора. Рассматриваемый на основе микро-мезопористого морденита катализатор алкилирования бензола додеценом-1 обеспечивает полную конверсию додецена-1 и селективность по линейным изомерам и по 2-фенилдодекану во фракции фенилдодеканов 92 % и 72 %, соответственно. Максимальный выход целевого продукта и стабильная работа катализатора обеспечиваются при мольном соотношении бензол: додецен-1 = (8 : 1), давлении 3 МПа, температуре 100 °C . Таким образом, применение твердофазных катализаторов в технологии алкилирования бензола этиленом имеет существенный ряд преимуществ по сравнению с процессом алкилирования на алюмохлористом катализаторе, а именно высокая селективность, высокий срок службы катализатора, отсутствие вредных отходов, изготовление оборудования из углеродистой стали. Применение на большинстве действующих установок жидких кислотных катализаторов обусловливает необходимость постоянного контроля качества катализаторного комплекса, который теряет свою активность в результате «осмоления» тяжелыми ароматическими соединениями. При достаточно активном катализаторном комплексе вокруг активных центров катализатора концентрируются молекулы полиалкилбензолов, что приводит к резкому снижению активности катализатора. При этом перевод действующих установок жидкофазного кислотного алкилирования на современные твердые катализаторы зачастую оказывается экономически нецелесообразным из-за значительных материальных затрат на реконструкцию производства. Поэтому в настоящее время перед нефтеперерабатывающими и нефтехимическими заводами, использующими жидкофазные катализаторы, остро стоит проблема повышения эффективности производства алкилатов с учетом изменения активности катализатора.
Катализаторы с микро-мезопористой структурой
Образование транспортных пор в цеолитном катализаторе позволяет повысить эффективность катализатора. Рассматриваемый на основе микро-мезопористого морденита катализатор алкилирования бензола додеценом-1 обеспечивает полную конверсию додецена-1 и селективность по линейным изомерам и по 2-фенилдодекану во фракции фенилдодеканов 92 % и 72 %, соответственно. Максимальный выход целевого продукта и стабильная работа катализатора обеспечиваются при мольном соотношении бензол: додецен-1 = (8 : 1), давлении 3 МПа, температуре 100 °C . Таким образом, применение твердофазных катализаторов в технологии алкилирования бензола этиленом имеет существенный ряд преимуществ по сравнению с процессом алкилирования на алюмохлористом катализаторе, а именно высокая селективность, высокий срок службы катализатора, отстуствие вредных отходов, изготовление оборудования из углеродистой стали. Применение на большинстве действующих установок жидких кислотных катализаторов обусловливает необходимость постоянного контроля качества катализаторного комплекса, который теряет свою активность в результате «осмоления» тяжелыми ароматическими соединениями. При достаточно активном катализаторном комплексе вокруг активных центров катализатора концентрируются молекулы полиалкилбензолов, что приводит к резкому снижению активности катализатора. При этом перевод действующих установок жидкофазного кислотного алкилирования на современные твердые катализаторы зачастую оказывается экономически нецелесообразным из-за значительных материальных затрат на реконструкцию производства. Поэтому в настоящее время перед нефтеперерабатывающими и нефтехимическими заводами, использующими жидкофазные катализаторы, остро стоит проблема повышения эффективности производства алкилатов с учетом изменения активности катализатора.
Источник
Химические свойства алканов
Алканами (парафинами) называют нециклические углеводороды, в молекулах которых все атомы углерода соединены только одинарными связями. Другими словами в молекулах алканов отсутствуют кратные — двойные или тройные связи. Фактически алканы являются углеводородами, содержащими максимально возможное количество атомов водорода, в связи с чем их называют предельным (насыщенными).
Ввиду насыщенности, алканы не могут вступать в реакции присоединения.
Поскольку атомы углерода и водорода имеют довольно близкие электроотрицательности, это приводит к тому, что связи С-Н в их молекулах крайне малополярны. В связи с этим для алканов более характерны реакции протекающие по механизму радикального замещения, обозначаемого символом SR.
1. Реакции замещения
В реакциях данного типа происходит разрыв связей углерод-водород
RH + XY → RX + HY
или
Галогенирование
Алканы реагируют с галогенами (хлором и бромом) под действием ультрафиолетового света или при сильном нагревании. При этом образуется смесь галогенпроизводных с различной степенью замещения атомов водорода — моно-, ди- три- и т.д. галогенозамещенных алканов.
На примере метана это выглядит следующим образом:
Меняя соотношение галоген/метан в реакционной смеси можно добиться того, что в составе продуктов будет преобладать какое-либо конкретное галогенпроизводное метана.
Механизм реакции
Разберем механизм реакции свободнорадикального замещения на примере взаимодействия метана и хлора. Он состоит из трех стадий:
- инициирование (или зарождение цепи) — процесс образования свободных радикалов под действии энергии извне – облучения УФ-светом или нагревания. На этой стадии молекула хлора претерпевает гомолитический разрыв связи Cl-Cl c образованием свободных радикалов:
Свободными радикалами, как можно видеть из рисунка выше, называют атомы или группы атомов с одним или несколькими неспаренными электронами (Сl•, •Н, •СН3,•СН2• и т.д.);
2. Развитие цепи
Эта стадия заключается во взаимодействии активных свободных радикалов с неактивными молекулами. При этом образуются новые радикалы. В частности, при действии радикалов хлора на молекулы алкана, образуется алкильный радикал и хлороводород. В свою очередь, алкильный радикал, сталкиваясь с молекулами хлора, образует хлорпроизводное и новый радикал хлора:
3) Обрыв (гибель) цепи:
Происходит в результате рекомбинации двух радикалов друг с другом в неактивные молекулы:
2. Реакции окисления
В обычных условиях алканы инертны по отношению к таким сильным окислителям, как концентрированная серная и азотная кислоты, перманганат и дихромат калия (КMnО4, К2Cr2О7).
Горение в кислороде
А) полное сгорание при избытке кислорода. Приводит к образованию углекислого газа и воды:
CH4 + 2O2 = CO2 + 2H2O
Б) неполное сгорание при недостатке кислорода:
2CH4 + 3O2 = 2CO + 4H2O
CH4 + O2 = C + 2H2O
Каталитическое окисление кислородом
В результате нагревания алканов с кислородом (~200 оС) в присутствии катализаторов, из них может быть получено большое разнообразие органических продуктов: альдегиды, кетоны, спирты, карбоновые кислоты.
Например, метан, в зависимости природы катализатора, может быть окислен в метиловый спирт, формальдегид или муравьиную кислоту:
3. Термические превращения алканов
Крекинг
Крекинг (от англ. to crack — рвать) — это химический процесс протекающий при высокой температуре, в результате которого происходит разрыв углеродного скелета молекул алканов с образованием молекул алкенов и алканов с обладающих меньшими молекулярными массами по сравнению с исходными алканами. Например:
CH3-CH2-CH2-CH2-CH2-CH2-CH3 → CH3-CH2-CH2-CH3 + CH3-CH=CH2
Крекинг бывает термический и каталитический. Для осуществления каталитического крекинга, благодаря использованию катализаторов, используют заметно меньшие температуры по сравнению с термическим крекингом.
Дегидрирование
Отщепление водорода происходит в результате разрыва связей С—Н; осуществляется в присутствии катализаторов при повышенных температурах. При дегидрировании метана образуется ацетилен:
2CH4 → C2H2 + 3H2
Нагревание метана до 1200 °С приводит к его разложению на простые вещества:
СН4 → С + 2Н2
При дегидрировании остальных алканов образуются алкены:
C2H6 → C2H4 + H2
При дегидрировании н-бутана образуются бутен-1 и бутен-2 (последний в виде цис- и транс-изомеров):
Способы получения этилбензола:
1. Алкилирование бензола:
а) алкилирование бензола этиленом на протонных кислотах (HF > H2SO4 (ж.ф. 10-400С, 0,1-1,0 МПа > H3PO4 г.ф. 200-4000С, 2-6 МПа);
б) алкилирование бензола этиленом на апротонных кислотах; жидкофазное, kt – AlCl3 – стандартное (20-40% AlCl3) и гомогенное (2 г kt на 1 кг алкилата);
в) алкилирование бензола этиленом на гетерогенных катализаторах – алюмосиликатах и цеолитах (парофазный процесс, 210-2500С, 1,4-2,8 МПа; соотношение бензол:этилен 7:1
г) алкилирование бензола этилгалогенидами на AlCl3;
2. выделение ректификацией из фракции C8 ароматических углеводородов – продуктов каталитического риформинга;
3. выделение из смолы пиролиза;
4. окислительное метилирование толуола (700-7500С, радикально-цепной механизм, без катализатора)
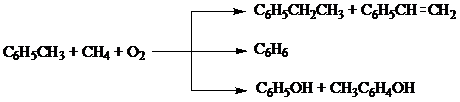
Основное количество этилбензола получают алкилированием бензола этиленом в присутствии AlCl3.
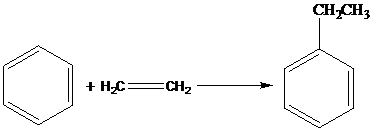
1. на AlCl3 протекают реакции последовательного алкилирования, а т.к. алкилирование проводится под термодинамическим контролем, то среди диэтилбензолов будут преобладать мета- и пара-изомеры, а среди триэтилбензолов – 1,3,5-триэтилбензол.
2. деструкция этильной группы с образованием толуола;
3. олигомеризация этилена
4. смолообразование за счет конденсации ароматических соединений (диарилалканы).
Механизм – карбкатионный: протон уже имеется в виде σ-комплекса. Он передается молекуле олефина, образовавшийся карбокатион атакует ароматическое соединение, причем вся реакция протекает в слое каталитического комплекса, который обменивается своими лигандами с углеводородным слоем. Далее карбокатион атакует ароматическое ядро, образуются последовательно π-комплекс и карбокатион с последующей быстрой стадией отщепления протона.
Оптимальные условия: температура – 100-1100С (при этой температуре переалкилирование уже протекает достаточно быстро, но полициклических веществ, дезактивирующих катализатор еще мало); давление 0,1-0,2 МПа; соотношение бензол : этилен = (2-3) : 1моль/моль.
Технологические особенности процесса:
1. необходимость использовать избыток бензола по отношению к олефину – рецикл бензола;
2. реакция экзотермичная – необходимо предусмотреть съем тепла;
3. катализ осуществляется катализаторным комплексом на основе AlCl3 — его готовят отдельно;
4. реакция идет в слое катализаторного комплекса – необходимо активное перемешивание;
5. необходимость осушки бензола и, при необходимости, олефиновой фракции, т.к. наличие влаги приводит к дезактивации катализатора – осушка бензола, возможность отгонять непрореагировавший бензол с водой и возвращать его в рецикл;
6. на AlCl3 протекает обратимая реакции переалкилирования;
7. необходимость разлагать катализаторный комплекс – промывки, сточные воды;
8. абгазы содержат HCl – очистка абгазов.
Стадии, из которых состоит процесс:
1. гетероазеотропная осушка бензола;
2. блок приготовления катализатора;
3. реакторный узел;
4. очистка отходящих газов от HCl;
5. отделение реакционной массы от катализаторного комплекса;
6. разложение катализаторного комплекса и очистка продуктов алкилирования от HCl;
Методы отделения и выделения следов элементов Немногие из применяемых в колориметрии реактивов обладают достаточной избирательностью для определения элемента непосредственно в присутствии сопутствующих элементов, когда соотношения межд .
Водород (Hydrogenium), Н Водород — химический элемент, первый по порядковому номеру в периодической системе Менделеева; атомная масса 1,00797. При обычных условиях В. — газ; не имеет цвета, запаха и вкуса. Историческая .
Источник
Реферат патента 2011 года СПОСОБ АЛКИЛИРОВАНИЯ БЕНЗОЛА ЭТИЛЕНОМ И КАТАЛИЗАТОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ
Изобретение относится к катализатору алкилирования бензола этиленом на основе цеолита ZSM-5, а также способу алкилирования бензола этиленом, использующему этот катализатор, при этом катализатор характеризуется тем, что является экструдированным (черенковым), состоящим из 55-90 мас.% цеолита типа HCaZSM-5 с мольным отношением оксид кремния : оксид алюминия 60-220 и 10-45 мас.% оксида алюминия (связующего) и имеющим химический состав, мас.%: оксид алюминия 10,3-47,1, оксид кальция 0,2-1,0, оксид натрия 0,01-0,1, оксид кремния остальное. Применение предлагаемого изобретения позволяет повысить выход этилбензола и селективность процесса алкилирования. 2 н.п. ф-лы, 2 табл.
Кислотные катализаторы алкилирования
Факт алкилирования бензола олефинами с использованием кислотного катализатора Фриделя — Крафтса — был опубликован в 1878 г. В качестве таких катализаторов применялись различные минеральные соли и кислоты Льюиса, такие как H2SO4, H3PO4, комплексы типа HF, BF3·H3PO4, 2BF3·H4P2O7, BF3·H2O, молибденовые и вольфрамовые гетерополикислоты. Для алкилирования бензола этиленом часто использовались комплексы AlCl3, в растворе бензола или алкилбензольной фракции (AlCl3 катализирует реакции трансалкилирования). Комплексы на основе катализаторов Фриделя-Крафтса из-за 31 технологических недостатков — токсичности, коррозии аппаратуры, что представляет опасность в обращении и при транспортировке, и большого количества сточных вод — уступают (в промышленных процессах) концентрированным кислотам, а в последние годы — твердым кислотным катализаторам. Процессы на основе хлорида алюминия имеют ряд и других существенных недостатков: быстрая дезактивация катализатора, необходимость осушки сырья, при промывке и нейтрализации алкилатов образуется хлористый водород и алюминий — хлоридные стоки. Кроме того, продукты реакции требуется отделять от кислотного катализатора, что является достаточно сложным с технической стороны и энергоемким процессом. Хлорид алюминия с исходным бензолом и продуктами алкилирования образует устойчивые комплексные соединения. В процессе алкилирования бензола непрерывно происходит распад одних комплексов и образование новых. Из хлорида алюминия готовится катализаторный комплекс (Густавсона), нагревая и пропуская этилхлорид через суспензию АlСl3 в смеси бензола и диэтилбензола. При использовании в качестве катализатора безводного хлорида алюминия активатором служит хлористый водород, поэтому при проведении процесса алкилирования в реакционную зону вводят алкил хлориды (например, хлористый этил), которые выделяют хлористый водород в результате взаимодействия с бензолом. В отдельных случаях к катализатору добавляется незначительное количество водяного пара или воды, что в свою очередь вызывает процесс гидролиза хлористого алюминия. В твердом виде хлорид алюминия практически не растворим в углеводородах и слабо катализирует реакционную массу. Однако по мере выделения HCl хлорид алюминия начинает превращаться в темную тяжелую маслянистую жидкость, ограниченно растворимую в бензоле, этилбензоле и их смеси. Этот комплекс обладает высокой каталитической активностью, и реакция постепенно начинает ускоряться.
Данный комплекс представляет из себя соединение АlСl3 и HCl с 1-6 молекулами ароматического углеводорода, одна из которых находится в виде положительно заряженного иона (σ-комплекс): Al2Cl6·C6H5R·HCl (где R=CnH2n+1). Данный активный катализаторный комплекс целесообразно готовить предварительно и затем подавать в реакционную массу во избежание медленного катализа твердым хлоридом алюминия. Кроме НСl его образованию также способствуют небольшое количество воды или соответствующего хлорпроизводного, роль которых заключается в генерации НСl. Целесообразней использовать HCl или RCl, так как вода разлагает катализатор и дезактивирует его. Другими катализаторными ядами являются многие соединения серы и аммиак, в меньшей степени — диены и ацетилен. Следует отметить, что металлоорганический катализаторный комплекс является сильно коррозионноспособным, крайне неустойчивым к воздействию воды, с которой при контакте образует гидроокись алюминия:
AlCl3 + 3H2O = Al(OH)3↓ + 3HCl.
Образовавшаяся гидроокись алюминия является малорастворимой, в результате чего забивает аппараты и трубопроводы на производстве, поэтому содержание влаги в бензоле, подаваемом на алкилирование должно быть не более 0,006 %. Перспективным решением существующих технологических проблем и недостатков в процессах алкилирования ароматических углеводородов является переход на гетерогенные цеолитсодержащие катализаторы.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
Нецеолитные катализаторы
Данный катализатор использовался американской фирмой «UOP» для получения этилбензола и для производства кумола (реакция алкилирования бензола с пропан-пропиленовой фракцией при температуре около 200 °С, давлении 3-4 МПа и высоком мольном отношении бензол: олефины — около (6 — 10) : 1. Срок службы катализатора при условии добавки промотора (воды) составляет от нескольких месяцев до трех лет. Особенностью работы катализатора является отсутствие реакций трансалкилирования образующихся побочных продуктов — полиалкилбензолов. Такая особенность требует строительства отдельного блока трансалкилирования с использованием хлоридов алюминия. Также фирмой «UOP» был использован более эффективный катализатор фторид бора, нанесенный на оксид алюминия. Ограничение по содержанию примесей диенов и воды в сырье, несмотря на необходимость подпитки BF3, обусловливает как стабильную работу катализатора, так и минимальную коррозию оборудования. Процесс осуществляется при температуре 125 — 150 °С, давлении 0,6 МПа и мольном отношении бензол: этилен, равном (5 — 6) : 1.



























