Периодический закон в современной формулировке. Периодическая система. Физический смысл периодического закона. Структура периодической системы. Изменение свойств атомов химических элементов главных подгрупп. План характеристики химического элемента.
|
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядра (=атомного номера элемента) |
||||||||||||||||||||||||||||||||
|
Периодическая таблица: это графическое изображение периодического закона. |
||||||||||||||||||||||||||||||||
|
Периодическое изменение свойств химических элементов и их соединений при увеличении заряда ядра атома объясняется тем, что периодически повторяется строение внешнего электронного слоя в атомах элементов. |
||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||
|
Общая характеристика квантовых чисел
Главное квантовое число n характеризует энергию электрона в атоме и размер электронной орбитали. Оно соответствует также номеру электронного слоя, на котором находится электрон. Совокупность электронов в атоме с одинаковым значением главного квантового числа n называют электронным слоем (энергетическим уровнем). n – принимает значения 1, 2, 3, …, ∞ . Энергетические уровни обозначают прописными латинскими буквами:
| Значение n | 1 | 2 | 3 | 4 | 5 | 6 |
| Обозначение слоя | K | L | M | N | O | P |
Различия в энергиях электронов, принадлежащих к различным подуровням данного энергетического уровня, отражает побочное (орбитальное) квантовое число l. Электроны в атоме с одинаковыми значениями n и l составляют энергетический подуровень (электронную оболочку). Максимальное число электронов в оболочке Nl:
Nl = 2(2l + 1). (1)
Побочное квантовое число принимает целые значения 0, 1, … (n – 1). Обычно l обозначается не цифрами, а буквами:
| Значение l | 1 | 2 | 3 | 4 | |
| Обозначение орбитали | s | p | d | f | g |
Орбиталь – пространство вокруг ядра, в котором наиболее вероятно нахождение электрона.
Побочное (орбитальное) квантовое число l характеризует различное энергетическое состояние электронов на данном уровне, форму орбитали, орбитальный момент импульса электрона.
Таким образом, электрон, обладая свойствами частицы и волны, движется вокруг ядра, образуя электронное облако, форма которого зависит от значения l. Так, если l = 0, (s-орбиталь), то электронное облако имеет сферическую симметрию. При l = 1 (p-орбиталь) электронное облако имеет форму гантели. d-орбитали имеют различную форму: dz2 — гантель, расположенная по оси Z с тором в плоскости X – Y, dx2 — y2 — две гантели, расположенные по осям X и Y; dxy, dxz, dyz, — две гантели, расположенные под 45oк соответствующим осям.
Формы электронных облаков для различных состояний электронов в атомах
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве, а также определяет величину проекции орбитального момента импульса на ось Z. ml принимает значения от +l до — l, включая 0. Общее число значений ml равно числу орбиталей в данной электронной оболочке.
Магнитное спиновое квантовое число ms характеризует проекцию собственного момента импульса электрона на ось Z и принимает значения +1/2 и –1/2 в единицах h/2p (h – постоянная Планка).
Группы
Вертикальные столбики элементов в периодической таблице — группы состоят из подгрупп: главной и побочной, они иногда обозначаются буквами А и Б соответственно.
В состав главных подгрупп входят s- и р-элементы, а в состав побочных — d- и f-элементы больших периодов.
Главная подгруппа — это совокупность элементов, которая размещается в периодической таблице вертикально и имеет одинаковую конфигурацию внешнего электронного слоя в атомах.
Как следует из приведенного определения, положения элемента в главной подгруппе определяется общим количеством электронов (s- и р-) внешнего энергетического уровня, равным номеру группы. Например, сера (S — 3s2 3p4 ), в атоме которого на внешнем уровне содержится шесть электронов, относится к главной подгруппе шестой группы, аргон (Ar — 3s2 3p6 ) — к главной подгруппе восьмой группы, а стронций (Sr — 5s2 ) — к ІІА-подгруппе.
Элементы одной подгруппы характеризуются сходством химических свойств. В качестве примера рассмотрим элементы ІА и VІІА подгрупп (табл.2). С ростом заряда ядра увеличивается количество электронных слоев и радиус атома, но количество электронов на внешнем энергетическом уровне остается постоянной: для щелочных металлов (подгруппа IА) — один, а для галогенов (подгруппа VIIА) — семь. Поскольку именно внешние электроны наиболее существенно влияют на химические свойства, то понятно, что каждая из рассмотренных групп элементов-аналогов имеет подобные свойства.
Но в пределах одной подгруппы наряду с подобием свойств наблюдается их некоторое изменение. Так, элементы подгруппы ІА все, кроме Н — активные металлы. Но с ростом радиуса атома и количества электронных слоев экранирующих влияние ядра на валентные электроны, металлические свойства усиливаются. Поэтому Fr более активный металл, чем Сs, a Cs — более активный, чем R в и т.д. А в подгруппе VIIA по той же причине ослабляются неметаллические свойства элементов при росте порядкового номера. Поэтому F — более активный неметалл по сравнению с Cl, a Cl — более активный неметалл сравнению с Br и т.д.
Таблица 2 — Некоторые характеристики элементов ІА и VІІА-подгрупп
| период | Подгруппа IA | Подгруппа VIIA | ||||||
|---|---|---|---|---|---|---|---|---|
| Символ элемента | Заряд ядра | Радиус атома, нм | Внешняя электронная конфигурацiя | Символ элемента | Заряд ядра | Радиус атома, нм | Внешняя электронная конфигурацiя | |
| II | Li | +3 | 0,155 | 2 s 1 | F | +9 | 0,064 | 2 s 2 2 p 5 |
| III | Na | +11 | 0,189 | 3 s 1 | Cl | +17 | 0,099 | 3 s 2 3 p 5 |
| IV | K | +19 | 0,236 | 4 s 1 | Br | 35 | 0,114 | 4 s 2 4 p 5 |
| V | Rb | +37 | 0,248 | 5 s 1 | I | +53 | 0,133 | 5 s 2 5 p 5 |
| VI | Cs | 55 | 0,268 | 6 s 1 | At | 85 | 0,140 | 6 s 2 6 p 5 |
| VII | Fr | +87 | 0,280 | 7 s 1 | — | — | — | — |
Побочные подгруппа — это совокупность элементов, размещаемых в периодической таблице вертикально и имеют одинаковое количество валентных электронов за счет застройки внешнего s- и втором снаружи d-энергетических подуровней.
Все элементы побочных подгрупп относятся к d-семейству. Эти элементы иногда называют переходными металлами. В побочных подгруппах свойства изменяются более медленно, поскольку в атомах d-элементов электроны застраивают второй извне энергетический уровень, а на внешнем уровне находятся только один или два электрона.
Положение первых пяти d-элементов (подгруппы IIIБ- VIIБ) каждого периода можно определить с помощью суммы внешних s-электронов и d-электронов второго снаружи уровня. Например, из электронной формулы скандия (Sc — 4s2 3d1 ) видно, что он размещается в побочной подгруппе (поскольку является d-элементом) третьей группы (поскольку сумма валентных электронов равна трем), а марганец (Mn — 4s2 3d5 ) размещается в побочной подгруппе седьмой группы.
Положение последних двух элементов каждого периода (подгруппы IБ и IIБ) можно определить по количеству электронов на внешнем уровне, поскольку в атомах этих элементов предыдущий уровень является полностью завершенным. Например, Ag ( 5s1 5d10 ) размещается в побочной подгруппе первой группы, Zn ( 4s2 3d10 ) — в побочной подгруппе второй группы.
Триады Fe-Co-Ni, Ru-Rh-Pd и Os-Ir-Pt размещены в побочной подгруппе восьмой группы. Эти триады образуют две семьи: железа и платиноидов. Кроме указанных семей отдельно выделяют семью лантаноидов (четырнадцать 4f-элементов) и семью актиноидов (четырнадцать 5f-элементов). Эти семьи принадлежат к побочной подгруппе третьей группы.
Рост металлических свойств элементов в подгруппах сверху вниз, а также уменьшение этих свойств в пределах одного периода слева направо обусловливают появление в периодической системе диагональной закономерности. Так, Be очень похож на Al, B — на Si, Ti — на Nb. Это ярко проявляется в том, что в природе эти элементы образуют подобные минералы. Например, в природе Те всегда бывает с Nb, образуя минералы — титанониобаты.
Модели атомов
Атом – сфера положительного электричества с плавающими электронами. Если проводить аналогию с кондитерским пудингом, то сфера – тесто, а электроны – изюм.
Эрнест Резерфорд (1911 г.) – планетарная модель
В центре атома располагается небольшое ядро, которое имеет положительный заряд. Вокруг ядра электроны, заряженные отрицательно, движутся как планеты. Т.е. ядро – Солнце нашей галактики, а планеты – это электроны.
Нильс Бор (1913 г.) – квантовая теория
Положения теории Бора.
- Электрон может вращаться по стационарным круговым орбиталям.
- При движении по орбиталям электроны не излучают энергию.
- Атом излучает или поглощает электромагнитную энергию при переходе электрона на другую орбиталь.
- Квантовая теория (с 1932 г.) – современная теория
Ядро атома включает протоны и нейтроны. Количество электронов равно сумме протонов. Точное расположение электрона определить невозможно, можно только найти его наиболее вероятную область нахождения. При переходе с орбитали на орбиталь испускается или поглощается электромагнитная энергия.
Чем ограничены правила
Существует некое ограничение правил, которое касается низко лежащих состояний атомов. Если воздействие электронной корреляции (взаимной обусловленности движений электронов) небольшое и не нарушает границ применимости одно-конфигурационного приближения.
Кроме этого существуют отдельные правила, которые применяются для ограниченного количества типов состояний. Эти правила отвечают изменению энергии атома при конкретной конфигурации и данных L и S в зависимости от J, и связаны с взаимодействием спин-орбиталей и другими тонкими эффектами.
Например, если лишь одна из оболочек конфигурации частично заполнена, тогда в случае, когда оболочка будет заполнена менее чем на половину, энергия будет возрастать с J. В других случаях, когда J возрастает, энергия понижается. Первый алгоритм носит название нормальная мультипликация, второй — обратная мультипликация.
В этом случае для атома C правила обосновываются экспериментальными значениями энергий возбуждения из основного состояния \({}^3P_0\): энергия перехода в состояние \({}^3P_1\) будет равняться 0,2 кДж/моль, а в состояние \({}^3P_2\) — 0,5 кДж/моль.
Условия для соблюдения
Молекулы могут образовать исключительно атомы, у которых присутствует от одного неспаренных электронных спинов. В соответствии с правилом Хунда в одной подоболочке у электронов есть столько параллельных спинов, сколько это возможно. Это означает, что у максимального числа электронов одинаковое направление спина. Учитывая это, все атомы, за исключением тех, у которых замкнутые подоболочки, имеют неспаренные электроны. Таким образом, у этих электронов могут создаваться связи.
Учитывая вышеизложенное, химические соединения создаются всеми элементами с незамкнутыми внешними оболочками. Тогда для построения основного терма, применяется следующее правило Хунда: терм, расположенный ниже по энергии характеризуется максимальной мультиплетностью; если мультиплетности равны, то термом с минимальной энергией является тот, которому принадлежит максимальная величина суммы орбитального момента.
Основания для выполнения первого и второго правила
- Основание для выполнения первого правила: между симметрией пространственной части волновой функции атома и симметрией ее спиновой части существует тесная взаимосвязь, которая существует в рамках принципа Паулини. Таким образом, первое правило Хунда выполняется в том числе для молекул.
- Основание для выполнения второго правила: правило имеет больше ограничений в том, что касается его применения. Это правило является определяющим в том, насколько существенным является межэлектронное отталкивание в анализируемых состояниях. Указанное правило так же актуально и для линейных молекул (в случаях, когда L заменена модулем проекции момента количества движения на ось молекулы.
Энергии основных термов
Для конкретной конфигурации электронов можно иногда можно построить ряд атомных термов, которые имеют разную энергию. Терм может расщепляться на мультиплет, образовывая тонкую структуру. Часто требуется выделить основной терм и основное состояние.
Для основного состояния атомов существуют эмпирические правила, которые называют правилами Хунда:
- Если задана электронная конфигурация, то минимальную энергию имеет терм, полный спин ($S$) которого является самым большим (мультиплетность максимальна).
- Если имеется несколько термов с одинаковой мультиплетностью, то самым низким является тот терм, у которого самое большое значение полного орбитального момента ($L$).
Правила Хунда объясняют тем, что при максимальных величинах $S$ и $L$ электроны (в среднем) располагаются дальше друг от друга. Значит, энергия отталкивания минимизируется.
Так, рассмотрим электронную конфигурацию $d^2.$ Можно определить каким является основной терм для такой конфигурации не находя полный набор термов. Для того, чтобы выполнялось первое правило Хунда и S было равно максимальному значению, то есть единице необходимо, чтобы имеющиеся два электрона в приведенной конфигурации имели одинаковую проекцию спинов (либо $+\frac{1}{2},\ либо-\frac{1}{2}\ $). При этом состояния электронов должны быть таковы, что полный орбитальный момент был максимальным. Так как значение $L=4$ было бы не совместно с требованием $S=1$ (электроны были бы спаренными), значит $L=3$. Получаем, что основным будет терм ${}^3F$.
Для выявления основного состояния в терме применяют правило Ланде (иногда оно включено в правила Хунда):
если подоболочка атома заселена меньше, чем на $\frac{1}{2}$, то минимальной энергией обладает нормальный мультиплет (состояние, которое имеет минимальное значение $J$); ели подоболочка заполнена более, чем на 50\%, то минимальную энергию имеет состояние с максимальным $J$ (обращенный мультиплет).
Пример 1
Задание: Определите основной терм атома азота.
Решение:
Атом азота имеет электронную конфигурацию:
\
Пусть спины всех внешних электронов (их количество равно трем) направлены в одну сторону. Следовательно, получим:
\
что означает, что у нас имеется квартетный терм. Составим таблицу из квантовых чисел:
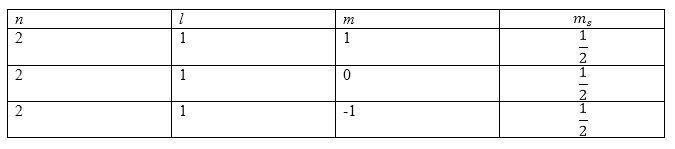 Рисунок 1.
Рисунок 1.
Для того, чтобы все спины имели одинаковые направления необходимо использовать все величины магнитного квантового числа ($m$). Получим, что:
\
Ответ: Можно сделать вывод о том, что основным термом является терм ${}^4S$, а основное состояние — ${{}^4S}_{\frac{3}{2}}.$
Пример 2
Задание: Каким будет основной терм атома кислорода?
Решение:
Атом кислорода имеет электронную конфигурацию:
\
Составим таблицу из квантовых чисел:
 Рисунок 2.
Рисунок 2.
Для атома кислорода нельзя направить все спины в одну сторону. В результате видно, что получаем два некомпенсированных спина. Значит, основной терм будет триплетом. Помимо этого результирующий орбитальный момент равен:
\
В качестве основного терма имеем:
\
Применим правило Ланде, учтем, что p — подоболочка заселена более чем на $\frac{1}{2}$, получим основное состояние:
\
Ответ: Основной терм кислорода — ${}^3{P,}\ $основное состояние — ${{}^3P}_2.$
Примеры решения задач
Задача 1. Охарактеризуйте квантовыми числами электроны атома углерода в невозбужденном состоянии. Ответ представьте в виде таблицы.
Решение. Электронная формула атома углерода: 1s22s22p2. В первом слое атома углерода находятся два s-электрона с антипараллельными спинами, для которых n = 1. Для двух s-электронов второго слоя n = 2. Спины двух р-электронов второго слоя параллельны; для них m s= +1/2.
| № электрона | n | l | ml | ms |
| 1 | 1 | +1/2 | ||
| 2 | 1 | –1/2 | ||
| 3 | 2 | +1/2 | ||
| 4 | 2 | –1/2 | ||
| 5 | 2 | 1 | 1 | +1/2 |
| 6 | 2 | 1 | +1/2 |
Решение и ответ
Свернуть
Задача 2. Охарактеризуйте квантовыми числами внешние электроны атома кислорода в основном состоянии. Ответ представьте в виде таблицы.
Решение. Электронная формула атома кислорода: 1s22s22p4. Во внешнем слое у этого атома находятся 6 электронов 2s22p4. Значения их квантовых чисел приведены в таблице.
| № электрона | n | l | ml | ms |
| 1 | 2 | +1/2 | ||
| 2 | 2 | –1/2 | ||
| 3 | 2 | 1 | 1 | +1/2 |
| 4 | 2 | 1 | +1/2 | |
| 5 | 2 | 1 | –1 | +1/2 |
| 6 | 2 | 1 | 1 | –1/2 |
Решение и ответ
Свернуть
Задача 3. Охарактеризуйте квантовыми числами пять электронов, находящихся в состоянии 4d. Ответ представьте в виде таблицы.
Решение. Согласно правилу Хунда электроны в квантовых ячейках располагаются следующим образом:
Значения главного, побочного и спинового квантовых чисел у электронов одинаковы и равны n=4, l=2, ms=+1/2. Рассматриваемые электроны отличаются значениями квантовых чисел ml.
| № электрона | n | l | ml | ms |
| 1 | 4 | 2 | 2 | +1/2 |
| 2 | 4 | 2 | 1 | +1/2 |
| 3 | 4 | 2 | +1/2 | |
| 4 | 4 | 2 | –1 | +1/2 |
| 5 | 4 | 2 | –2 | +1/2 |
Решение и ответ
Свернуть
Задача 4. Рассчитайте максимальное число электронов в электронном слое с n = 4.
Решение. Максимальное число электронов, обладающих данным значением главного квантового числа, рассчитываем по формуле (2). Следовательно, в третьем энергетическом уровне может быть не более 32 электронов.
Решение и ответ
Свернуть
Задача 5. Рассчитайте максимальное число электронов в электронной оболочке с l = 3.
Решение:
Максимальное число электронов в оболочке определяется выражением (1). Таким образом, максимальное число электронов в электронной оболочке с l = 3 равно 14.
Решение и ответ
Свернуть
Строение атома
Атомы – частицы, из которых состоят молекулы. Понятие «атом» ввел Демокрит. Он считал эти частицы первоначалом мироздания. С греческого языка атом переводится как неделимый.
Представление Демокрита о месте атомов в мире.
После Демокрита учение об атомах было забыто на несколько веков. Возродил атомистическую теорию Джон Дальтон.Он установил, что атомы одного элемента одинаковы. Джон Дальтон определил атом, как «неделимый, вечный и неразрушимый».
В начале XX в. было установлено, что атом делим. Этот вывод был сделан исходя из ряда научных открытий.
- Катодные лучи – поток электронов в вакуумной трубке, содержащей катод и анод.
- Фотоэффект – испускание металлом электронов под действием падающего на него света.
- Рентгеновские лучи – электромагнитное излучение подобное свету с гораздо более высокой частотой, испускаемой при действии на них катодных лучей.
- Радиоактивность – явление самопроизвольного превращения одного химического элемента в другой, которое сопровождается испусканием электронов или других частиц и рентгеновского излучения.
Экспериментальные данные показывают, что атом – сложная частица. На протяжении многих лет ученые спорили о строении и свойствах атома.
«Периодическая система химических элементов»
Ключевые слова конспекта: Периодическая система химических элементов Д.И. Менделеева, группы и периоды Периодической системы, физический смысл порядкового номера химического элемента.
Периодическая система химических элементов — это таблица, в которой все химические элементы расположены в порядке возрастания атомных номеров. Таблица включает в себя периоды и группы, т.е. горизонтальные строчки и вертикальные столбцы.
Период — это последовательность (горизонтальный ряд в таблице) элементов с возрастающими атомными номерами, начинающаяся щелочным металлом (или водородом) и заканчивающаяся благородным газом.
Число электронных слоев в атомах данного периода равно номеру периода.
В периодах с возрастанием атомного номера Z металлические свойства ослабевают, а неметаллические усиливаются.
Группа — это вертикальная колонка элементов в таблице, включающая элементы с одинаковой максимальной степенью окисления, равной номеру группы, и одинаковой отрицательной степенью окисления, для атомов неметаллов равной номеру группы минус 8.
В группах с возрастанием атомного номера Z металлические свойства усиливаются, а неметаллические ослабевают. Число валентных электронов атома обычно равно номеру группы.
В коротком варианте таблицы Менделеева различают малые периоды — 1-й, 2-й и 3-й, содержащие 2, 8 и 8 элементов соответственно, а также большие периоды — 4-й, 5-й, 6-й и незавершенный 7-й. Каждый большой период таблицы включает две строчки (два ряда). Например, в 4-м периоде, начинающемся калием 19K, последний элемент в верхней строчке — никель 28Ni, он в числе элементов триады (Fe, Со, Ni) попадает в VIII группу. Следующий элемент — медь 29Cu записан строчкой ниже и находится в I-й группе.
Каждая группа с номерами от I до VIII включает две группы — А и Б.
A-группы включают элементы малых периодов, а также элементы больших периодов, которые по свойствам наиболее близки к соответствующим элементам малых периодов.
Б-группы включают элементы больших периодов, в атомах которых электроны, появляющиеся в них с увеличением заряда ядра, попадают в слой, предшествующий внешнему.
Физический смысл порядкового номера химического элемента:
- это число нейтронов в атоме;
- это относительная атомная масса;
- это число энергетических уровней в атоме;
- это число протонов в ядре.
Конспект урока «Периодическая система химических элементов».
Следующая тема: «Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе».
Последовательность заполнения электронных оболочек атомов
Два принципа определяют строение электронной оболочки атома элемента:
-
принцип Паули, который гласит: в атоме может существовать только один электрон с определенным набором квантовых чисел, что учитывает квантовые свойства возможных состояний атома;
-
принципом минимума энергии: при известном суммарном количестве электронов в атоме реализуется состояние с наименьшей энергией. Данный принцип является естественным для существования устойчивого состояния атома. Так как, если состояние атома не является состоянием с наименьшей энергией, то атом может под воздействием внутренних причин перейти в состояние с минимумом энергии.
Анализируя строение атома в первом приближении, пренебрегают энергией взаимодействия электронов. При этом энергию атома приравнивают к суммарной энергии электронов в поле, которое создается ядром атома. Отталкиваясь от данной известной энергии, находят распределение электронов по разным состояниям при учете принципа Паули и минимума энергии. При этом получают идеальную схему заполнения оболочек. Надо отметить, что идеальная схема заполнения может сильно отличаться от реально существующей. Исходя из принципа Паули, максимальное количество электронов (N), которое может находиться в оболочке равно:
где $n$ — главное квантовое число, $l=0,1…, n-1$ (при заданном $n$) — орбитальное квантовое число.
Энергия электрона в поле ядра растет при увеличении главного квантового числа. Минимальную энергию имеют электроны на $K$ — оболочке ($n=1$), потом на $L$- оболочке ($n=2$) и далее. Что означает последовательное заполнение оболочек, начиная с $K \ (K,L,M,…).$
Замечание 1
Надо заметить, что в первом приближении энергия электронов не зависит от орбитального квантового числа, поэтому для того, чтобы объяснить схему заполнения состояний $s,p,d,f…$ требуется учитывать взаимодействие между электронами. При этом получают, что их энергия взаимодействия растет с ростом $l$ (при заданном $n$). В идеальной схеме заполнения оболочки считают, что каждый новый присоединяющийся электрон связывается в состоянии с минимальными квантовыми числами $n,l$, которые допускает принцип Паули.
Следствие правила Хунда
Только те атомы могут образовать молекулы, у которых присутствует один или более неспаренных электронных спинов. По правилу Хунда в одной подоболочке электроны имеют столько параллельных спинов, сколько это возможно (то есть направление спина одинаково у максимального числа электронов). При этом все атомы (исключая атомы с замкнутыми подоболочками) обладают неспаренными электронами, следовательно, могут создавать связи (вступать в реакции). Из сказанного выше можно сделать вывод о том, что все элементы с незамкнутыми внешними оболочками могут создавать химические соединения.
Правила Хунда (используются для построения основного терма):
- ниже по энергии расположен терм, мультиплетность которого максимальна;
- если мультиплетности равны, то минимальна энергия у терма, которому принадлежит максимальная величина суммы орбитального момента.
Пример 1
Задание: Объясните, каковы структуры молекул водорода, кислорода и азота?
Решение:
Структура атома $H$ имеет вид:
\
Значит, структура молекулы водорода $(H):$
\
Электронную структуру атома кислорода $(O)$ запишем как:
\
Во внешней незамкнутой оболочке расположено $4$ электрона которые находятся в состоянии $2p$. Подоболочка $2p$ имеет три разных координатных состояния. Они соответствуют $m=-1,0,1.$ В соответствии с правилом Хунда и принципом Паули, три электрона заполнят данные состояния, обладая параллельными спинами, один электрон будет иметь спин противоположного направления. Получается, что во внешней оболочке два электрона имеют одинаково направленные спины, то есть способны образовывать связи с электронами другого атома. Валентность атома кислорода равна двум. При этом структура молекулы имеет вид:
\
Запишем электронную конфигурацию атома азота $(N)$:
\
Соответственно:
\
Внешняя оболочка имеет три электрона, спины которых параллельны. Валентность атома азота равна трем. Соответственно, структурная формула молекулы азота запишется как:
\
Ответ: $H-H;$ $O=O;$ $N\equiv N.$
Пример 2
Задание: Каким будет основной терм и основные состояния у атома углерода?
Решение:
Запишем электронную конфигурацию атома углерода $(C)$:
\
Применим правило Хунда. На внешней оболочке имеются два электрона, следовательно, $S=1$, то есть основной терм будет триплетом. Выберем максимальное значение $L$ для двух эквивалентных $p$-электронов. Учтем принцип Паули. Запишем возможные квантовые числа, которые характеризуют состояния электронов.
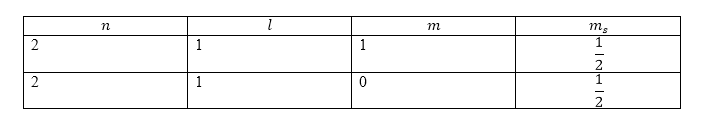 Рисунок 2.
Рисунок 2.
Числа выбираются так, чтобы (для начала) получалось максимальное значение проекции орбитального момента. Так, ${\max \left(M_L\right)\ }=1$, значит $L={\max \left(M_L\right)\ }=1$. Основным термом является:
${}^3P,$ он имеет три состояния: ${}^3{P_{0,1,2}.}\ $Основным является состояние: ${}^3{P_{0.}.}$
Ответ: Основной терм — ${}^3P,\ $основное состояние — ${}^3{P_0.}$






























