Вторичный стандартный раствор
Если титрант с точно известной концентрацией приготовить сразу нельзя, то в этом случае готовят раствор с приблизительной точностью. В дальнейшем его стандартизируют с помощью первичных растворов известной концентрации. Полученный таким образом титрант, называют вторичным стандартным раствором. В некоторых случая стандартизацию проводят не первичным, а другим вторичным раствором с известной концентрацией. Поправочный коэффициент стандартизированных титрантов отличается от единицы, но должен укладываться в диапазон от 0,9 до 1,1.
По своей сути поправочный коэффициент показывает отклонение приготовленного раствора от теоретической концентрации, которую предполагалось получить при смешивании исходных компонентов.
Как понять, что титрование окончено, и какие химические взаимодействия лежат в основе титриметрического анализа, какие еще необходимы реактивы для титрования можно посмотреть в наших последующих материалах.
Химические реакции в титриметрическом анализе
Химические процессы, которые лежат в основе взаимодействия между титрантом и определяемым веществом, могут иметь различную природу. Наиболее часто встречаются:
-
реакции ионного обмена;
-
окислительно-восстановительные процессы;
Зная механизм реакции, можно посчитать ее стехиометрию, а значит определить концентрацию титруемого раствора.
Обменные реакции могут:
-
протекать с образованием малодиссоциирующих соединений (например, воды в реакциях нейтрализации);
-
сопровождаться выпадением осадка;
-
проходить с образованием комплексов.
Все эти взаимодействия должны протекать необратимо, чтобы исходные реагенты расходовались полностью. В этом случае для вычисления концентрации определяемого раствора применим закон эквивалентов.
Задачи на титрование
Пример 1. Допустим, химичка потребовала, чтобы вы нейтрализовали 25,00 мл раствора кислоты H3PO4. На титрование у вас ушло 30,25 мл раствора NaOH. Вычислите отношение нормальных и молярных концентраций обоих растворов.
Решение:
NH3PO4 / NNaOH = VNaOH/ VH3PO4 = 30,25 мл / 25,00 мл = 1,210
Нормальная концентрация NaOH совпадает с молярной, а у H3PO4 нормальность в три раза больше молярной концентрации, поэтому:
cH3PO4/ cNaOH = NH3PO4/3 / NNaOH = 0,403
Пример 2. Вы израсходовали 10,81 мл 0,1 н раствора HCl на титрование 25,00 мл раствора Ca(OH)2. Какую нормальность и молярность имеет анализируемый раствор? Сколько граммов Ca(OH)2 содержится в растворе?
Решение:
Первым делом вычислим нормальную концентрацию анализируемого раствора Ca(OH)2:
NCa(OH)2 = ( VHCl/ VCa(OH)2) × NHCl = ( 10,81 мл / 25,00 мл ) × 0,1 н = 0,0432 н
Молярная концентрация Ca(OH)2 вдвое меньше его нормальной концентрации, так как химический эквивалент Ca(OH)2 равен 2. Поэтому анализируемый раствор имеет молярность 0,0216 М Ca(OH)2. Чтобы ответить на вопрос, сколько граммов Ca(OH)2 содержится в растворе, необходимо найти его количество вещества в растворе, для этого следует множить молярность на объем:
0,0216 моль/л × 0,025 л = 0,000514 моля
По таблице Менделеева определяем, что молекулярная масса Ca(OH)2 равна 74,1 г/моль, а значит в растворе содержится:
0,000541 моля × 74,1 г/моль = 0,0401 г Ca(OH)2
Пример 3. Химик-органик синтезирует новую кислоту. Он растворяет 0,5 г этой кислоты в определенном объеме воды и устанавливает, что для нейтрализации полученного раствора требуется 15,73 мл 0,437 н. раствора NaOH. Чему равен грамм-эквивалент синтезированной им кислоты? Если известно, что эта кислота содержит три ионизуемые группы –COOH, чему равна ее молекулярная масса?
Решение
Число эквивалентов основания, понадобившееся для нейтрализации, равно:
0,01573 л × 0,437 экв/л = 0,00687 экв
Грамм-эквивалент кислоты определяется из соотношения:
0,500 г / 0,00687 экв. = 72,8 г/экв
Так как грамм-эквивалент кислоты равен 72,8 г, а каждый ее моль высвобождает 3 эквивалента ионов водорода H+, молекулярная масса кислоты должна быть равна 3·72,8 г = 218 г.
Надеюсь урок 18 «Кислотно-основное титрование» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Виды титрантов
Название метода произошло от слова титр (франц. качество, характеристика) – концентрации, являющейся количественной характеристикой рабочего раствора, добавляемого к определяемому раствору. Титр титранта должен быть известен заранее, и способ его определения зависит от того, каким образом был приготовлен рабочий раствор.
Титр рабочего раствора обычно выражается как отношение массы (г) растворенного вещества к объему приготовленного раствора (мл) и может быть рассчитан по формуле:

Где,
Т – титр титранта;
mв-ва – масса растворенного вещества;
Vр-ра – объем титрованного раствора.
Титр раствора взаимосвязан с другими видами концентраций, которые также широко используются в количественном анализе: молярной, нормальной, массовой долей растворенного вещества, моляльной. Существуют формулы перерасчета, которые позволяют перейти к любой из них.
В зависимости от способа приготовления различают два вида рабочих растворов:
-
стандартный раствор с приготовленным титром (первичный стандартный раствор);
-
стандартный раствор с установленным титром (стандартизированный раствор).
Точка эквивалентности
Поговорим о сущности процесса кислотно-основного титрования. Из необходимого оборудования, грубо говоря, вам понадобится лишь бюретка (стеклянная трубка с краником) и колба. Бывают два случая:
- Когда нужно определить концентрацию основания в колбе путем добавления из бюретки кислоты известной концентрации.
- Наоборот, когда необходимо определить концентрацию кислоты в колбе путем добавления основания известной концентрации.
Рассмотрим титрование в первом случае, когда титруемый раствор — основание, а титрант — кислота. Начинаем к анализируемому образцу основания постепенно добавлять раствор кислоты с заранее определенной концентраций до тех пор, пока число эквивалентов кислоты не будет равно числу эквивалентов основания. Продолжая титровать, в конце концов мы достигнем конечной точки титрования, или, как ее еще называют, точки эквивалентности — момент титрования, когда число эквивалентов титранта и титруемого раствора будут точно равны.
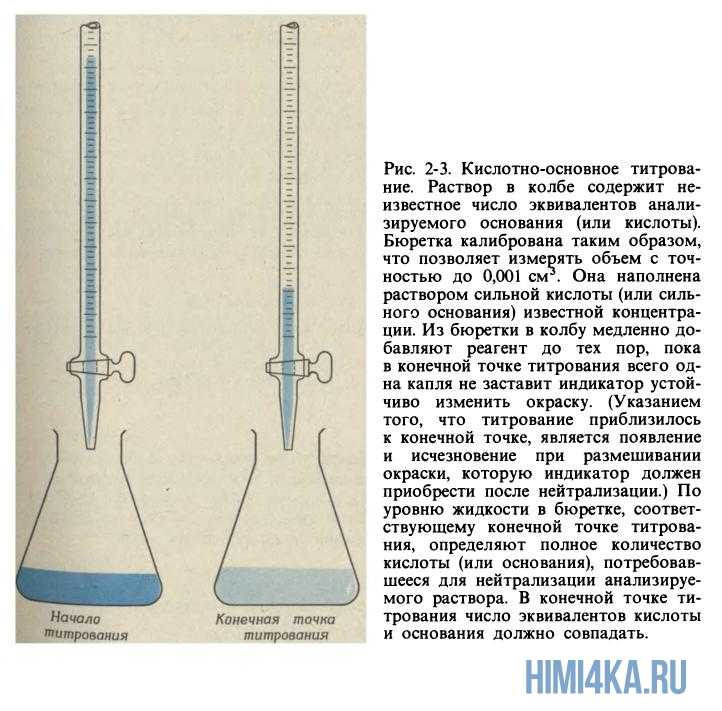
Чтобы понять, достигнута точки эквивалентности или еще нет, обычно используют различные кислотно-основные индикаторы. Для этого перед непосредственным титрованием в колбу с анализируемым раствором добавляют пару капель необходимого индикатора, и в момент достижения точки эквивалентности раствор начинает менять свой цвет.
Зная использованный объем титранта и его концентрацию, можно вычислить число эквивалентов основания в анализируемом образце. Если NA и NB — нормальности растворов кислоты и основания, а VA и VB — их объемы в момент нейтрализации, то:
Число эквивалентов = NAVA = NBVB
С теорией покончено, переходим к решению задач на титрование.





























