Физические и химические свойства
Светло-жёлтые кристаллы с тетрагональной (существуют также ромбическая и моноклинная модификации) решёткой, существующие в виде тригидрата . Плотность 1,853 г/см³ при +17 °C.
Растворимость в воде 35,8 г/100 г при +25 °C, она уменьшается в присутствии аммиака или других солей калия. В абсолютном спирте нерастворим, но растворяется в смесях спирта с водой. Мало растворим в метаноле (0,024 моль/л), практически не растворяется в эфире, пиридине, анилине, этилацетате, жидких хлоре и аммиаке.
Гексацианоферрат(II) калия диамагнитен, при низких температурах является сегнетоэлектриком.
Выше +120 °C (по другим данным, выше +87,3 °C) превращается в безводную соль с плотностью 1,935 г/см³. Выше 650 °C разлагается:
В реакции с концентрированной соляной кислотой выделяется белый осадок железистосинеродистой кислоты ().
С концентрированной серной кислотой реагирует по уравнению:
- .
Этим способом можно пользоваться в лаборатории для получения монооксида углерода.
С солями металлов в степени окисления +2 и +3, образует малорастворимые соединения гексацианоферратов(II)
.
В водных растворах окисляется хлором и другими окислителями, такими, как пероксид водорода до гексацианоферрата(III) калия:
Анион очень прочен (его константа нестойкости, по разным данным, от 4⋅10-36 до 1⋅10-35), не разлагается ни щелочами, ни кислотами, устойчив по отношению к воздуху; поэтому растворы гексацианоферрат(II) калия, как и все ферроцианиды, не дают реакций ни на , ни на .
Синтез и свойства комплексов железа (II) и железа (III)
КУРСОВАЯ РАБОТА
по неорганической химии
СИНТЕЗ И СВОЙСТВА КОМПЛЕКСОВ ЖЕЛЕЗА (II) И ЖЕЛЕЗА
(III)
Введение
Цель
данной работы состоит в изучении строения и свойств комплексных соединений
железа (II) и железа (III).
В
ходе выполнения работы были поставлены следующие задачи:
1)
изучение литературных данных о физических свойствах элементов VIIIB группы и их
соединений, в частности, соединений железа;
2)
анализ комплексных соединений железа (II) и железа (III) с различными лигандами
с точки зрения теории кристаллического поля;
3)
изучение литературных данных о строении цианидных комплексов железа (спектры
Мессбауэра).
В
ходе литературного поиска рассматриваются:
1)
теория кристаллического поля;
2)
эффект Мессбауэра;
3)
комплексообразование в растворах.
В
экспериментальной части предпринята попытка получения кристалла «берлинской
лазури» — «турнбулевой сини», получены комплексы триоксалатоферрата(III) и
хелатный комплекс.
1.
Литературный обзор
Мнемонические правила
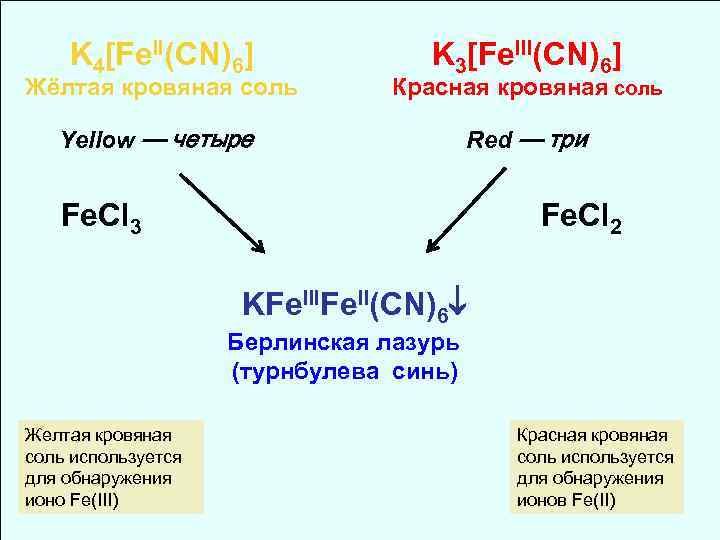
Для того, чтобы запомнить формулу красной кровяной соли K3[Fe(CN)6] и не перепутать её с формулой желтой кровяной соли K4[Fe(CN)6], существует несколько мнемонических правил:
- В соли красной кровяной калий с тройкой за стеной. Дальше — феррум, шесть цианов: все готово без обманов.
- Число атомов калия соответствует числу букв в английских названиях солей: «gold» — 4 буквы, то есть 4 атома калия — желтая кровяная соль K4[Fe(CN)6]. «Red» — три буквы, то есть три атома калия — красная кровяная соль — K3[Fe(CN)6].
- «Калий три — будет красный». Мнемоника построена на игре слов: «три» (число) и «три» (повелительное наклонение глагола «тереть»). Как известно при потирании, например, кожи, последняя краснеет.
Применение
Применяют при изготовлении пигментов, крашении шёлка, в производстве цианистых соединений, ферритов, цветной бумаги, как компонент ингибирующих покрытий и при цианировании сталей, для выделения и утилизации радиоактивного цезия.
В пищевой промышленности ферроцианид калия зарегистрирован в качестве пищевой добавки E536, препятствующей слёживанию и комкованию. Применяется как добавка к поваренной соли. В Российской Федерации широко применяют при производстве продуктов питания — соли, творожных продуктов, в виноделии и прочем.
Гексацианоферрат(II) калия применяется в аналитической химии как реактив для обнаружения некоторых катионов:
1. : образуется малорастворимый синий осадок «берлинской лазури»:
- ,
или, в ионной форме
Получающийся гексацианоферрат(II) калия-железа(III) слабо растворим (с образованием коллоидного раствора), поэтому носит название «растворимая берлинская лазурь».
2. : образуется белый осадок гексацианоферрата(II) цинка-калия:
- ,
или, в ионной форме
3. : из нейтральных или слабокислых растворов выпадает красно-бурый осадок гексацианоферрата(II) меди(II):
- ,
или, в ионной форме
Может использоваться для получения синильной кислоты:
Свойства
Выглядит как тёмно-красные кристаллы с моноклинной решеткой, имеет плотность 1,845 г/моль, хорошо растворим в воде: 40,8 г/100 г (15,6 °C), 58,7 г/100 г (37,8 °C). Водный раствор зеленовато-жёлтого цвета. В этаноле нерастворим.
Гексацианоферрат(III) калия — очень сильный окислитель, особенно в щелочной среде. Окисляет сероводород до серы, иодоводород до иода, оксид свинца(II) до оксида свинца(IV), аммиак до азота и солей аммония, вольфрам до WO42−:
Ранее считалось, что при этом образуется гексацианоферрат(III) железа(II), то есть FeII3[Fe(CN)6]2, именно такую формулу предлагали для «турнбулевой сини». Теперь известно, что турнбулева синь и берлинская лазурь — одно и то же вещество, а в процессе реакции происходит переход электронов от ионов Fe2+ к гексацианоферрат(III) — иону (валентная перестройка Fe2+ + [Fe3+(CN)6] к Fe3+ + [Fe2+(CN)6] происходит практически мгновенно, обратную реакцию можно осуществить в вакууме при 300 °C). Эта реакция является аналитической и используется для определения ионов Fe2+.Соли Fe3+ при этом не мешают, так как дают только слабое зеленовато-коричневое окрашивание (гексацианоферрат(III) железа(III) Fe3+[Fe3+(CN)6] устойчив только в растворах).
С концентрированной серной кислотой реагирует с образованием моноксида углерода:
Реагирует с перекисью бария (эта реакция может использоваться для количественного определения BaO2):
При взаимодействии с кислотами выделяет весьма токсичный цианистый водород:
Интересно то, что из гексацианоферрата(III) калия можно получить гексацианоферрат(II) калия с помощью перекиси водорода в щелочной среде:
Однако в нейтральной среде эта реакция протекает в обратную сторону.