Виды истинных растворов
По агрегатному состоянию растворы бывают жидкими, газообразными и твердыми. Наиболее распространены жидкие системы, причем они также подразделяются на несколько типов в зависимости от исходного состояния растворенного вещества:
- твердое в жидком, например, сахар или соль в воде;
- жидкое в жидком, например, серная или соляная кислоты в воде;
- газообразное в жидком, например, кислород или углекислый газ в воде.
Однако растворителем может быть не только вода. И по природе растворителя все жидкие растворы делят на водные, если вещества растворены в воде, и неводные, если вещества растворены в эфире, этаноле, бензоле и т.д.
По электрической проводимости растворы делят на электролиты и неэлектролиты. Электролитами являются соединения с преимущественно ионной кристаллической связью, которые при диссоциации в растворе образуют ионы. Неэлектролиты при растворении распадаются на атомы или молекулы.
В истинных растворах одновременно происходят два противоположных процесса — растворение вещества и его кристаллизация. В зависимости от положения равновесия в системе «растворенное вещество — раствор» различают следующие виды растворов:
- насыщенный, когда скорость растворения некоторого вещества равна скорости его же кристаллизации, то есть раствор находится в равновесии с растворяющим веществом;
- ненасыщенные, если в них содержится меньше растворенного вещества, по сравнению с насыщенным при той же температуре;
- пересыщенные, которые содержат избыток растворенного вещества в сравнении с насыщенным, и одного кристаллика его бывает достаточно для начала активной кристаллизации.
В качестве количественной характеристики, отражающей содержание того или иного компонента в растворах, используют концентрацию. Растворы с малым содержанием растворенного вещества называют разбавленными, а с высоким — концентрированными.
Классификация растворов
В зависимости от агрегатного состояния различают газообразные, жидкие и твердые Р. К газообразным Р. относятся смеси любых газов и паров, в т. ч. и освобожденный от пыли воздух. К твердым Р. относятся многие металлические сплавы (см.), стекло, минералы.
Особое значение для медицины и медико-биол. наук имеют жидкие Р., образуемые в результате растворения газов, жидкостей или твердых веществ в жидкостях.
Состав Р. выражают концентрацией компонентов (см. Концентрация). Р. с большой концентрацией растворенного вещества называют концентрированными, с малой — разбавленными. Р., находящиеся в равновесии с избытком растворяющегося вещества, называют насыщенными. В ненасыщенных Р. концентрация растворенного вещества меньше, а в пересыщенных больше, чем в насыщенных. Р., подчиняющиеся закону Рауля (см. Рауля закон), при всех возможных концентрациях называют идеальными растворами.
По способности проводить электрический ток Р. подразделяют на Р. электролитов (см.), или ионные Р., хорошо проводящие электрический ток (к ним относятся, напр., водные растворы к-т, оснований, солей), и на Р. неэлектролитов, или молекулярные, не проводящие электрического тока (напр., растворы глюкозы, этанола и др.).
В зависимости от величины мол. веса (массы) растворенного вещества жидкие Р. делят на Р. низкомолекулярных веществ (Р. глюкозы, этанола, глицерина, обычных к-т, щелочей и солей и др.) и на Р. высокомолекулярных соединений (см.), к к-рым относятся, напр., растворы белков, полисахаридов, нуклеиновых к-т в воде, каучука в бензоле и др. Растворы высокомолекулярных соединений обладают рядом свойств, присущих типичным коллоидным дисперсиям (см. Коллоиды).
Растворение
Растворение (перемешивание жидкостей, а также жидкостей и твердых тел) — основная стадия изготовления растворов, применяемых наружно, внутрь и в виде инъекций, — является довольно частой операцией при изготовлении лекарств. Наиболее важным из всех физико-химических свойств веществ является их способность растворяться в воде или других растворителях, т.е. растворимость. Растворимость количественно определяется концентрацией насыщенного раствора при данных условиях. Она может быть выражена теми же способами, что и концентрация (в процентах растворенного вещества или в молях на литр раствора), однако наиболее часто растворимость выражают числом граммов данного вещества, растворяющихся в 100 мл растворителя при определенной температуре. Показатели растворимости в разных растворителях приведены в частных статьях. Так, например, кислота ацетилсалициловая мало растворима в воде (растворима в горячей воде), легко — в спирте, в растворах едких и углекислых щелочей.
Огромную роль при перемешивании жидкостей и приготовлении растворов играет природа растворяемого вещества и растворителя. Одно и то же вещество в разной степени растворимо в различных растворителях, и наоборот — различные вещества смешиваются с одним и тем же растворителем по-разному.
С практической стороны важным руководящим правилом, позволяющим до известной степени разобраться в общих закономерностях растворимости, является давний принцип — “подобное растворяется в подобном” установленный еще алхимиками. («Similia similibus solventur»).
Любой раствор состоит из растворенного вещества и растворителя, т.е. среды, в которой это вещество равномерно распределено в виде молекул или еще более мелких частиц — ионов. Но не всегда легко определить, какое из веществ является растворителем, а какое — растворенным веществом. Как правило, растворителем считают тот компонент, который в чистом виде существует в том же агрегатном состоянии, что и полученный раствор. Например, в случае водного раствора натрия хлорида растворителем является вода. В том случае, если оба компонента до растворения находились в одинаковом агрегатном состоянии (например, вода и спирт), то растворителем обычно считается компонент, взятый в большем количестве.
Теории растворов и механизм растворения
Известны две основные теории Р. Физическая теория, разработанная в последней четверти 19 в. Я. Вант-Гоффом и С. Аррениусом, рассматривает растворитель как химически индифферентную среду, в к-рой равномерно распределены частицы (молекулы, ионы) растворенного вещества. При этом предполагается отсутствие межмолекулярного взаимодействия как между самими частицами растворенного вещества, так и между ними и молекулами растворителя. С позиций физической теории удалось объяснить ряд свойств разбавленных Р.— понижение давления пара (см. Рауля закон), понижение температуры замерзания (см. Криометрия), повышение температуры кипения (см. Эбуллиометрия) и такое явление, как осмотическое давление (см.) Р. Эти свойства, называемые коллигативными, или осмотическими, свойствами Р., зависят только от концентрации частиц растворенного вещества, но не от их природы. Однако физическая теория оказалась несостоятельной при объяснении ряда свойств Р., особенно свойств концентрированных Р.
Химическая, или сольватная, теория Р. предложена Д. И. Менделеевым в 1887 г. Согласно этой теории, между частицами растворенного вещества и молекулами растворителя происходит взаимодействие, в результате к-рого образуются нестойкие соединения переменного состава, называемые сольватами или гидратами — в тех случаях, когда растворителем является вода (см.). Главную роль в образовании сольватов играют не валентные связи, а менее прочные межмолекулярные силы и водородные связи (см. Молекула). Сольватная теория дала возможность объяснить изменение ряда свойств Р. (плотности, вязкости, удельной теплоемкости и др.) с изменением их концентрации, тепловые эффекты, наблюдаемые при растворении, и др. Необходимо отметить, что физическая и химическая теории Р. не исключают, а дополняют друг друга.
Механизм растворения в общих чертах состоит в следующем. При внесении в растворитель (напр., воду) растворяемого вещества его молекулы или ионы подвергаются гидратации (см.), отрываются от растворяемого вещества и вследствие диффузии равномерно распределяются по всему объему Р. Одновременно с растворением протекает и обратный процесс — выделение молекул или ионов из Р. и переход их в состав еще не растворившегося вещества. Скорость выделения растворенного вещества, пропорциональная его концентрации в Р., в начале процесса равна нулю, но по мере растворения вещества непрерывно возрастает. По истечении нек-рого времени скорости двух противоположно направленных процессов становятся равными друг другу. С этого момента между избытком нерастворившегося вещества и Р. устанавливается динамическое равновесие, при к-ром при неизменных внешних условиях концентрация Р., называемого в данном случае насыщенным, и количество нерастворившегося вещества остаются постоянными.
Процесс растворения сопровождается выделением или поглощением теплоты. Этот эффект растворения складывается из теплоты, необходимой для отрыва молекул или ионов от растворяемого вещества и равномерного распределения их по всему объему Р., и из теплоты гидратации (сольватации) частиц растворяемого вещества. Поскольку первый из этих процессов происходит с поглощением, а второй с выделением теплоты, тепловой эффект растворения может быть как положительным (выделение теплоты), так и отрицательным (поглощение теплоты).
Свойства растворов
Рассматривая этот вопрос, чаще всего говорят о разбавленных растворах неэлектролитов. Связано это, во-первых, с тем, что степень взаимодействия между частицами приближает их к идеальным газам. А во-вторых, свойства их обусловлены взаимосвязанностью всех частиц и пропорциональны содержанию компонентов. Такие свойства истинных растворов называют коллигативными. Давление пара растворителя над раствором описывается законом Рауля, который гласит, что снижение давления насыщенного пара растворителя ΔР над раствором прямо пропорционально мольной доле растворенного вещества (Тв-ва) и давлению пара над чистым растворителем (Р0р-ля):
ΔР = Рор-ля ∙ Тв-ва
Повышение температур кипения ΔТк и температур замерзания ΔТз растворов прямопропорционально моляльным концентрациям растворенных в них веществ Сm:
- ΔТк = Е ∙ Сm, где Е — эбулиоскопическая константа;
- ΔТз = К ∙ Сm, где К — криоскопическая константа.
Осмотическое давление π рассчитывают по уравнению:
π = Р∙Е∙Хв-ва / Vр-ля, где Хв-ва — мольная доля растворенного вещества, Vр-ля — объем растворителя.
Значение растворов в обычной жизни любого человека сложно переоценить. Природная вода содержит растворенные газы — СО2 и О2, различные соли — NaCl, CaSO4, MgCO3, KCl и др. Но без этих примесей в организме мог бы нарушиться водно-солевой обмен и работа сердечно-сосудистой системы. Другим примером истинных растворов является сплав металлов. Это может быть латунь или ювелирное золото, но, главное, что после смешивания расплавленных компонентов и остывания полученного раствора образуется одна твердая фаза. Металлические сплавы применяют повсеместно, начиная со столовых приборов, и заканчивая электроникой.
Признаки истинных растворов
Под растворами понимают многокомпонентные однородные системы, образующиеся при распределении одного компонента в другом. Ими также принято называть дисперсные системы, которые в зависимости от размеров образующих их частиц подразделяют на коллоидные системы, суспензии и истинные растворы.
В последних компоненты находятся в состоянии разделенности на молекулы, атомы или ионы. Для таких молекулярно-дисперсных систем характерны следующие признаки:
- сродство (взаимодействие);
- самопроизвольность образования;
- постоянство концентрации;
- гомогенность;
- устойчивость.
Иными словами, они могут образовываться, если между компонентами имеется взаимодействие, которое приводит к самопроизвольному разделению вещества на мельчайшие частицы без усилий, прилагаемых извне. Получаемые растворы должны быть однофазными, то есть между составными частями не должно быть поверхности раздела. Последний признак является наиболее важным, поскольку самопроизвольно процесс растворения может протекать, только если для системы это энергетически выгодно. При этом происходит уменьшение свободной энергии, и система становится равновесной. С учетом всех этих особенностей можно сформулировать следующее определение:
Истинным раствором является устойчивая равновесная система взаимодействующих частиц двух и более веществ, размеры которых не превышают 10-7 см, то есть соразмерны атомам, молекулам и ионам.
Одно из веществ является растворителем (как правило, это тот компонент, концентрация которого выше), а остальные — растворенными веществами. Если исходные вещества находились в разных агрегатных состояниях, то за растворитель принимают то, которое его не изменило.
Слайды и текст этой презентации
Общие правила изготовления растворов.
».

Слайд 2ПК 2.1. Изготавливать лекарственные формы по рецептам и требованиям
учреждений здравоохранения.
ПК
2.2. Изготавливать внутриаптечную заготовку и фасовать
лекарственные средства для последующей реализации.
ПК
2.3. Владеть обязательными видами внутриаптечного
контроля лекарственных средств.
ПК 2.4. Соблюдать правила санитарно – гигиенического режима, охраны труда, техники безопасности и противопожарной безопасности.
ПК 2.5. Оформлять документы первичного учета.



процесса растворения является его самопроизвольность.

правилом: «Подобное растворяется в подобном». Это означает что для растворимого
вещества наиболее пригодными являются те растворители которые структурно сходны и следовательно обладают близкими физико-химическими свойствами.

Слайд 7С современной точки зрения это правило в значительной степени может
быть объяснено наличием или отсутствием у растворителя и растворимого вещества
полярных групп.Полярные группы- это функциональные группы присутствуют в химических соединениях способные образовывать соответствующие связи между контактируемыми веществами.

Слайд 8Полярными функциональными группами являются : ОН, СО, СООН, NH2, жидкости
имеющие эти группы: вода, этанол, глицерин, хорошо смешиваются, т.е. взаимно
растворяются.К неполярным растворителям относятся вещества не имеющие активно функциональных групп (вазелиновое масло, хлороформ).

Слайд 9Растворимость жидкостей в жидкостях колеблется в широких пределах. Наряду с
жидкостями неограниченно растворимыми друг в друге (этанол и вода) имеются
группы ограниченно растворимые друг в друге (эфир и вода -малополярное вещество и полярное вещество) и жидкости практически не растворимые друг в друге (растительное масло и вода).

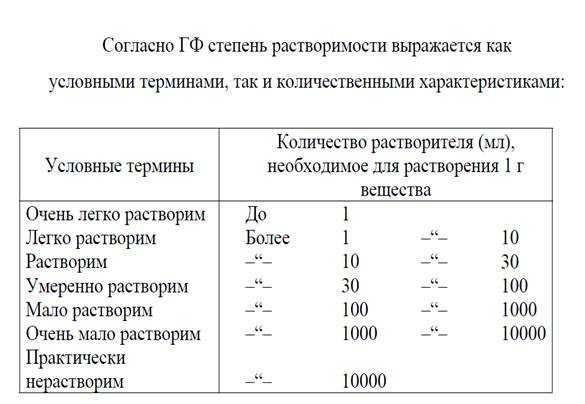
Слайд 10На 1 гр. вещества требуется:1. Очень легко растворимые до 1
мл: Серебра нитратКалия йодид Магния сульфат Новокаин Резорцин2. Легко растворимые
от 1 до 10 мл АнальгинКалия бромид Аскорбиновая кислота Сульфацил Na3. Растворимые 10-30 мл Перманганат калия Кислота борная Кислота глютаминовая Натрия гидрокарбонат
Таблица растворимости

РибофлавинАнестезинЙодМентол

оксид8. Медленно растворимые более 10000 мл АмидопиринКислота борная

Димедрол


вещества входящие в состав:Furacillini 0.02Aquae purificatae 100 ml2. Способ выражения
концентрации в процентах Sol. Furacillini 20%- 100 ml3. Sol. Furacillini ex 0.02-100 ml4. В соотношении:Sol. Furacillini 1:5000-100 ml 1-5000 x- 100 ml x= 0.02 фурациллина

purificatae 100 ml S. По 1 ст.л. 3 раза
в день По рецепту берем 3,0 NaBr, 100гр воды очищенной2. Сокращенный способ Rp: Sol. Natrii bromidi 3% — 100,0 S. По 1 ст.л. Зр\дБерем 3,0 NaBr, 100,0 воды очищенной

Слайд 173 Rp: Sol. Natrii bromidi ex 3.0-120
ml D.S. По 1 ст.л. Зр\д Берем
3,0 NaBr, 120 мл воды очищенной 4. По соотношению Rp: Sol Riboflavini 1:5000-200ml D.S. по 1 ст.л. Зр\д 1:5000 Х:200 Х=0,04- рибофлавин 200 мл воды

Слайд 18Простые содержат 1 лекарственное вещество и растворитель Rp: Sol. acidi
borici 3%- 150ml D.S Для полоскания Расчет: 3%
— 100,0 Х- 150,0 Х= 4,5г борной кислоты 150 мл воды Rp: Sol. Calcii gluconatis ex 2.0-150ml D.S. no 1 ст.л. Зр\д Берем 2,0 кальция глюконата, 150 мл воды
Простые и сложные жидкие лекарственные формы

Слайд 19Сложные жидкие лекарственные формы содержат несколько лекарственных веществ Rp: Natrii bromidi
5.0 Cofeini natrii benzoatis 0.5
Aquae purificatae 100.0 D.S. Rp: Acidi salicilici Recorcini ana 0.75 Yodi 1.0 Acidi borici 1.5 Spiritus aetilicus 70%- 50 ml M.D S. Для полоскания


Растворение
Растворение — переход молекул вещества из одной фазы в другую (раствор, растворенное состояние). Происходит в результате взаимодействия атомов (молекул) растворителя и растворённого вещества и сопровождается увеличением энтропии. При растворении межфазная граница исчезает, при этом многие физические свойства раствора (например, плотность, вязкость, иногда — цвет, и другие) меняются.
В случае химического взаимодействия растворителя и растворенного вещества сильно меняются и химические свойства — например, при растворении газа хлороводорода в воде образуется жидкая соляная кислота.






























