По размеру частиц растворенного вещества
Наиболее общий принцип классификации. В данном случае выделяют два типа систем: истинные и коллоидные.
В первом случае растворенное вещество находится в виде отдельных атомов и молекул. Размеры этих частиц настолько малы, что их невозможно различить визуально или при помощи оптического микроскопа. Истинными являются, например, водные растворы поваренной соли, сахара или уксусной кислоты. Основным их отличительным признаком является отсутствие помутнений.
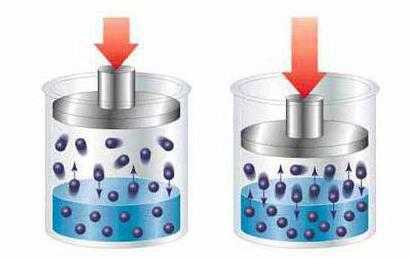
В коллоидных системах растворенное вещество содержится в виде агрегатов достаточно большого размера (от 1 до 1000 нм), которые заметны невооруженным взглядом. Свет, проходящий сквозь такой раствор, конусообразно рассеивается. Это явление получило название эффекта Тиндаля.
Классификация растворов по различным критериям
На сегодняшний день не существует единой системы классификации решений, однако условно типы решений можно сгруппировать по наиболее значимым критериям, а именно:
I) По агрегатному состоянию различают твердые, газообразные и жидкие растворы.
II) От размера частиц растворенного вещества: коллоидные и истинные.
III) По степени концентрации растворенных частиц в растворе: насыщенный, ненасыщенный, концентрированный, разбавленный.
IV) По способности проводить электрический ток: электролиты и неэлектролиты.
V) По назначению и сфере применения: химические, медицинские, строительные, специальные растворы и др.
Группы растворов по назначению
Решения незаменимы во всех отраслях народного хозяйства, специфика которых создала такие виды специальных решений, как медицинское, строительное, химическое и другие.
Лечебные растворы — это комбинации лекарственных препаратов в виде мазей, суспензий, смесей, растворов для инфузий и инъекций и других лекарственных форм, используемых в медицинских целях для лечения и профилактики различных заболеваний.
Типы химических растворов включают огромное количество разнообразных гомогенных соединений, используемых в химических реакциях: кислоты, соли. Эти растворы могут быть органическими или неорганическими, водными (морская вода) или безводными (на основе бензола, ацетона и т.д.), Жидкими (водка) или твердыми (латунь). Они нашли свое применение в самых разных отраслях народного хозяйства: химической, пищевой, текстильной промышленности.
Виды растворов отличаются вязкой и густой консистенцией, поэтому название смеси им больше подходит.
 Благодаря способности быстро затвердевать, они успешно используются в качестве крепежного материала при кладке стен, потолков, несущих конструкций и при отделочных работах. Это водные растворы, чаще всего трехкомпонентные (растворитель, цемент различной маркировки, заполнитель), в которых в качестве наполнителя используются песок, глина, щебень, известь, гипс и другие строительные материалы.
Благодаря способности быстро затвердевать, они успешно используются в качестве крепежного материала при кладке стен, потолков, несущих конструкций и при отделочных работах. Это водные растворы, чаще всего трехкомпонентные (растворитель, цемент различной маркировки, заполнитель), в которых в качестве наполнителя используются песок, глина, щебень, известь, гипс и другие строительные материалы.
Классификация по степени насыщенности
Довольно распространен другой принцип разделения растворов на виды. Так, в зависимости от концентрации раствора, можно выделить два типа: разбавленные и концентрированные. Однако граница между ними весьма условна.
Разбавленный раствор характеризуется низким содержанием растворенного вещества. При этом его нельзя отождествлять с ненасыщенным.
Например, раствор, содержащий всего лишь 0,0000134 моль/л хлорида серебра, является разбавленным, так как концентрация растворенного вещества в нем очень мала. Однако при обычных условиях растворить большее количество соединения в нем невозможно, а потому такой раствор одновременно будет насыщенным.
Классификация истинных растворов
Примерами истинных являются водные растворы соли, соды, сахара, уксусной кислоты и т. д. Их принято классифицировать в зависимости от концентрации растворенного вещества. По этому признаку выделяют три вида растворов в химии.
Если при данных условиях (температуре, давлении) можно растворить большее количество вещества, чем уже содержится в растворе, он называется ненасыщенным.
Насыщенный раствор содержит максимально возможное в условиях проведения эксперимента количество растворенного вещества.
Если же в растворе содержится больше вещества, чем в насыщенном, такая система называется пересыщенной. Получить ее можно при очень медленном и аккуратном охлаждении насыщенного раствора, приготовленного при более высокой температуре.
Пересыщенные растворы крайне неустойчивы. При нарушении равновесия моментально начинается процесс кристаллизации избыточно содержащегося растворенного вещества. Инициировать выпадение осадка может добавление маленького кристалла вещества, попадание инородного тела (например, пыли) или встряхивание раствора.
Виды растворов по агрегатному состоянию
Классификация растворов по агрегатному состоянию растворителя дана в широком смысле значения этого термина. Принято рассматривать жидкие вещества как растворы (причем как жидкий элемент, так и твердый элемент могут выступать в качестве растворенного вещества), однако, если учесть, что раствор представляет собой гомогенную систему из двух или более веществ, то это Вполне логично признать также твердые и газообразные растворы. Твердые растворы считаются смесями, например, различных металлов, более известных в повседневной жизни как сплавы. Типы газообразных растворов — это смеси разных газов, например, окружающий нас воздух, который выглядит как комбинация кислорода, азота и углекислого газа.
См. также
Wikimedia Foundation . 2010 .
Смотреть что такое «Истинные растворы» в других словарях:
Растворы — Растворение соли в воде Раствор гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из которых называется растворителем, а другой растворимым веществом, это также система переменного состава, находящаяся в состоянии… … Википедия
Растворы (химич.) — Растворение соли в воде Раствор гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из которых называется растворителем, а другой растворимым веществом, это также система переменного состава, находящаяся в состоянии… … Википедия
РАСТВОРЫ — однофазные системы, состоящие из двух или более компонентов. По своему агрегатному состоянию растворы могут быть твердыми, жидкими или газообразными. Так, воздух это газообразный раствор, гомогенная смесь газов; водка жидкий раствор, смесь… … Энциклопедия Кольера
РАСТВОРЫ — (Solutiones), однородные системы переменного состава, состоящие не менее чем из двух веществ, из которых одно (растворённое вещество) распределено в другом (растворителе). Р. подразделяют на истинные и коллоидные. Важнейшей характеристикой Р.… … Ветеринарный энциклопедический словарь
Раство́ры — истинные растворы однородные (гомогенные, или однофазные) системы переменного состава, состоящие из двух или более компонентов. Известны газообразные, жидкие и твердые растворы. К газообразным Р. относятся смеси любых газов и паров, к твердым… … Медицинская энциклопедия
Раствор — У этого термина существуют и другие значения, см. Раствор (значения). Растворение поваренной соли (NaCl) в воде Раствор гомогенная ( … Википедия
Коллоидный раствор — Растворение соли в воде Раствор гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из которых называется растворителем, а другой растворимым веществом, это также система переменного состава, находящаяся в состоянии… … Википедия
Растворение — соли в воде Раствор гомогенная (однородная) смесь, образованная не менее чем двумя компонентами, один из которых называется растворителем, а другой растворимым веществом, это также система переменного состава, находящаяся в состоянии химического… … Википедия
Химия — У этого термина существуют и другие значения, см. Химия (значения). Химия (от араб. کيمياء, произошедшего, предположительно, от египетского слова km.t (чёрный), откуда возникло также название Египта, чернозёма и свинца «черная… … Википедия
Каргин Валентин Алексеевич — (1907 1969), физикохимик, основатель отечественной научной школы, академик АН СССР (1953), Герой Социалистического Труда (1966). Установил, что полимеры образуют истинные растворы. Исследования механических и термомеханических свойств полимеров,… … Энциклопедический словарь
Растворы, также как и процесс их образования, имеют огромное значение в окружающем нас мире. Вода и воздух — это два их представителя, без которых невозможна жизнь на Земле. Большинство биологических жидкостей в растениях и животных также являются растворами. Процесс переваривания пищи неразрывно связан с растворением питательных веществ.
Любые производства связаны с использованием тех или иных видов растворов. Они применяются в текстильной, пищевой, фармацевтической промышленностях, металлообработке, при добыче полезных ископаемых, получении пластмасс и волокон
Именно поэтому важно понимать, что они собой представляют, знать их свойства и отличительные признаки
По физическим свойствам
Довольно часто вещества и их растворы классифицируют по способности проводить электрический ток. Ею обладают растворы веществ с ионной связью в молекулах. Под действием молекул воды эти соединения способны подвергаться электролитической диссоциации на ионы. Такие вещества и их растворы получили название электролитов. Примеры электролитов: растворы хлорида натрия, серной кислоты, бромида калия.
Органические вещества, как правило, находятся в растворе в виде нейтральных молекул или же малодиссоциированы. Такие системы не способны проводить ток и называются неэлектролитами.
Таким образом, классификация растворов обширна и разнообразна. Тип ее выбирается в зависимости от конкретных целей.
Теории растворов и механизм растворения
Известны две основные теории Р. Физическая теория, разработанная в последней четверти 19 в. Я. Вант-Гоффом и С. Аррениусом, рассматривает растворитель как химически индифферентную среду, в к-рой равномерно распределены частицы (молекулы, ионы) растворенного вещества. При этом предполагается отсутствие межмолекулярного взаимодействия как между самими частицами растворенного вещества, так и между ними и молекулами растворителя. С позиций физической теории удалось объяснить ряд свойств разбавленных Р.— понижение давления пара (см. Рауля закон), понижение температуры замерзания (см. Криометрия), повышение температуры кипения (см. Эбуллиометрия) и такое явление, как осмотическое давление (см.) Р. Эти свойства, называемые коллигативными, или осмотическими, свойствами Р., зависят только от концентрации частиц растворенного вещества, но не от их природы. Однако физическая теория оказалась несостоятельной при объяснении ряда свойств Р., особенно свойств концентрированных Р.
Химическая, или сольватная, теория Р. предложена Д. И. Менделеевым в 1887 г. Согласно этой теории, между частицами растворенного вещества и молекулами растворителя происходит взаимодействие, в результате к-рого образуются нестойкие соединения переменного состава, называемые сольватами или гидратами — в тех случаях, когда растворителем является вода (см.). Главную роль в образовании сольватов играют не валентные связи, а менее прочные межмолекулярные силы и водородные связи (см. Молекула). Сольватная теория дала возможность объяснить изменение ряда свойств Р. (плотности, вязкости, удельной теплоемкости и др.) с изменением их концентрации, тепловые эффекты, наблюдаемые при растворении, и др. Необходимо отметить, что физическая и химическая теории Р. не исключают, а дополняют друг друга.
Механизм растворения в общих чертах состоит в следующем. При внесении в растворитель (напр., воду) растворяемого вещества его молекулы или ионы подвергаются гидратации (см.), отрываются от растворяемого вещества и вследствие диффузии равномерно распределяются по всему объему Р. Одновременно с растворением протекает и обратный процесс — выделение молекул или ионов из Р. и переход их в состав еще не растворившегося вещества. Скорость выделения растворенного вещества, пропорциональная его концентрации в Р., в начале процесса равна нулю, но по мере растворения вещества непрерывно возрастает. По истечении нек-рого времени скорости двух противоположно направленных процессов становятся равными друг другу. С этого момента между избытком нерастворившегося вещества и Р. устанавливается динамическое равновесие, при к-ром при неизменных внешних условиях концентрация Р., называемого в данном случае насыщенным, и количество нерастворившегося вещества остаются постоянными.
Процесс растворения сопровождается выделением или поглощением теплоты. Этот эффект растворения складывается из теплоты, необходимой для отрыва молекул или ионов от растворяемого вещества и равномерного распределения их по всему объему Р., и из теплоты гидратации (сольватации) частиц растворяемого вещества. Поскольку первый из этих процессов происходит с поглощением, а второй с выделением теплоты, тепловой эффект растворения может быть как положительным (выделение теплоты), так и отрицательным (поглощение теплоты).
Поведение веществ в растворе
Растворение — это физико-химический процесс. Он сочетает в себе физический процесс (дробление до молекул) и химическое воздействие компонентов (образование в воде непрочных соединений — гидратов). В процессе растворения молекулы воды разрушают кристаллы растворяемого вещества. Это разрушение происходит в месте соприкосновения кристалла с водой. Чем больше площадь поверхности соприкосновения, тем быстрее разрушаются кристаллы. В результате диффузии происходит самопроизвольное распределение частиц одного вещества между частицами другого, что приводит к образованию раствора. Для улучшения контакта вещества с растворителем увеличивают площадь поверхности соприкосновения, вещества измельчают и раствор перемешивают.
В результате химического взаимодействия вещества с водой образуются соединения — гидраты. О химическом взаимодействии говорят такие признаки химических реакций, как тепловые явления при растворении: растворение H 2 SO 4 сопровождается выделением тепла, растворение NaCl, NH 4 NO 3 — охлаждением. Косвенным доказательством гидратации является существование твердых кристаллогидратов — солей, в состав которых входят вода, например медный купорос CuSO 4 х 5Н 2 O.
Виды концентрации растворов
В одно и то же количество растворителя можно добавить разное количество растворяемого элемента, на выходе у нас будут растворы с разной концентрацией. Перечислим основные из них:
- Насыщенные растворы характеризуются степенью растворимости вещества, при которой растворенный компонент под действием постоянного значения температуры и давления больше не распадается на атомы и молекулы, и раствор достигает фазового равновесия. Насыщенные растворы также можно условно разделить на концентрированные растворы, в которых массовая доля растворенного компонента сравнима с растворителем, и на разбавленные, где растворенное вещество в несколько раз меньше растворителя.
- Ненасыщенными считаются те растворы, в которых растворенное вещество еще может распадаться на мелкие частицы.
- Перенасыщенные растворы получаются при изменении параметров влияющих факторов (температура, давление), в результате чего продолжается процесс «дробления» растворенного вещества, его становится больше, чем было в норме (норм.
6.1. Классификация растворов window.top.document.title = «6.1. Классификация растворов»;
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов).
По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми. Обычно компонент, который в данных условиях находится в том же агрегатном состоянии, что и образующийся раствор, считают растворителем, остальные составляющие раствора – растворенными веществами. В случае одинакового агрегатного состояния компонентов растворителем считают тот компонент, который преобладает в растворе.
В зависимости от размеров частиц растворы делятся на истинные и коллоидные. В истинных растворах (часто называемых просто растворами) растворенное вещество диспергировано до атомного или молекулярного уровня, частицы растворенного вещества не видимы ни визуально, ни под микроскопом, свободно передвигаются в среде растворителя. Истинные растворы – термодинамически устойчивые системы, неограниченно стабильные во времени.
 |
|
Модель 6.1. Растворение хлорида натрия |
Движущими силами образования растворов являются энтропийный и энтальпийный факторы. При растворении газов в жидкости энтропия всегда уменьшается ΔS < 0, а при растворении кристаллов возрастает (ΔS > 0). Чем сильнее взаимодействие растворенного вещества и растворителя, тем больше роль энтальпийного фактора в образовании растворов. Знак изменения энтальпии растворения определяется знаком суммы всех тепловых эффектов процессов, сопровождающих растворение, из которых основной вклад вносят разрушение кристаллической решетки на свободные ионы (ΔH > 0) и взаимодействие образовавшихся ионов с молекулами растворителя (сольтивация, ΔH < 0). При этом независимо от знака энтальпии при растворении (абсолютно нерастворимых веществ нет) всегда ΔG = ΔH – T·ΔS < 0, т. к. переход вещества в раствор сопровождается значительным возрастанием энтропии вследствие стремления системы к разупорядочиванию. Для жидких растворов (расплавов) процесс растворения идет самопроизвольно (ΔG < 0) до установления динамического равновесия между раствором и твердой фазой.
Концентрация насыщенного раствора определяется растворимостью вещества при данной температуре. Растворы с меньшей концентрацией называются ненасыщенными.
Растворимость для различных веществ колеблется в значительных пределах и зависит от их природы, взаимодействия частиц растворенного вещества между собой и с молекулами растворителя, а также от внешних условий (давления, температуры и т. д.)
В химической практике наиболее важны растворы, приготовленные на основе жидкого растворителя. Именно жидкие смеси в химии называют просто растворами. Наиболее широко применяемым неорганическим растворителем является вода. Растворы с другими растворителями называются неводными.
Растворы имеют чрезвычайно большое практическое значение, в них протекают многие химические реакции, в том числе и лежащие в основе обмена веществ в живых организмах.
Рекомендуемые материалы
Рис. 5.1. Молекулы сахара (белые кружочки), находящиеся на поверхности кристалла сахара, окружены молекулами воды (темные кружочки). Между молекулами сахара и воды возникают водородные связи, благодаря которым молекулы сахара отрываются от поверхности кристалла. Молекулы воды, не связанные с молекулами сахара, на рисунке не показаны.
Молекулы сахара, перешедшие из кристалла в раствор, могут передвигаться по всему объему раствора вместе с молекулами воды благодаря тепловому движению. Это явление называется диффузией. Диффузия происходит медленно, поэтому около поверхности кристаллов находится избыток уже оторванных от кристалла, но еще не диффундировавших в раствор молекул сахара. Они мешают новым молекулам воды подойти к поверхности кристалла, чтобы связаться с его молекулами водородными связями. Если раствор перемешивать, то диффузия происходит интенсивнее и растворение сахара идет быстрее. Молекулы сахара распределяются равномерно и раствор становится одинаково сладким по всему объему.
Количество молекул, способных перейти в раствор, часто ограничено. Молекулы вещества не только покидают кристалл, но и вновь присоединяются к кристаллу из раствора. Пока кристаллов относительно немного, больше молекул переходит в раствор, чем возвращается из него – идет растворение. Но если растворитель находится в контакте с большим количеством кристаллов, то число уходящих и возвращающихся молекул становится одинаковым и для внешнего наблюдателя растворение прекращается.
Растворы делятся на ненасыщенные, насыщенные и перенасыщенные.
Ещё посмотрите лекцию «Функционирование ЛВС» по этой теме.
Насыщенным раствором называется раствор, находящийся в динамическом равновесии с твердым растворяемым веществом. Под динамическим равновесием понимают то, что уравниваются скорости двух процессов: перехода растворяемого вещества в раствор и выпадения его из раствора. Иными словами, насыщенный раствор характеризуется строго определенным содержанием растворенного вещества в фиксированном количестве растворителя при данной температуре.
Например, если поместить 50 г NaCl в 100 г H2O, то при 20ºC растворится только 36 г соли. Ненасыщенный раствор — раствор, содержащий меньше вещества, чем в насыщенном растворе.
Поместив в 100 г воды при 20ºC меньше 36 г NaCl, мы получим ненасыщенный раствор. Перенасыщенный раствор — раствор, содержащий больше растворенного вещества, чем насыщенный.
Такой раствор находится в метастабильном (неустойчивом) равновесии. О его неустойчивости говорит то, что при любом физическом воздействии на него, например, встряхивании или образовании в растворе центра кристаллизации путем внесения кристалла, избыток растворенного вещества мгновенно выпадает в осадок: происходит кристаллизация вещества из пересыщенного раствора.
При нагревании смеси соли с водой до 100 0 C произойдёт растворение 39,8 г NaCl в 100 г воды
Если теперь удалить из раствора нерастворившуюся соль, а раствор осторожно охладить до 20ºC, избыточное количество соли не всегда выпадает в осадок. В этом случае мы имеем дело с перенасыщенным раствором
Помешивание, встряхивание, добавление крупинок соли может вызвать кристаллизацию избытка соли и переход в насыщенное устойчивое состояние.
В зависимости от содержания растворенного вещества растворы также разделяются на концентрированные и разбавленные. Эти понятия не надо путать с понятиями насыщенных и ненасыщенных растворов. Раствор может быть насыщенным, но в то же время и разбавленным. Примером этого могут служить растворы всех труднорастворимых солей. Например, раствор сульфата бария, полученный сливанием растворов хлорида бария и сульфата натрия. И наоборот, концентрированный раствор необязательно будет насыщенным. Примером такого раствора является 90%-ный раствор серной кислоты.
-
Вирусы возбудители инфекционных заболеваний понятие об онковирусах кратко
-
Историческое развитие института прав человека и гражданина кратко
-
Куприн система краткое содержание
-
Проводящая ткань строение и функции кратко
- Политическая жизнь в современном обществе кратко
Растворы по размеру растворённых частиц
Типы растворенных растворов включают истинные (обычные) растворы и коллоидные системы. В истинных растворах растворенное вещество распадается на небольшие молекулы или атомы, близкие по размеру к молекулам растворителя. При этом настоящие типы растворов сохраняют исходные свойства растворителя, лишь незначительно его трансформируя под влиянием физико-химических свойств добавляемого в него элемента. Например: когда поваренная соль или сахар растворяются в воде, вода остается в том же агрегатном состоянии и той же консистенции, практически того же цвета, меняется только вкус.

Коллоидные растворы отличаются от обычных тем, что добавленный компонент не полностью разлагается, сохраняя сложные молекулы и соединения, размеры которых намного больше, чем у частиц растворителя, превышающие значение в 1 нанометр.
Массовая доля вещества. Концентрация растворов
ω(Х) = m(Х)• 100%/ m р-ра (в процентах)
Концентрация (С) — это содержание растворенного вещества в единице массы или объема.
Процентная концентрация раствора — это отношение массы растворенного вещества m (в граммах) к массе раствора (в граммах).
Молярная концентрация — это отношение количества растворенного вещества n (в молях) к объему раствора V (в литрах). Ее обозначают буквой С.
Найди готовую курсовую работу выполненное домашнее задание решённую задачу готовую лабораторную работу написанный реферат подготовленный доклад готовую ВКР готовую диссертацию готовую НИР готовый отчёт по практике готовые ответы полные лекции полные семинары заполненную рабочую тетрадь подготовленную презентацию переведённый текст написанное изложение написанное сочинение готовую статью
Сделан в Word, графики в электронном виде с ссылками. Курсовая работа. Вариант 33. Гидравлический расчет гидросистемы стенда для испытания центробежных насосов.
Глава 5. РАСТВОРЫ.
5.1. Общая характеристика и классификация растворов.
Если в сосуд с водой поместить кристаллы поваренной соли, сахара или перманганата калия (марганцовки), то мы можем наблюдать, как количество твердого вещества постепенно уменьшается. При этом вода, в которую были добавлены кристаллы, приобретает новые свойства: у нее появляется соленый или сладкий вкус (в случае марганцовки появляется малиновая окраска), изменяется плотность, температура замерзания и т.д. Полученные жидкости уже нельзя назвать водой, даже если они неотличимы от воды по внешнему виду (как в случае с солью и сахаром). Это – растворы.
Раствор — однородная многокомпонентная система, состоящая из растворителя, растворённых веществ и продуктов их взаимодействия.
Растворы не отстаиваются и сохранятся все время однородными. Если раствор профильтровать через самый плотный фильтр, то ни соль, ни сахар, ни марганцевокислый калий не удается отделить от воды. Следовательно, эти вещества в воде раздроблены до наиболее мелких частиц – молекул. Молекулы могут опять собраться в кристаллы только тогда, когда мы выпарим воду. Таким образом, растворы – это молекулярные смеси. По агрегатному состоянию растворы могут быть жидкими (морская вода), газообразными (воздух) или твёрдыми (многие сплавы металлов). Размеры частиц в истинных растворах — менее 10 -9 м (порядка размеров молекул).
Любой раствор состоит из растворителя и растворенного вещества. В приведенных примерах растворителем является вода. Но не всегда обязательно вода является растворителем. Например, можно получить раствор воды в серной кислоте. Здесь растворителем будет кислота. Можно приготовить и растворы кислоты в воде.
Из двух или нескольких компонентов раствора растворителем является тот, который взят в большем количестве и имеет то же агрегатное состояние, что и раствор в целом.
Рассмотрим, как происходит растворение веществ. Для этого понаблюдаем, как растворяется добавленный в чай сахар. Если чай холодный, то сахар растворяется медленно. Наоборот, если чай горячий и размешивается ложечкой, то растворение происходит быстро.
Попадая в воду, молекулы сахара, находящиеся на поверхности кристаллов сахарного песка, образуют с молекулами воды донорно-акцепторные (водородные) связи. При этом с одной молекулой сахара связывается несколько молекул воды. Тепловое движение молекул воды заставляет связанные с ними молекулы сахара отрываться от кристалла и переходить в толщу молекул растворителя (рис. 5.1).
Классификация коллоидных систем
В свою очередь, коллоидные системы принято разделять на типы в зависимости от агрегатного состояния растворителя и растворенного вещества. В таблице ниже приведена их классификация. Агрегатное состояние растворителя указано по вертикали, а растворенного вещества — по горизонтали.
Дым представляет собой раствор твердых частиц углерода в воздухе.
При смешивании воды с маслом образуется еще один вид дисперсных систем — эмульсии. Как правило, они достаточно быстро расслаиваются. При необходимости в эмульсии добавляются специальные вещества-стабилизаторы.
Еще один довольно необычный пример раствора — морская пена. Причем ее можно рассматривать с двух точек зрения: как раствор воздуха в воде (на этом основано пенообразование как таковое) и как истинный водный раствор минеральных солей.






























