Химические свойства аминокислот
Реакционные центры аминокислот
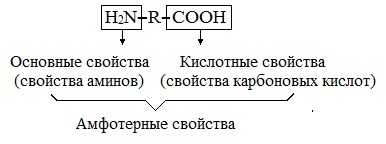
В составе аминокислоты есть несколько реакционных центров: аминогруппа, отвечающая за основные свойства; карбоксильная группа, отвечающая за кислотные свойства. Исходя из вышесказанного мы делаем вывод, что аминокислоты являются амфотерными соединениями.
Углеродный скелет тоже относится к реакционным центрам и в зависимости от кратности связей углерод-углерод может отвечать определенным химическим свойствам:
а) если все связи углеродного скелета одинарные, то он может взаимодействовать с галогенами –реакции замещения;
б) если углеродный скелет содержит двойные или тройные связи, то могут происходить реакции присоединения ( можно присоединять: водород, воду, галогены, галогеноводороды);
Подробнее химические свойства каждого реакционного центра представлены в таблице:
| Аминогруппа | Карбоксильная группа | Предельная углеродная цепь | Непредельная углеродная цепь |
| Основные свойства | Кислотные свойства | Реакции замещения | Реакции присоединения |
| +Кислота | +Me(до Н2)=соль+Н2 | +Галогены | +H2 |
| +MeO=соль+Н2О | +H2O | ||
| +MeOH=соль+Н2О | +Галогены | ||
| +Соль=кислота`+соль ` | +Галогеноводороды | ||
| +Спирт=сложный эфир+Н2О |
а) Взаимодействие с кислотами: происходят реакции присоединения, например, при реакции глицина с соляной кислотой образуется хлорид карбоксиметиламмония (хлорид глициния)
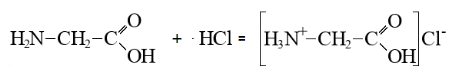
б) Взаимодействие со спиртами: образование сложного эфира и воды
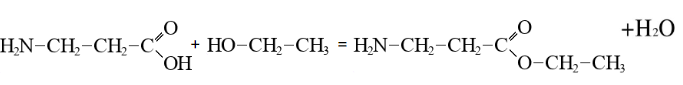
в) Взаимодействие с нитритом натрия в кислой среде: реакция идет с образованием молочной кислоты
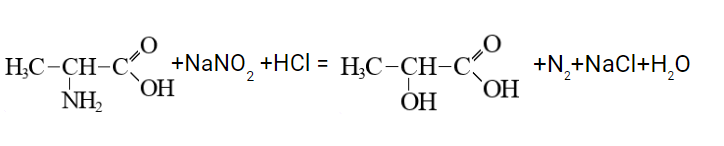
г) Аминокислоты также взаимодействуют между собой с образованием пептидной связи

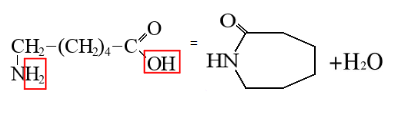
Таким образом получают такие соединения, как белки (пептиды). К такому типу относится известная реакция образования капрона. Для производства капрона используют производные аминокислот, а именно капролактам, который образуется за счет внутримолекулярной дегидратации 6-аминогексановой кислоты.
Что такое белки?
Белки- это органические соединения, состоящие из аминокислот, связанных между собой пептидной связью
Пептидная связь
Презентация на тему: » КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АМИНОКИСЛОТЫ И БЕЛКИ. Белки Белки – это высокомолекулярные органические соединения, состоящие из остатков аминокислот, которые.» — Транскрипт:
1
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АМИНОКИСЛОТЫ И БЕЛКИ

2
Белки Белки – это высокомолекулярные органические соединения, состоящие из остатков аминокислот, которые связаны друг с другом при помощи пептидных связей. В состав белков входят 18–20 различных аминокислот. Одни из них организм может синтезировать самостоятельно – это заменимые аминокислоты. Другие, незаменимые, в организме синтезироваться не могут и должны по- ступать с пищей.

3
Для обнаружения белка применяют цветные реакции Для обнаружения белка применяют цветные реакции. Универсальные Специфические
4
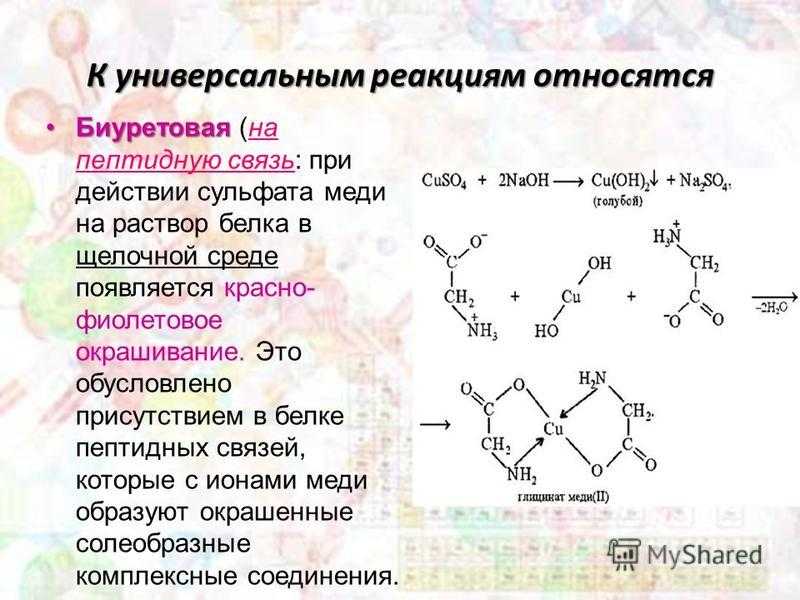
К универсальным реакциям относятся Биуретовая Биуретовая (на пептидную связь: при действии сульфата меди на раствор белка в щелочной среде появляется красно- фиолетовое окрашивание. Это обусловлено присутствием в белке пептидных связей, которые с ионами меди образуют окрашенные солеобразные комплексные соединения.
5
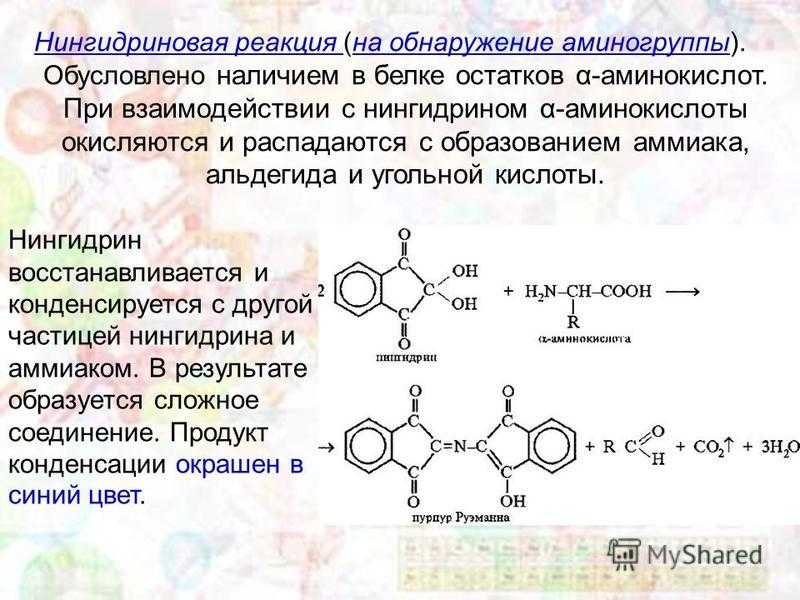
Нингидриновая реакция (на обнаружение аминогруппы). Обусловлено наличием в белке остатков α-аминокислот. При взаимодействии с нингидрином α-аминокислоты окисляются и распадаются с образованием аммиака, альдегида и угольной кислоты. Нингидрин восстанавливается и конденсируется с другой частицей нингидрина и аммиаком. В результате образуется сложное соединение. Продукт конденсации окрашен в синий цвет.
6
специфическим К специфическим относятся реакции на отдельные аминокислоты. Это реакции на функциональные группы радикалов аминокислот, входящих в состав белков. При их помощи можно открыть только тот белок, в состав которого они входят. Диазореакция на гистидин и тирозин (реакция Паули) Реакция Фоля на серосодержащие аминокислоты Нитропруссидная реакция на серосодержащие аминокислоты Реакция Сакагучи (выявление аргинина Реакция Сакагучи (выявление аргинина ) Ксантопротеиновая реакция на ароматические аминокислоты

7
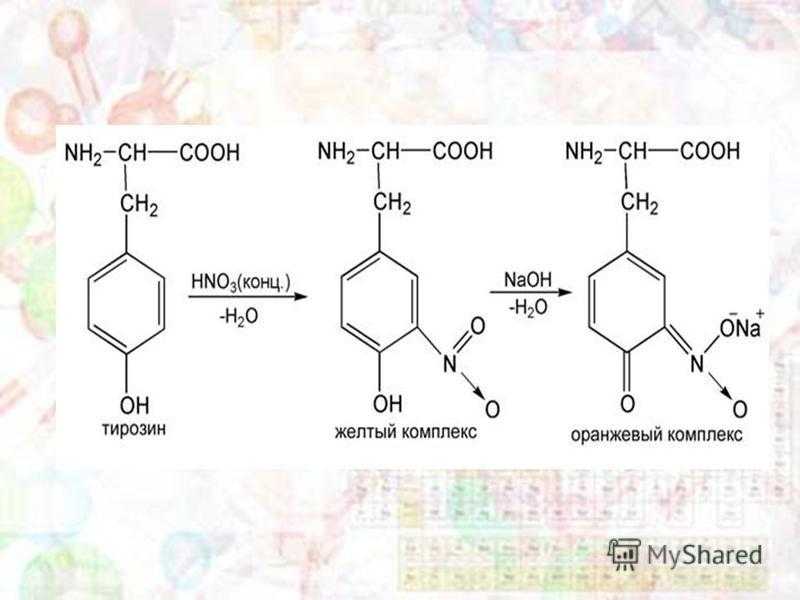
Ксантопротеиновая реакция – на ароматические радикалы желтого цвета оранжевый цвет Обусловлена присутствием в белке ароматических аминокислот — фенилаланина, тирозина (поиск фенилаланина) и триптофана (индолилаланина), которые при взаимодействии с концентрированной азотной кислотой образуют нитропроизводные желтого цвета (реакция нитрования). При добавлении щелочи превращаются в соли хиноидной структуры, окрашенные в оранжевый цвет.

9
Нитропруссидная реакция на серосодержащие аминокислоты Обусловлена присутствием в белке серосодержащих аминокислот, которые при кипячении со щелочью разрушаются с образованием сернистого натрия. Нитропруссид натрия при взаимодействии с сернистым натрием превращается в красно окрашенное соединение. Na 2 S + Na 2 = Na 4

10
Реакция Фоля на серосодержащие аминокислоты Обусловлена присутствием в белке серосодержащих аминокислот цистина, цистеина. (CH 3 COO) 2 Pb + Na 2 S PbS + 2CH 3 COONa (черный осадок)
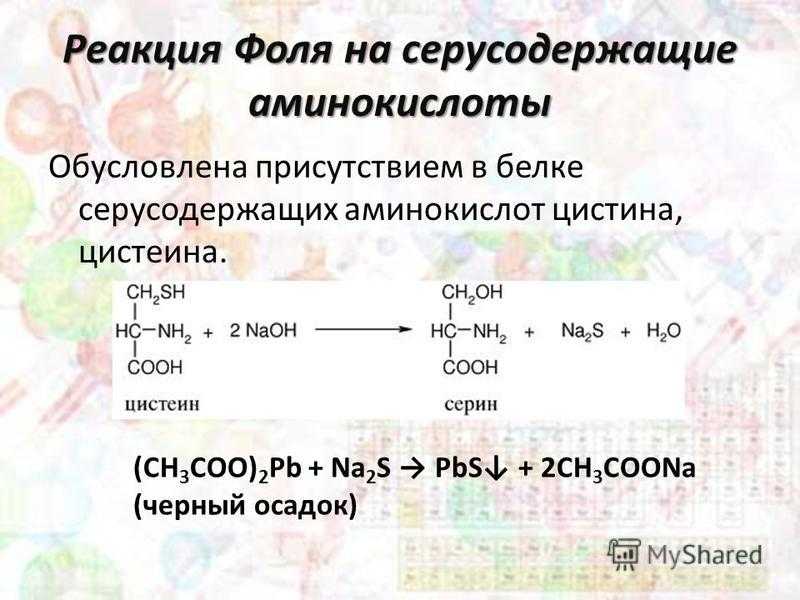
11
Реакция Сакагучи (выявление аргинина) красного цвета. Обусловлена окислением гуанидиновой группы аргинина гипобромитом, окисленный аргинин -нафтолом образует продукт конденсации при взаимодействии с красного цвета.
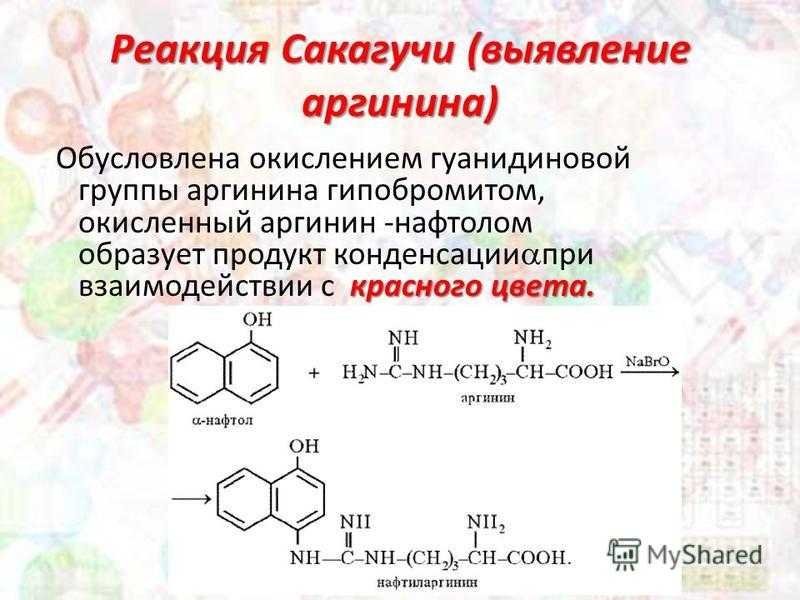
12
Диазореакция на гистидин и тирозин (реакция Паули) красного цвета Обусловлена присутствием в белке аминокислот гистидина (имидазолилаланина) и тирозина (либо одной из них), которые, реагируя с диазобензолсульфокислотой, образуют азокраситель красного цвета.
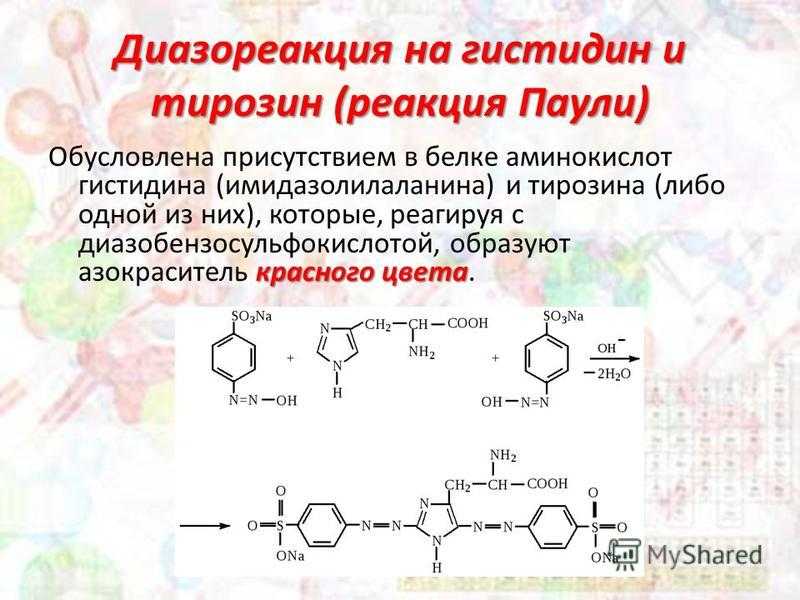
Химические свойства аминокислот
Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
Кислотно-основное равновесие в водных растворах
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
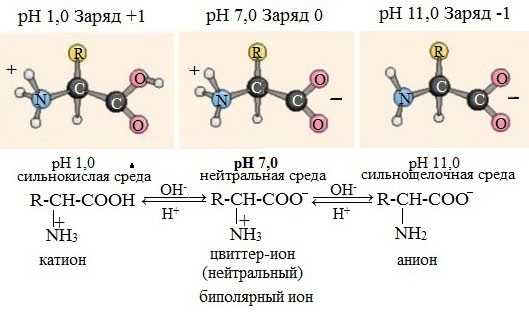
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
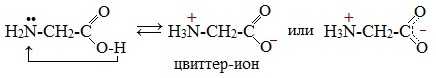
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
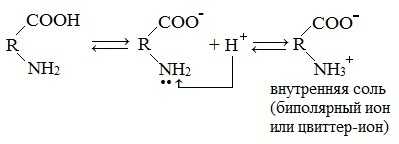
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
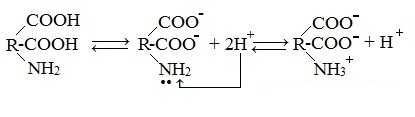
Водные растворы моноаминодикарбоновых кислот имеют рН<7 (кислая среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток ионов водорода Н+.
в) диаминомонокарбоновые кислоты (основные аминокислоты)
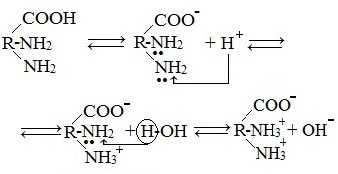
Водные растворы диаминомонокарбоновых кислот имеют рН>7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН— .
2. Взаимодействие с основаниями и кислотами
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
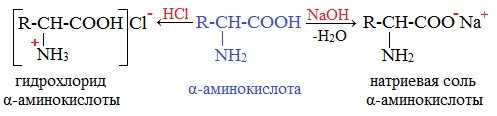
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
Образуются соли:
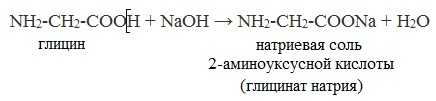
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
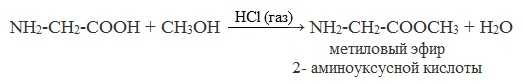
в) взаимодействие с аммиаком
Образуются амиды:
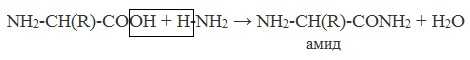
Как основание (участвует аминогруппа)
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
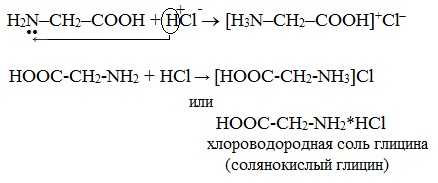
б) взаимодействие с азотистой кислотой (р. дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
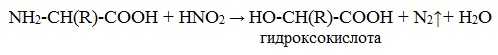
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
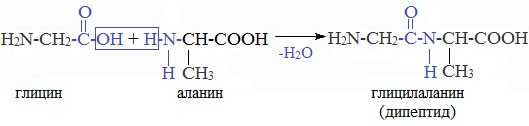
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е представляют собой продукт поликонденсации a-аминокислот.
5. Качественные реакции!
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Видеоопыт «Образование медной соли аминоуксусной кислоты»
Рубрики: Аминокислоты Теги: Аминокислоты
Свойства белков
Как мы уже убедились, возможно существование огромного множества различных белков. В зависимости от строения аминокислотных остатков и их последовательности в полипептидной цепи свойства белков могут существенно различаться. Например, белок куриного яйца альбумин растворяется в воде, в то же время белки кератины, входящие в состав волос и ногтей, нерастворимы в воде. Рассмотрим некоторые химические свойства белков.
1. Гидролиз
Белки подвергаются гидролизу. При этом происходит постепенное расщепление молекулы белка. Сначала образуются продукты частичного расщепления — пептиды, имеющие молекулярную массу меньшую, чем у исходного белка. Конечными продуктами гидролиза являются α-аминокислоты, из которых построена молекула белка. Рассмотрим реакцию гидролиза на примере трипептида, состоящего из остатков фенилаланина, аланина и глицина:
При гидролизе происходит разрыв пептидных связей в молекуле белка. В качестве катализаторов реакции гидролиза белка можно использовать кислоты или щёлочи. В живых организмах гидролиз белков катализируют ферменты.
2. Денатурация
Под действием различных факторов (нагревание, действие кислот, щелочей и др.) может произойти нарушение пространственной структуры молекулы белка (рис. 48.2). Такой процесс называется денатурацией. Например, денатурация белка происходит при варке яиц. В результате денатурации белок утрачивает присущие ему биохимические свойства.
3. Биуретовая реакция (качественная реакция на белки)
Видео 48.1. Цветные реакции белков
Биуретовая реакция является качественной реакцией на белки. Если к водному раствору белка, содержащему немного щёлочи, добавить раствор сульфата меди(II), то образуется сложное комплексное соединение и раствор приобретает красно-фиолетовую окраску. В биуретовую реакцию вступают вещества, содержащие пептидные связи.
4. Ксантопротеиновая реакция
Ксантопротеиновая реакция позволяет обнаружить в белках остатки аминокислот, содержащих бензольное кольцо, например, фенилаланина и тирозина (табл. 48.1). При действии концентрированной азотной кислоты происходит нитрование бензольных колец молекул таких аминокислот:
В результате реакции атомы водорода в бензольных кольцах фенилаланина и тирозина замещаются на нитрогруппы —NO2, и появляется жёлтая окраска.
В белках кожи содержится большое число остатков ароматических аминокислот. Поэтому при попадании азотной кислоты на кожу на ней появляются жёлтые пятна.
Белки в живом организме выполняют множество функций. Из белков состоят ткани органов. Катализаторами и регуляторами биохимических процессов выступают ферменты и гормоны — белковые молекулы, каждый вид которых регулирует отдельный процесс. Высокая избирательность фермента обусловлена его уникальным строением.
Белок инсулин выполняет важную роль в обмене веществ — он регулирует углеводный обмен. Недостаточная выработка этого белка поджелудочной железой приводит к тяжелому заболеванию — сахарному диабету.
Белки — важнейший компонент пищи. Если основными источниками энергии для живого организма являются жиры и углеводы, белковый компонент служит в первую очередь источником аминокислот для биосинтеза белков. При этом белки пищи расщепляются на отдельные аминокислоты, из которых затем осуществляется биосинтез. В связи с этим различают заменимые и незаменимые аминокислоты. Заменимые аминокислоты могут быть синтезированы в организме человека из других компонентов пищи, незаменимые не могут быть синтезированы, поэтому обязательно должны поступать в организм с пищей. Примеры заменимых аминокислот — глицин и аланин; незаменимых — фенилаланин и цистеин (табл. 48.1).
В заключение отметим, что, осуществляя знакомство с органической химией, мы прошли путь от простейших органических веществ — углеводородов — к белкам. Дальнейшее изучение органической химии и биологии позволит приоткрыть ещё много тайн живого мира.
Номенклатура аминокислот
Необходимо придерживаться следующих правил:
1. Для систематической нумерации ведут отсчет атомов углерода, начиная с атома, связанного с карбоксильной группой (1,2,3 соответственно). В рациональной нумерации сам атом углерода, связанный с карбоксильной группой, в нумерации не участвует (α, β, γ-соответственно).
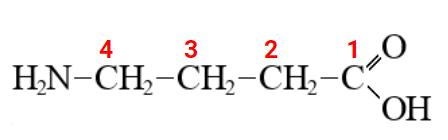 Систематическая нумерация
Систематическая нумерация
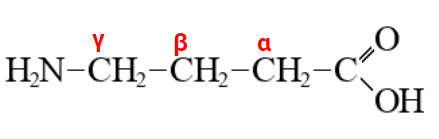 Рациональная нумерация
Рациональная нумерация
2. Приставка амино-
3. Радикалы и их местоположение
4. Корень- показывает количество атомов углерода
5. Суффиксы -ан -ен -ин — показывают кратность связей
6. -Овая кислота
Существует множество аминокислот, 20 из них участвуют в генетическом коде. Важнейшие аминокислоты имеют специальные названия и обозначения, например : Глицин-аминоуксусная кислота (GLY)
Все природные аминокислоты являются α -аминокислотами. Перечень встречающихся в природе аминокислот не ограничен лишь аминокислотами, встречающимися в белках. Многие аминокислоты были выделены из растений или найдены в организмах животных. Первой выделенной природной аминокислотой был аспарагин. Он был выделен из сока спаржи.
Качественные реакции на аминокислоты
1) Нингидриновая реакция — качественная реакция на a-аминокислоты — при взаимодействии с нингидрином происходит окислительное дезаминирование a-аминокислот с образованием продукта конденсации сине-фиолетового цвета.
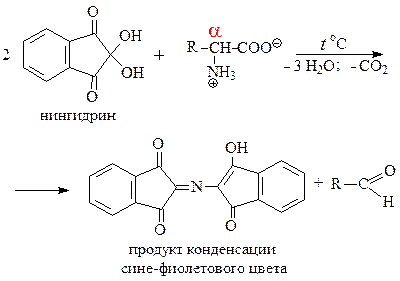
2) Ксантопротеиновая реакция — качественная реакция на ароматические и гетероциклические аминокислоты — появление желто-оранжевой окраски после добавления аммиака к продукту нитрования ароматического кольца
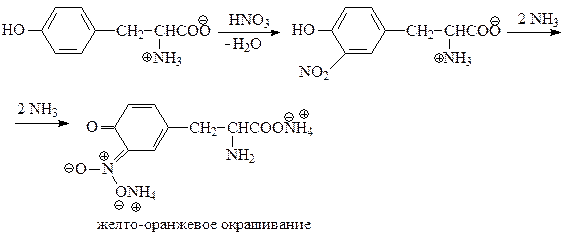
3) Реакция Фоля — качественная реакция на серосодержащие аминокислоты (цистеин, метионин) — образование черного осадка PbS при добавлении ацетата свинца к продуктам щелочного гидролиза серосодержащих аминокислот.
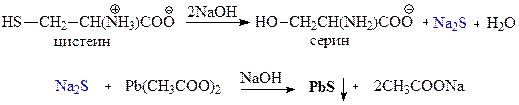
Решение
Приведем уравнения реакций 2-фенилэтанамина с HNO2; CH3COOH; С2Н5Br.
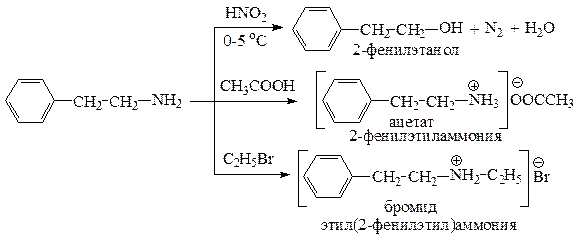
Приведем уравнения реакций α-фенилаланина с дегидрогеназой; NH3; T > Tпл.
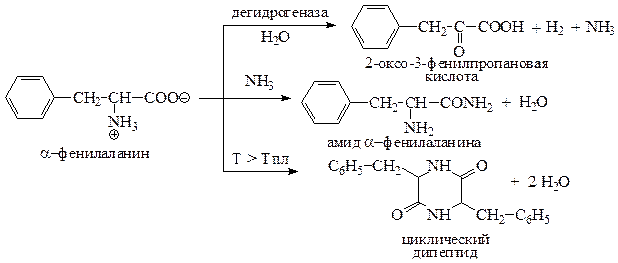
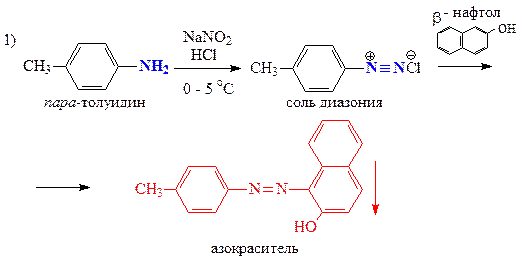
Решение
С помощью качественных проб и реакций отличите между собой три вещества пара-толуидин (А), дипропиламин (Б) и валин (В).
А — пара-толуидин — первичный ароматический амин
.
Б — пропандиамин — первичный алифатический амин
.
В — валин — алифатическая a-аминокислота
Составим план эксперимента в виде таблицы:
| Опыт | Реагент | Наблюдаемый результат и вывод | |
| Пробирка 1 | Пробирка 2 | Пробирка 3 | |
| Н2О NaNO2+HCl, 0-5 °C + β-нафтол нингидрин | Не растворяется Гомогенный раствор Красно-оранжевое окрашивание — первичная ароматическая аминогруппа Без изменений | Растворяется рН > 8 — сильное основание Выделение газа — первичная алифатическая аминогруппа — Без изменений | Растворяется рН = 5 Выделение газа — первичная алифатическая аминогруппа — Фиолетовое окрашивание — a-аминокислота |
| Общий вывод | пара-толуидин | пропандиамин | валин |
Запишем уравнения соответствующих реакций:
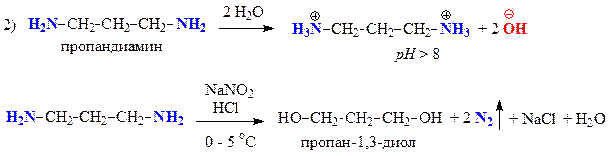
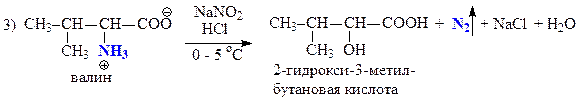
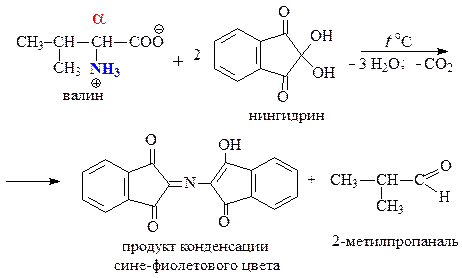
Пример решения задачи 37
Установите строение соединения с молекулярной формулой А, которое соответствует приведенному описанию
| Вариант | Молекулярная формула соединения А | Описание свойств соединения А |
| Х | С6Н15N | а) в водном растворе имеет рН > 8; б) с H2SO4 образует соль; в) алкилируется, но не ацилируется; г) с азотистой кислотой при 0-5 °С заметно не реагирует; д) может существовать в виде энантиомеров |
Сделаем выводы о строении соединения из условия задачи
| Экспериментальный факт | Выводы о строении |
| С6Н15N а) в водном растворе имеет рН > 8; б) с H2SO4 образует соль; в) алкилируется, но не ацилируется; г) с азотистой кислотой при 0-5 °С заметно не реагирует; д) может существовать в виде энантиомеров | насыщенное алифатическое азотсодержащее соединение а) сильные основные свойства — алифатический амин; б) амин; в) алкилируются все амины, но если не ацилируется, значит третичный амин; г) третичный алифатический амин; д) содержит асимметрический С-атом (хиральный центр) |
Искомое вещество является третичным алифатическим амином, содержащим хиральный центр (*):
а) в водном растворе имеет рН > 8:
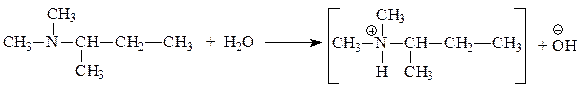
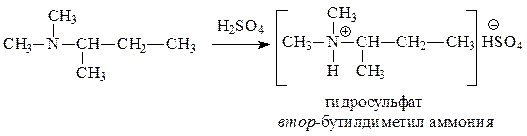
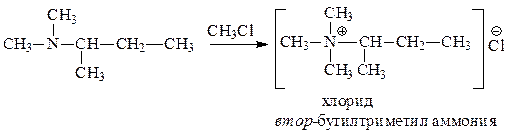
д) может существовать в виде энантиомеров:
Пример решения задачи 38
Пептиды — это природные или синтетические соединения, молекулы которых построены чаще всего из остатков α-аминокислот, соединённых в цепь пептидными (амидными) связями —C(O)NH-.
Полипептиды состоят из сотен аминокислот, олигопептиды — из небольшого числа аминокислот (от 10 до 50), и простые пептиды до 10.
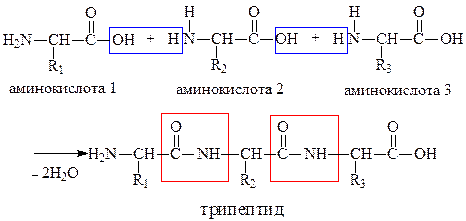
Решение
Из соответствующих аминокислот (табл. 53) постройте формулу трипептида Gly-Val-Pro. Обозначьте пептидные связи, назовите образованный трипептид.
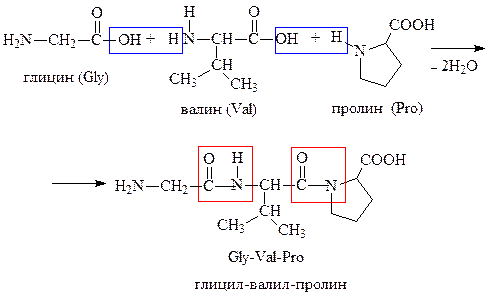
Перечислм, качественные реакции, которые могут протекать для полученного трипептида:
а) выделение газа при добавлении NaHCO3 — качественная реакция на карбоксильную группу;
б) моментальное выделение газа при добавлении HNO2 при 0-5 °С — качественная реакция на первичную алифатическую аминогруппу;
в) фиолетовое окрашивание при взаимодействии с нингидрином (нингидриновая реакция) — качественная реакция на a-аминокислоты;
г) биуретовая реакция — возникновение синей или розово-фиолетовой окраски при взаимодействии с Сu(OH)2 — качественная реакция на a-аминокислоты и пептидные связи.






























