Реакции этерификации
Общее уравнение реакции этерификации выглядит следующим образом:
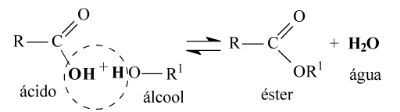
Обратите внимание, что вода образуется в результате объединения гидроксильной группы (ОН) карбоновой кислоты с водородом (Н) спирта. Остальная часть углеродной цепи карбоновой кислоты и спирта объединяется с образованием сложного эфира
Остальная часть углеродной цепи карбоновой кислоты и спирта объединяется с образованием сложного эфира.
Этерификация также может происходить между неорганической кислотой или вторичным или третичным спиртом.
В этом случае образование воды будет происходить иначе: гидроксильная группа будет происходить из спирта, а водород из кислоты.
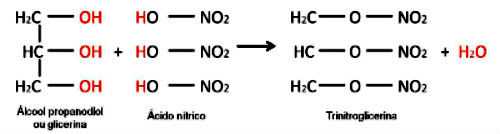
Примером является реакция между неорганической кислотой и образованием неорганического сложного эфира. Три молекулы органической кислоты (азотной кислоты) реагируют с глицерином и образуют тринитроглицерин (сложный эфир нитрата), взрывчатое вещество.
Производственный процесс
Многие химические продукты образуются в результате химической реакции, а затем перегоняются. При получении сложного эфира оба процесса комбинируют друг с другом. Этот процесс называется . Во время реакции один или несколько продуктов (в случае этерификации: вода) могут быть удалены выпариванием. Химическое равновесие постоянно восстанавливается, и тем самым может быть достигнут больший выход сложного эфира. Преимущество процесса состоит в том, что два рабочих шага можно комбинировать. Затраты на оборудование низкие, а процесс недорогой.
Этерификация реактивной перегонкой
Ацилирование гидроксильной группы ($O$-ацилирование)
Ацилирование фенолов или фенолятов хлорангидридами карбоновых кислот в присутствии щелочи или пиридина приводит к образованию сложных эфиров (реакция К. Шоттена, 1884 гг. — Е. Бауманна, 1886 гг.):
 Рисунок 7.
Рисунок 7.
Как ацилирующий реагент используют также ангидриды кислот. Ацилирование фенолов карбоновыми кислотами в присутствии серной кислоты, характерное для алифатических спиртов, проходит очень медленно. Это связано со значительным уменьшением электронной плотности на протонированном фенольном атоме кислорода, существенно уменьшает его нуклеофильные свойства:
![]() Рисунок 8.
Рисунок 8.
Для смещения равновесия в сторону образования эфира необходимо энергично изымать воду в процессе реакции.
Аналогично простым эфирам фенолов для их сложных эфиров характерны перегруппировки в присутствии кислот Льюиса с миграцией ацильной группы в ядро главным образом в п-положение (перегруппировка К. Фриса, 1908) с образованием кетонофенолов (ацилфенолов):
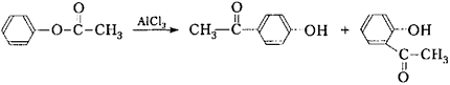 Рисунок 9.
Рисунок 9.
Перегруппировку Фриса часто используют для синтеза ароматических кетонов вместо прямого ацилирования аренов. Миграция ацильной группы в орто- или пара-положения зависит главным образом от температуры, а также от природы растворителя и катализатора. При этом при низких температурах образуются пара-изомеры, а при высоких — орто- изомеры:
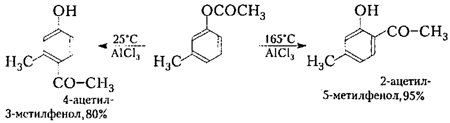 Рисунок 10.
Рисунок 10.
Химические свойства альдегидов и кетонов
Альдегидами называют соединения, молекулы которых содержат карбонильную группу, соединенную с атомом водорода, т.е. общая формула альдегидов может быть записана как
где R – углеводородный радикал, который может быть разной степени насыщенности, например, предельный или ароматический.
Группу –СНО называют альдегидной.
Кетоны – органические соединения, в молекулах которых содержится карбонильная группа, соединенная с двумя углеводородными радикалами. Общую формулу кетонов можно записать как:
где R и R’ – углеводородные радикалы, например, предельные (алкилы) или ароматические.
Гидрирование альдегидов и кетонов
Альдегиды и кетоны могут быть восстановлены водородом в присутствии катализаторов и нагревании до первичных и вторичных спиртов соответственно:
Окисление альдегидов
Альдегиды легко могут быть окислены даже такими мягкими окислителями, как гидроксид меди и аммиачный раствор оксида серебра.
При нагревании гидроксида меди с альдегидом происходит исчезновение изначального голубого окрашивания реакционной смеси, при этом образуется кирпично-красный осадок оксида одновалентной меди:
В реакции с аммиачным раствором оксида серебра вместо самой карбоновой кислоты образуется ее аммонийная соль, поскольку находящийся в растворе аммиак реагирует с кислотами:
Кетоны в реакцию с гидроксидом меди (II) и аммиачным раствором оксида серебра не вступают. По этой причине эти реакции являются качественными на альдегиды. Так реакция с аммиачным раствором оксида серебра при правильной методике ее проведения приводит к образованию на внутренней поверхности реакционного сосуда характерного серебряного зеркала.
Очевидно, что если мягкие окислители могут окислить альдегиды, то само собой это могут сделать и более сильные окислители, например, перманганат калия или дихромат калия. При использовании данных окислителей в присутствии кислот образуются карбоновые кислоты:
Реакции гидролиза
Карбоновые кислоты можно получить реакциями гидролиза их производных или тригалогеналканов.
Гидролиз сложных эфиров. При гидролизе сложных эфиров образуются спирт и карбоновая кислота. Как уже отмечалось выше, реакции этерификации и гидролиза, катализируемые кислотой, обратимы:
![]()
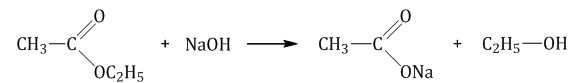
Гидролиз сложного эфира под действием водного раствора щёлочи протекает необратимо. В этом случае из сложного эфира образуется не кислота, а соль:
R—COOR’ + NaOH → R—COONa + R’OH.
Гидролиз нитрилов. Карбоновые кислоты могут быть получены гидролизом их многочисленных производных. Однако с целью синтеза карбоновых кислот используют лишь гидролиз нитрилов, поскольку остальные производные сами получаются из кислот.
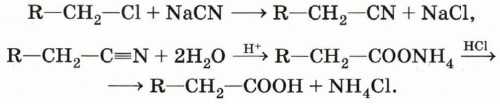
Напомним, что получение нитрилов с их последующим гидролизом позволяет увеличить длину углеродной цепочки на один атом.
Гидролиз тригалогеналканов. Взаимодействие производных предельных углеводородов, содержащих три атома галогена у концевого углеродного атома, с водными растворами щелочей позволяет получить монокарбоновые кислоты. Упрощённо уравнение реакции можно записать следующим образом:
СН3—ССl3 + 3NaOH → СН3—СООН + 3NaCl + Н2O.
Механизм реакции
Реакция протекает в условиях кислотного катализа и проходит по механизму нуклеофильного замещения. На первой стадии происходит протонирование атома кислорода карбонильной группы карбоновой кислоты с образованием резонансно стабилизированого карбокатиона:
после чего происходит нуклеофильная атака атома кислорода гидроксильной группы спирта на карбониевый центр с образованием алкилоксониевого иона, эта стадия является лимитирующей. Затем в алкилоксониевом ионе происходит миграция протона на один из гидроксилов с образованием уходящей группы —O + H2:
Завершающей стадией является отщепление промежуточного продукта присоединения воды и протона — катализатора с образованием сложного эфира:
Механизм реакции подтвержден экспериментом с использованием изотопных меток: при использовании спирта, меченного изотопом 18 O, метка оказывается в составе сложного эфира:
$C$-ацилирование
В отличие от $O$-ацилирования при $C$-ацилировании необходимо использовать как минимум эквимолярное количество катализатора вроде $AlCl_3$ по отношению к фенолу для галогенангидридов карбоновых кислот и двойное его количество для других ацилирующих агентов — ангидридов, о чем будет говорится далее. Реакция $C$-ацилирования осложняется взаимодействием катализатора с фенолом и осмолением. Поэтому получить моноацилфенолы практически невозможно. Чаще ацилируют галогенангидриды или ангидриды карбоновых кислот не фенолы, но их сложные эфиры, например:
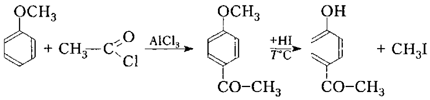 Рисунок 11.
Рисунок 11.
Гидроксильную группу со сложноэфирной после ацилирования восстанавливают действием концентрированной йодоводородной (йодидной) кислоты.
Кроме того, ацилфенолы добывают с помощью перегруппировки Фриса.
Производные карбоновых кислот
Карбоновые кислоты образуют различные функциональные производные при замещении гидроксильной группы.
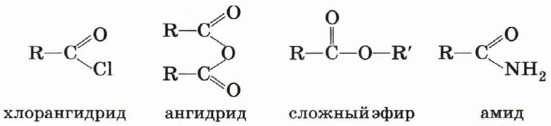
При гидролизе из этих производных вновь образуется карбоновая кислота.
Хлорангидрид карбоновой кислоты можно получить, воздействуя на неё хлоридом фосфора (III) или тионилхлоридом (SOCl2):
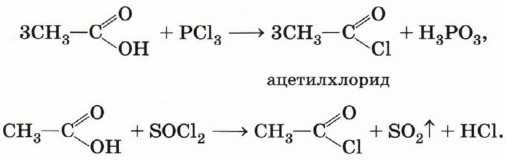
Ангидриды карбоновых кислот получают взаимодействием хлорангидридов с солями карбоновых кислот:
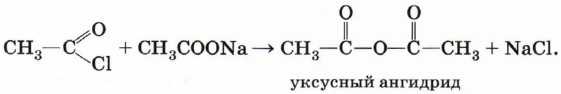
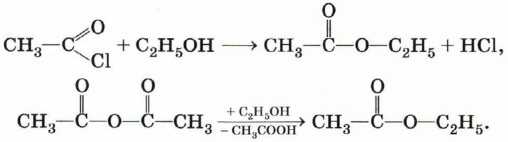
Сложные эфиры образуются в результате этерификации карбоновых кислот спиртами. Этерификация катализируется неорганическими кислотами:
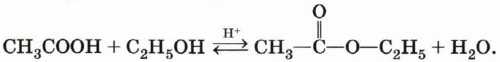
Сложные эфиры могут быть получены также из хлорангидридов и ангидридов карбоновых кислот:
При взаимодействии карбоновых кислот с аммиаком образуются аммониевые соли карбоновых кислот:
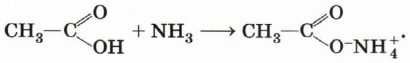
Эти соли при нагревании отщепляют воду, превращаясь в амиды:
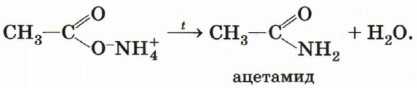
При нагревании амидов кислот с водоотнимающими средствами, например с фосфорным ангидридом, образуются нитрилы:
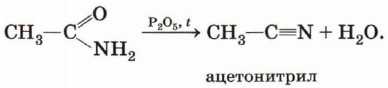
Химические свойства сложных эфиров
| Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей. |
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
При щелочном гидролизе этилацетата образуются ацетат и этанол:
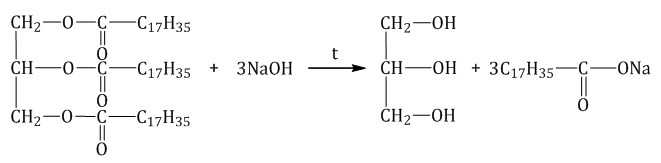
Щелочной гидролиз сложных эфиров — реакция, имеющая промышленное значение. Гидролиз жиров в присутствии оснований — древнейший способ получения мыла. Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:
Применение в органическом синтезе
Этерификацию обычно проводят в присутствии катализаторов — сильных кислот (серная кислота, толуолсульфоновая кислота и т. п.).
Реакция этерификации обратима (гидролиз сложных эфиров называется омылением), положение равновесия зависит от строения и концентраций спирта и карбоновой кислоты, то есть для реакционной смеси существует предел этерификации, при котором устанавливается равновесие, характеризующееся определенным соотношением концентраций исходных спирта и кислоты и продукта их реакции — сложного эфира. Так, например, при эквимолярном соотношении этанола и уксусной кислоты в исходной реакционной смеси равновесие устанавливается, когда
2/3 спирта и кислоты прореагируют с образованием этилацетата.
Для повышения выхода сложного эфира используют либо избыток одного из реагентов (обычно спирта), либо отгонку образующейся при этерификации воды в виде азеотропной смеси с добавляемым в реакционную смесь бензолом.
Свойства муравьиной кислоты
| Особенности свойств муравьиной кислоты обусловлены ее строением, она содержит не только карбоксильную, но и альдегидную группу и проявляет все свойства альдегидов. |
4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
Как и альдегиды, муравьиная кислота окисляется аммиачным раствором оксида серебра. При этом образуется осадок из металлического серебра.
При окислении муравьиной кислоты гидроксидом меди (II) образуется осадок оксида меди (I):
Муравьиная кислота окисляется хлором до углекислого газа.
4.3. Окисление перманганатом калия
Муравьиная кислота окисляется перманганатом калия до углекислого газа:
5HCOOH + 2KMnO4 + 3H2SO4 → 5CO2 + 2MnSO4 + K2SO4 + 8H2O
Химические свойства сложных эфиров
| Сложные эфиры устойчивы в нейтральной среде, но легко разлагаются при нагревании в присутствии кислот или в присутствии щелочей. |
В присутствии кислот гидролиз сложных эфиров протекает как реакция, обратная этерификации. при гидролизе сложных эфиров образуются спирты и карбоновые кислоты.
R-COO-R’ + H2O = R-COOH + R’-OH
Например , при гидролизе метилацетата образуются уксусная кислота и метанол.
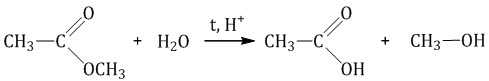
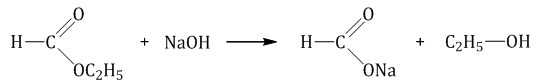
При щелочном гидролизе сложных эфиров образуются соли карбоновых кислот и спирты.
Например , при щелочном гидролизе этилформиата образуются этанол и формиат натрия:
При щелочном гидролизе этилацетата образуются ацетат и этанол:
Щелочной гидролиз сложных эфиров — реакция, имеющая промышленное значение. Гидролиз жиров в присутствии оснований — древнейший способ получения мыла. Первые способы получения мыла связаны со смешиванием жира с золой. Один из основных компонентов животного жира — тристеарат глицерина. В щелочной среде тристеарат глицерина разлагается на глицерин и соль стеариновой кислоты:
Ацилирование фенола. Синтез винилацетата
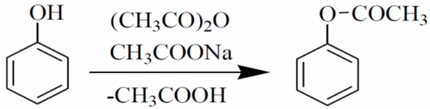 Рисунок 12.
Рисунок 12.
В круглодонную одногорлую колбу, оснащенную механической мешалкой и обратным холодильником, помешают 28,2 г (0.3 моль) фенола, 33,7 г (0.33 моля) уксусного ангидрида и 15-20 г обезвоженного ацетата натрия
Реакционную смесь при интенсивном перемешивании осторожно медленно нагревают до кипения, кипятят в течение 20-30 минут, затем охлаждают, помещают на лед или в 0.5 л воды и в течение 2-х часов перемешивают. Органический слой отделяют, добавляют к нему 50 мл бензола и проводят его обезвоживания (путем отгонки на роторном испарителе азеотропа бензол-вода)
К остатку добавляют 30-50 мл бензола, сушат его обезвоженным магний (II) сульфатом или натрий сульфатом. Раствор продукта реакции переносят в перегонную колбу, отгоняют бензол, а остаток фракционируют при пониженном давлении.
Выход очищенного целевого продукта составляет около 36-38 г. Ткип = 195,5 $^\circ$ С.
Химические свойства карбоновых кислот
Карбоновыми кислотами называют производные углеводородов, содержащие одну или несколько карбоксильных групп.
Карбоксильная группа:
Как можно видеть, карбоксильная группа состоит из карбонильной группы –С(О)- , соединенной с гидроксильной группой –ОН.
В связи с тем, что к гидроксильной группе непосредственно прикреплена карбонильная, обладающая отрицательным индуктивным эффектом связь О-Н является более полярной, чем в спиртах и фенолах. По этой причине карбоновые кислоты обладают заметно более выраженными, чем спирты и фенолы, кислотными свойствами. В водных растворах они проявляют свойства слабых кислот, т.е. обратимо диссоциируют на катионы водорода (Н+) и анионы кислотных остатков:
Реакции образования солей
С образованием солей карбоновые кислоты реагируют с:
1) металлами до водорода в ряду активности:
2) аммиаком
3) основными и амфотерными оксидами:
4) основными и амфотерными гидроксидами металлов:
5) солями более слабых кислот – карбонатами и гидрокарбонатами, сульфидами и гидросульфидами, солями высших (с большим числом атомов углерода в молекуле) кислот:
Систематические и тривиальные названия некоторых кислот и их солей представлены в следующей таблице:
| Формула кислоты | Название кислоты тривиальное/систематическое | Название соли тривиальное/систематическое |
| HCOOH | муравьиная/ метановая | формиат/ метаноат |
| CH3COOH | уксусная/ этановая | ацетат/ этаноат |
| CH3 CH2COOH | пропионовая/ пропановая | пропионат/ пропаноат |
| CH3 CH2 CH2COOH | масляная/ бутановая | бутират/ бутаноат |
Следует помнить и обратное: сильные минеральные кислоты вытесняют карбоновые кислоты из их солей как более слабые:
Реакции с участием ОН группы
Карбоновые кислоты вступают в реакцию этерификации с одноатомными и многоатомными спиртами в присутствии сильных неорганических кислот, при этом образуются сложные эфиры:
Данного типа реакции относятся к обратимым, в связи с чем с целью смещения равновесия в сторону образования сложного эфира их следует осуществлять, отгоняя более летучий сложный эфир при нагревании.
Обратный реакции этерификации процесс называют гидролизом сложного эфира:
Необратимо данная реакция протекает в присутствии щелочей, поскольку образующаяся кислота реагирует с гидроксидом металла с образованием соли:
Реакции замещения атомов водорода в углеводородном заместителе
При проведении реакций карбоновых с хлором или бромом в присутствии красного фосфора при нагревании происходит замещение атомов водорода при α-атоме углерода на атомы галогена:
В случае большей пропорции галоген/кислота может произойти и более глубокое хлорирование:
Особые химические свойства муравьиной кислоты
Молекула муравьиной кислоты, несмотря на свои малые размеры, содержит сразу две функциональные группы:
В связи с этим она проявляет не только свойства кислот, но также и свойства альдегидов:
При действии концентрированной серной кислоты муравьиная кислота разлагается на воду и угарный газ:
Классификация по строению углеводородного радикала
- Предельные карбоновые кислоты – карбоксильная группа СООН соединена с предельным радикалом. Например, этановая кислота СН3–СООН.
- Непредельные карбоновые кислоты – карбоксильная группа СООН соединена с непредельным радикалом. Например, акриловая кислота: СН2=СН–СООН.
- Ароматические кислоты — карбоксильная группа СООН соединена с непредельным радикалом. Например, бензойная кислота: С6Н5СООН.
- Циклические кислоты — карбоксильная группа СООН соединена с углеводородным циклом. Например, циклопропанкарбоновая кислота: С3Н5СООН.
Строение карбоновых кислот
Карбоксильная группа сочетает в себе две функциональные группы – карбонил и гидроксил, взаимно влияющие друг на друга.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность смещена к более электроотрицательному атому кислорода.
Атом углерода карбоксильной группы находится в состоянии sp2-гибридизации, образует три σ-связи и одну π-связь.
Водородные связи и физические свойства карбоновых кислот
В жидком состоянии и в растворах молекулы карбоновых кислот образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул карбоновых кислот.
Молекулы карбоновых кислот с помощью водородных связей соединены в димеры.
Это приводит к увеличению растворимости в воде и высоким температурам кипения низших карбоновых кислот.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Номенклатура карбоновых кислот
Предельные одноосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Муравьиная | Метановая | Формиат (метаноат) | HCOOH |
| Уксусная | Этановая | Ацетат (этаноат) | CH3COOH |
| Пропионовая | Пропановая | Пропионат (пропаноат) | CH3CH2COOH |
| Масляная | Бутановая | Бутират (бутаноат) | CH3(CH2)2COOH |
| Валериановая | Пентановая | Пентаноат | CH3(CH2)3COOH |
| Капроновая | Гексановая | Гексаноат | CH3(CH2)4COOH |
| Пальмитиновая | Гексадекановая | Пальмитат | С15Н31СООН |
| Стеариновая | Октадекановая | Стеарат | С17Н35СООН |
Таблица. Непредельные одноосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Акриловая | Пропеновая | Акрилат | CH2=CH–COOH |
| Метакриловая | 2-Метилпропеновая | Метакрилат | CH2=C(СH3)–COOH |
| Кротоновая | транс-2-Бутеновая | Кротонат | СН3 -CH=CH–COOH |
| Олеиновая | 9- цис-Октадеценовая | Олеат |
СН3(СН2)7СН=СН(СН2)7СООН |
| Линолевая | 9,12-цис-Октадекадиеновая | Линолеат | СН3(СН2)4(СН=СНСН2)2(СН2)6СООН |
| Линоленовая | 9,12,15-цис-Октадекатриеновая | Линоленоат | СН3СН2(СН=СНСН2)3(СН2)6СООН |
Таблица. Двухосновные карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Щавелевая | Этандиовая | Оксалат | НООС – COOH |
| Малоновая | Пропандиовая | Малонат | НООС-СН2-СООН |
| Янтарная | Бутандиовая | Сукцинат | НООС-(СН2)2-СООН |
| Глутаровая | Пентандиовая | Глутарат | НООС-(СН2)3-СООН |
| Адипиновая | Гександиовая | Адипинат | НООС-(СН2)4-СООН |
| Малеиновая | цис-Бутендиовая | Малеинат | цис-НООССН=СНСООН |
| Фумаровая | транс-Бутендиовая | Фумарат | транс-НООССН=СНСООН |
Таблица. Ароматические карбоновые кислоты.
| Тривиальное название | Систематическое название | Название соли и эфира | Формула кислоты |
| Бензойная | Фенилкарбоновая | Бензоат | |
| Фталевая | Бензол-1,2-дикарбоновая кислота | Фталат | |
| Изофталевая | Бензол-1,3-дикарбоновая кислота | Изофталат | |
| Терефталевая | Бензол-1,4-дикарбоновая кислота | Терефталат |
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
Механизм кислотно-катализируемой этерификации карбоновых кислот (этерификация Фишера)
Эмиль Фишер осознал, что даже небольшие количества серной кислоты значительно увеличивают выход сложного эфира и что большие количества кислоты не нужны, как это было принято в то время.
Первый шаг этерификации является протонированием с карбоновой кислотой в мезомерный стабилизированном катион .
Катион, образованный протонированием, подвергается нуклеофильной атаке неподеленной парой электронов из гидроксильной группы спирта . Атом водорода исходного алканола образует внутримолекулярную водородную связь с атомом кислорода карбоксильной группы и в конечном итоге образует с ним связь.
Ион оксония, образовавшийся на последней стадии выше, сначала отщепляет воду с образованием катиона, который после депротонирования приводит к сложному эфиру.
Этот механизм может быть продемонстрирован изотопным мечением атома кислорода в спирте.
Быстро установившееся равновесие образования сложного эфира требует повышенной температуры или добавления кислот. Серная кислота часто используется для кислотного катализа , потому что ее гидратная способность связывает определенное количество воды, так что вода удаляется из реакционного равновесия (реакционное равновесие смещается в пользу сложного эфира).
Наиболее распространенный метод получения сложных эфиров в лабораторных условиях — азеотропная этерификация. Вода, образующаяся во время реакции, отгоняется (вытягивается) с растворителем в качестве азеотропа . Обычно в качестве переносчиков растворителей / воды используются гексан , хлороформ или толуол . Бензол , который часто использовался в прошлом, больше не используется , потому что это канцерогенное вещество. В качестве катализатора обычно используется п- толуолсульфоновая кислота вместо серной кислоты, потому что с ней удобнее обращаться с сопоставимой активностью, и для этого метода не требуются водосвязывающие свойства серной кислоты. Если используется водоотделитель , за ходом этерификации также можно следить количественно.
Соли гафния (IV) (включая оксид дихлорида гафния) оказались особенно эффективными катализаторами (одна молекула соли гафния (IV) может связывать 7 молекул воды).
См. также
Смотреть что такое «Этерификация» в других словарях:
этерификация — и, ж. éthérificatrion f. хим. Подвергание действию эфира. Этерификация желатина. ЭСХ 1900 2 1026. Этерификация этилового спирта уксусной кислотой. Природа 1935 7 9. Лекс. БСЭ 3: этерифика/ция … Исторический словарь галлицизмов русского языка
этерификация — сущ., кол во синонимов: 1 • эфиризация (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
этерификация — Образование эфира из низкомолекулярных исходных соединений, сопровождающееся выделением простейших веществ. Тематики волокна химические … Справочник технического переводчика
этерификация — esterinimas statusas T sritis chemija apibrėžtis Rūgšties ir alkoholio pavertimas esteriu. atitikmenys: angl. esterification rus. эстерификация; этерификация ryšiai: sinonimas – esterifikacija … Chemijos terminų aiškinamasis žodynas
этерификация — eterinimas statusas T sritis chemija apibrėžtis Alkoholio pavertimas eteriu. atitikmenys: angl. etherification rus. этерификация ryšiai: sinonimas – eterifikacija … Chemijos terminų aiškinamasis žodynas
Этерификация — При действии кислот на алкоголь одновременно происходит 2 реакции: 1) Сначала образование сложного эфира по уравнению: RCO2H + R OH = RCO2R + H2O. 2) Тотчас же разложение эфира водой, образующейся при реакции, по обратному уравнению: RCO2R + Н2O … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Реакции окисления
Окисление алканов. Ряд карбоновых кислот в промышленности получают окислением предельных углеводородов. Практическое значение имеет каталитическое окисление метана до муравьиной кислоты. При окислении других алканов происходит разрыв углеродной цепи (примерно посередине). Например, при каталитическом окислении бутана получают уксусную кислоту:
![]()
Практическое значение имеет окисление твёрдых алканов (парафинов). При этом углеводороды с длинной цепью (> С25) под действием кислорода воздуха в жидкой фазе в присутствии солей тяжёлых металлов превращаются в смесь карбоновых кислот с длиной цепи С12—С18, которая используется для получения мыла и других поверхностно-активных соединений:
![]()
Окисление алкенов. Алкены с неразветвлённой углеродной цепочкой окисляются по месту двойной связи с образованием карбоновых кислот:
![]()
В качестве окислителя можно использовать кипящий раствор перманганата калия или кислород воздуха в присутствии катализатора.
Окисление аренов. Ароматические карбоновые кислоты образуются при окислении гомологов бензола (см. §15):
![]()
В лабораторных условиях в качестве окислителя используют перманганат калия при нагревании.
Окисление первичных спиртов и альдегидов. Первичные спирты при окислении сначала превращаются в альдегиды и далее в карбоновые кислоты. Естественно, что в качестве исходных веществ в реакцию можно брать и альдегиды.
В качестве окислителей используются растворы перманганата или дихромата калия (КМnO4 или К2Сr2О7), раствор оксида хрома (VI) в серной кислоте.
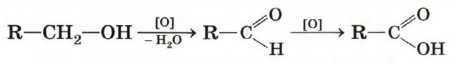
Структурная изомерия
Для предельных карбоновых кислот характерна структурная изомерия – изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры – это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для карбоновых кислот, которые содержат не менее четырех атомов углерода.
| Например. Формуле С4Н8О2 соответствуют бутановая и 2-метилпропановая кислота |
| Бутановая (масляная) кислота | Изомасляная (2-метилпропановая) кислота |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Карбоновые кислоты изомерны сложным эфирам. Общая формула и предельных одноосновных карбоновых кислот, и сложных эфиров — CnH2nО2.
| Например. Межклассовые изомеры с общей формулой С2Н4О2: уксусная кислота СН3–CОOH и метилформиат H–COOCH3 |
| Уксусная кислота | Метиловый эфир муравьиной кислоты |
| СН3–CОOH | HCOOCH3 |
Общую формулу СnH2nO2 могут также иметь многие другие полифункциональные соединения, например: альдегидоспирты, непредельные диолы, циклические простые диэфиры и т.п.
Химические свойства карбоновых кислот
.
Для карбоновых кислот характерны следующие свойства:
|
1. Кислотные свойства
| Кислотные свойства карбоновых кислот возникают из-за смещения электронной плотности к карбонильному атому кислорода и вызванной этим дополнительной (по сравнению со спиртами и фенолами) поляризацией связи О–Н. |
|
Карбоновые кислоты – кислоты средней силы.
В водном растворе карбоновые кислоты частично диссоциируют на ионы: R–COOH ⇆ R-COO– + H+ |
1.1. Взаимодействие с основаниями
Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
CH3COOH + NaOH = CH3COONa + H2O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
| Например, уксусная кислота растворяет осадок гидроксида меди (II) |
| Например, уксусная кислота реагирует с водным раствором аммиака с образованием ацетата аммония |
CH3COOH + NH3 = CH3COONH4
1.2. Взаимодействие с металлами
Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород.
| Например, уксусная кислота взаимодействует с кальцием с образованием ацетата кальция и водорода. |
1.3. Взаимодействие с основными оксидами
Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды.
| Например, уксусная кислота взаимодействует с оксидом бария с образованием ацетата бария и воды. |
| Например, уксусная кислота реагирует с оксидом меди (II) |
2СН3СООН + CuO = H2О + ( CH3COO)2 Cu
1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
Карбоновые кислоты реагируют с солями более слабых, нерастворимых и летучих кислот.
| Например, уксусная кислота растворяет карбонат кальция |
| Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими гидрокарбонатами. В результате наблюдается выделение углекислого газа |
Этерификация
Смотреть что такое «Этерификация» в других словарях:
этерификация — и, ж. éthérificatrion f. хим. Подвергание действию эфира. Этерификация желатина. ЭСХ 1900 2 1026. Этерификация этилового спирта уксусной кислотой. Природа 1935 7 9. Лекс. БСЭ 3: этерифика/ция … Исторический словарь галлицизмов русского языка
Этерификация — (от др. греч. αἰθήρ эфир и лат. facio делаю) реакция образования сложных эфиров при взаимодействии кислот и спиртов: RCOOH + R’OH ⇔ RCOOR + Н2О Механизм реакции Реакция протекает в условиях кислотного катализа и проходит по … Википедия
этерификация — сущ., кол во синонимов: 1 • эфиризация (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
этерификация — Образование эфира из низкомолекулярных исходных соединений, сопровождающееся выделением простейших веществ. Тематики волокна химические … Справочник технического переводчика
этерификация — esterinimas statusas T sritis chemija apibrėžtis Rūgšties ir alkoholio pavertimas esteriu. atitikmenys: angl. esterification rus. эстерификация; этерификация ryšiai: sinonimas – esterifikacija … Chemijos terminų aiškinamasis žodynas
этерификация — eterinimas statusas T sritis chemija apibrėžtis Alkoholio pavertimas eteriu. atitikmenys: angl. etherification rus. этерификация ryšiai: sinonimas – eterifikacija … Chemijos terminų aiškinamasis žodynas
Этерификация — При действии кислот на алкоголь одновременно происходит 2 реакции: 1) Сначала образование сложного эфира по уравнению: RCO2H + R OH = RCO2R + H2O. 2) Тотчас же разложение эфира водой, образующейся при реакции, по обратному уравнению: RCO2R + Н2O … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. |






























