Химические свойства алкенов
1. Реакции присоединения
Поскольку двойная связь в молекулах алкенов состоит из одной прочной сигма- и одной слабой пи-связи, они являются довольно активными соединениями, которые легко вступаю в реакции присоединения. В такие реакции алкены часто вступают даже в мягких условиях — на холоду, в водных растворах и органических растворителях.
Гидрирование алкенов
Алкены способны присоединять водород в присутствии катализаторов (платина, палладий, никель):
CH3—СН=СН2 + Н2 → CH3—СН2—СН3
Гидрирование алкенов легко протекает даже при обычном давлении и незначительном нагревании. Интересен тот факт, что для дегидрирования алканов до алкенов могут использоваться те же катализаторы, только процесс дегидрирования протекает при более высокой температуре и меньшем давлении.
Галогенирование
Алкены легко вступаю в реакцию присоединения с бромом как в водном растворе, так и с органических растворителях. В результате взаимодействия изначально желтые растворы брома теряют свою окраску, т.е. обесцвечиваются.
СН2=СН2+ Br2 → CH2Br-CH2Br
Гидрогалогенирование
Как нетрудно заметить, присоединение галогеноводорода к молекуле несимметричного алкена должно, теоретически, приводить к смеси двух изомеров. Например, при присоединении бромоводорода к пропену должны были бы получаться продукты:
Тем не менее в отсутствие специфических условий (например, наличие пероксидов в реакционной смеси) присоединение молекулы галогеноводорода будет происходить строго селективно в соответствии с правилом Марковникова:
Присоединении галогеноводорода к алкену происходит таким образом, что водород присоединяется к атому углерода с большим числом атомов водорода (более гидрированному), а галоген — к атому углерода с меньшим числом атомов водорода (менее гидрированному).
Поэтому:
Гидратация
Данная реакция приводит к образованию спиртов, и также протекает в соответствии с правилом Марковникова:
Как легко догадаться, по причине того, что присоединение воды к молекуле алкена происходит согласно правилу Марковникова, образование первичного спирта возможно только в случае гидратации этилена:
CH2=CH2 + H2O → CH3-CH2-OH
Именно по такой реакции проводят основное количество этилового спирта в крупнотоннажной промышленности.
Полимеризация
Специфическим случаем реакции присоединения можно реакцию полимеризации, которая в отличие от галогенирования, гидрогалогенирования и гадратации, протекает про свободно-радикальному механизму:
Реакции окисления
Как и все остальные углеводороды, алкены легко сгорают в кислороде с образованием углекислого газа и воды. Уравнение горения алкенов в избытке кислорода имеет вид:
CnH2n + (3/2)nO2 → nCO2 + nH2O
В отличие от алканов алкены легко окисляются. При действии на алкены водного раствора KMnO4 обесцвечивание, что является качественной реакцией на двойные и тройные CC связи в молекулах органических веществ.
Окисление алкенов перманганатом калия в нейтральном или слабощелочном растворе приводит к образованию диолов (двухатомных спиртов):
3C2H4 + 2KMnO4 + 4H2O → 3CH2OH–CH2OH + 2MnO2 + 2KOH (охлаждение)
В кислой среде происходит полное разрыв двойной связи с превращение атомов углерода образовывавших двойная связь в карбоксильные группы:
5CH3CH=CHCH2CH3 + 8KMnO4 + 12H2SO4 → 5CH3COOH + 5C2H5COOH + 8MnSO4 + 4K2SO4 + 12H2O (нагревание)
В случае, если двойная С=С связь находится в конце молекулы алкена, то в качестве продукта окисления крайнего углеродного атома при двойной связи образуется углекислый газ. Связано это с тем, что промежуточный продукт окисления – муравьиная кислота легко сама окисляется в избытке окислителя:
CH3CH=CH2 + 2KMnO4 + 3H2SO4 → CH3COOH + CO2 + 2MnSO4 + K2SO4 + 4H2O (нагревание)
При окислении алкенов, в которых атом C при двойной связи содержит два углеводородных заместителя, образуется кетон. Например, при окислении 2-метилбутена-2 образуется ацетон и уксусная кислота.
Окисление алкенов, при котором происходит разрыв углеродного скелета по двойной связи используется для установления их структуры.
Алкины
Алкины также называют ненасыщенными углеводородами, так как присутствует одна тройная связь и характерны реакции присоединения.
Общая формула: CnH2n-2.
Гибридизация
Атомы углерода, участвующие в образовании тройной связи находятся в состоянии sp-гибридизации, остальные атомы углерода находятся в состоянии sp3-гибридизации.
Виды изомерии: изомерия цепи, изомерия положения тройной связи, межклассовая изомерия с алкадиенами.
Физические свойства
Физические свойства алкинов практически не отличаются от свойств соответствующих алканов и алкенов (С2–С4 – газы, С4–С16 – жидкости при нормальных условиях, далее – твердые вещества). Температуры кипения алкинов несколько выше, чем у соответствующих алкенов (несмотря на несколько меньшую молекулярную массу). Это также связано с большей полярностью связей, образованных sp-гибридизованными атомами углерода.
Химические свойства
По своим химическим свойствам алкины похожи на алкены. Для них также наиболее характерными являются реакции электрофильного присоединения. Для несимметричных алкинов, как и для алкенов, действует правило Марковникова. Существенным отличием является меньшая реакционная способность тройных связей по сравнению с двойными. Поскольку в результате присоединения обаразуется замещенный алкен (с более реакционно-способной связью), то при избытке присоединяющегося реагента реакция, как правило, идет дальше и образуется замещенный алкан:
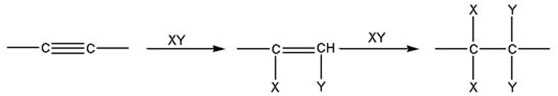 |
или |
| Алкин | Замещеный алкен | Замещеный алкан |
Гидрирование
В присутствии металлических катализаторов (Pt, Ni) алкины присоединяют водород с образованием алкенов (разрывается первая p-связь), а затем алканов (разрывается вторая p-связь):
| Пропин | Пропен | Пропан |
При использовании менее активного катализатора гидрирование останавливается на стадии образования алкенов.
Галогенирование
Электрофильное присоединение галогенов к алкинам протекает медленнее, чем для алкенов (первая p-связь разрывается труднее, чем вторая). Алкины обесцвечивают бромную воду:
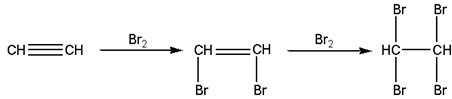 |
| Ацетилен | 1,2-Дибромэтилен | 1,1,2,2-Тетробромэтилен |
Гидрогалогенирование
Присоединение галогеноводородов также идет по электрофильному механизму. Продукты присоединения к несимметричным алкинам определяются правилом Марковникова :
 |
| Пропин | 2-Бромпропен | 2,2-Дибромпропан |
Гидрохлорирование
Гидрохлорирование ацетилена используется в одном из промышленных способов получения винилхлорида. Винилхлорид является исходным веществом (мономером) в производстве поливинилхлорида (ПВХ).
(реакция Кучерова)
Присоединение воды происходит в присутствии катализатора соли ртути (II) и идет через образование неустойчивого непредельного спирта, который изомеризуется в уксусный альдегид (в случае ацетилена) или в кетон (в случае других алкинов).
Полимеризация
1.Димеризация под действием водно-аммиачного раствора CuCl.
2.Тримеризация ацетилена над активированным углем приводит к образованию бензола (реакция Зелинского).
Возможно образование молекул, содержащих большее число звеньев ацетилена как циклического, так и линейного строения
… –СН=СН–СН=СН–СН=СН–…
(такие полимеры обладают полупроводниковыми свойствами).
Следует также отметить, что высокомолекулярное вещество – карбин (третья аллотропная модификация углерода) – образуется не в результате полимеризации ацетилена, а при окислительной поликонденсации ацетилена в присутствии CuCl.
Получение
Получение алкинов чаще всего производится по следующим реакциям:
| Карбид кальция | Ацетилен |
Алкины могут быть получены из соответствующих галогензамещенных алканов и алкенов.
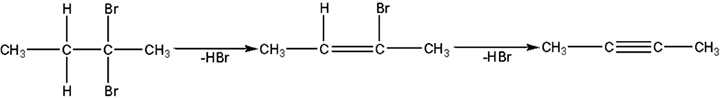 |
| 2,2-Дибромбутан | 2-Бромбутен-2 | Бутин-2 |
 |
| Бутен-1 | 1,2-Дибромбутан | Бутин-1 |
Применение
Ранее (а иногда и сейчас) ацетилен широко применялся для создания высокотемпературного пламени при газовой сварке. Сейчас на первый план вышло его применение для целей органического синтеза. Получение растворителей. При присоединении хлора к ацетилену получается тетрахлорэтан:
СН≡СН+2Сl2 = СНСl2–СНСl2,
а отщеплением от последнего молекулы хлороводорода – 1,1,2-трихлорэтен:
СНСl2–СНСl2 = СНСl=ССl2+НСl.
Химические свойства алканов
Алканами (парафинами) называют нециклические углеводороды, в молекулах которых все атомы углерода соединены только одинарными связями. Другими словами в молекулах алканов отсутствуют кратные — двойные или тройные связи. Фактически алканы являются углеводородами, содержащими максимально возможное количество атомов водорода, в связи с чем их называют предельным (насыщенными).
Ввиду насыщенности, алканы не могут вступать в реакции присоединения.
Поскольку атомы углерода и водорода имеют довольно близкие электроотрицательности, это приводит к тому, что связи С-Н в их молекулах крайне малополярны. В связи с этим для алканов более характерны реакции протекающие по механизму радикального замещения, обозначаемого символом SR.
1. Реакции замещения
В реакциях данного типа происходит разрыв связей углерод-водород
RH + XY → RX + HY
или
Галогенирование
Алканы реагируют с галогенами (хлором и бромом) под действием ультрафиолетового света или при сильном нагревании. При этом образуется смесь галогенпроизводных с различной степенью замещения атомов водорода — моно-, ди- три- и т.д. галогенозамещенных алканов.
На примере метана это выглядит следующим образом:
Меняя соотношение галоген/метан в реакционной смеси можно добиться того, что в составе продуктов будет преобладать какое-либо конкретное галогенпроизводное метана.
Механизм реакции
Разберем механизм реакции свободнорадикального замещения на примере взаимодействия метана и хлора. Он состоит из трех стадий:
- инициирование (или зарождение цепи) — процесс образования свободных радикалов под действии энергии извне – облучения УФ-светом или нагревания. На этой стадии молекула хлора претерпевает гомолитический разрыв связи Cl-Cl c образованием свободных радикалов:
Свободными радикалами, как можно видеть из рисунка выше, называют атомы или группы атомов с одним или несколькими неспаренными электронами (Сl•, •Н, •СН3,•СН2• и т.д.);
2. Развитие цепи
Эта стадия заключается во взаимодействии активных свободных радикалов с неактивными молекулами. При этом образуются новые радикалы. В частности, при действии радикалов хлора на молекулы алкана, образуется алкильный радикал и хлороводород. В свою очередь, алкильный радикал, сталкиваясь с молекулами хлора, образует хлорпроизводное и новый радикал хлора:
3) Обрыв (гибель) цепи:
Происходит в результате рекомбинации двух радикалов друг с другом в неактивные молекулы:
2. Реакции окисления
В обычных условиях алканы инертны по отношению к таким сильным окислителям, как концентрированная серная и азотная кислоты, перманганат и дихромат калия (КMnО4, К2Cr2О7).
Горение в кислороде
А) полное сгорание при избытке кислорода. Приводит к образованию углекислого газа и воды:
CH4 + 2O2 = CO2 + 2H2O
Б) неполное сгорание при недостатке кислорода:
2CH4 + 3O2 = 2CO + 4H2O
CH4 + O2 = C + 2H2O
Каталитическое окисление кислородом
В результате нагревания алканов с кислородом (~200 оС) в присутствии катализаторов, из них может быть получено большое разнообразие органических продуктов: альдегиды, кетоны, спирты, карбоновые кислоты.
Например, метан, в зависимости природы катализатора, может быть окислен в метиловый спирт, формальдегид или муравьиную кислоту:
3. Термические превращения алканов
Крекинг
Крекинг (от англ. to crack — рвать) — это химический процесс протекающий при высокой температуре, в результате которого происходит разрыв углеродного скелета молекул алканов с образованием молекул алкенов и алканов с обладающих меньшими молекулярными массами по сравнению с исходными алканами. Например:
CH3-CH2-CH2-CH2-CH2-CH2-CH3 → CH3-CH2-CH2-CH3 + CH3-CH=CH2
Крекинг бывает термический и каталитический. Для осуществления каталитического крекинга, благодаря использованию катализаторов, используют заметно меньшие температуры по сравнению с термическим крекингом.
Дегидрирование
Отщепление водорода происходит в результате разрыва связей С—Н; осуществляется в присутствии катализаторов при повышенных температурах. При дегидрировании метана образуется ацетилен:
2CH4 → C2H2 + 3H2
Нагревание метана до 1200 °С приводит к его разложению на простые вещества:
СН4 → С + 2Н2
При дегидрировании остальных алканов образуются алкены:
C2H6 → C2H4 + H2
При дегидрировании н-бутана образуются бутен-1 и бутен-2 (последний в виде цис- и транс-изомеров):
Химические свойства ароматических углеводородов
Ароматический характер связи влияет на химические свойства бензолов и других ароматических углеводородов.
Единая 6пи–электронная система намного более устойчива, чем обычные пи-связи. Поэтому для ароматических углеводородов более характерны реакции замещения, а не присоединения. В реакции замещения арены вступают по электрофильному механизму.
Реакции замещения
Галогенирование
Нитрование
Лучше всего реакция нитрования протекает под действием не чистой азотной кислоты, а ее смеси с концентрированной серной кислотой, так называемой нитрующей смеси:
Алкилирование
Реакция при которой один из атомов водорода при ароматическом ядре замещается на углеводородный радикал:
Также вместо галогенпроизводных алканов можно использовать алкены. В качестве катализаторов можно использовать галогениды алюминия, трехвалентного железа или неорганические кислоты.<
Реакции присоединения
Присоединение хлора
Протекает по радикальному механизму при интенсивном облучении ультрафиолетовым светом:
Подобным образом реакция может протекать только с хлором.
Реакции окисления
Неполное окисление
Бензольное кольцо устойчиво к действию таких окислителей как KMnO4 и K2Cr2O7. Реакция не идет.
Галогенирование
Молекулу толуола можно рассматривать, как состоящую из фрагментов молекул бензола и метана. Поэтому логично предположить, что химические свойства толуола должны в какой-то мере сочетать химические свойства этих двух веществ, взятых по отдельности. В частности, именно это и наблюдается при его галогенировании. Мы уже знаем, что бензол вступает в реакцию замещения с хлором по электрофильному механизму, и для осуществления данной реакции необходимо использовать катализаторы (галогениды алюминия или трехвалентного железа). В то же время метан так же способен реагировать с хлором, но уже по свободно-радикальному механизму, для чего требуется облучение исходной реакционной смеси УФ-светом. Толуол, в зависимости от того, в каких условиях подвергается хлорированию, способен дать либо продукты замещения атомов водорода в бензольном кольце – для это нужно использовать те же условия что и при хлорировании бензола, либо продукты замещения атомов водорода в метильном радикале, если на него, как и на метан действовать хлором при облучении ультрафиолетом:
Как можно заметить хлорирование толуола в присутствии хлорида алюминия привело к двум разным продуктам – орто- и пара-хлортолуолу. Это обусловлено тем, что метильный радикал является заместителем I рода.
Если хлорирование толуола в присутсвии AlCl3 проводить в избытке хлора, возможно образование трихлорзамещенного толуола:
Аналогично при хлорировании толуола на свету при большем соотношении хлор/толуол можно получить дихлорметилбензол или трихлорметилбензол:
Нитрование
Замещение атомов водорода на нитрогруппу при нитровании толуола смесью концентрированных азотной и серной кислот приводит к продуктам замещения в ароматическом ядре, а не метильном радикале:
Алкилирование
Как уже было сказано, метильный радикал является ориентантом I рода, поэтому его алкилирование по Фриделю-Крафтсу приводит продуктам замещения в орто- и пара-положения:
Реакции присоединения
Толуол можно прогидрировать до метилциклогексана при использовании металлических катализаторов (Pt, Pd, Ni):
С6Н5СН3 + 9O2 → 7СO2 + 4Н2O
Неполное окисление
При действии такого окислителя, как водный раствор перманганата калия окислению подвергается боковая цепь. Ароматическое ядро в таких условиях окислиться не может. При этом в зависимости от pH раствора будет образовываться либо карбоновая кислота, либо ее соль:
Реакции замещения
| Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение). При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). |
2.1. Галогенирование
Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl3, FeBr3).
При взаимодействии с хлором на катализаторе AlCl3 образуется хлорбензол:
Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr3 . Также в качестве катализатора можно использовать металлическое железо.
Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола:
|
Гомологи бензола содержат алкильные заместители, которые обладают электронодонорным эффектом: из-за того, что электроотрицательность водорода меньше, чем углерода, электронная плотность связи С-Н смещена к углероду.
На нём возникает избыток электронной плотности, который далее передается на бензольное кольцо. |
| Поэтому гомологи бензола легче вступают в реакции замещения в бензольном кольце. При этом гомологи бензола вступают в реакции замещения преимущественно в орто— и пара-положения |
| Например, при взаимодействии толуола с хлором образуется смесь продуктов, которая преимущественно состоит из орто-хлортолуола и пара-хлортолуола |
Мета-хлортолуол образуется в незначительном количестве.
При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300оС) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.
| Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). |
Например, при хлорировании этилбензола:
2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь).
При этом образуется нитробензол:
| Серная кислота способствует образованию электрофила NO2+: |
Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты.
В продуктах реакции мы указываем либо о-нитротолуол:
либо п-нитротолуол:
Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):
2.3. Алкилирование ароматических углеводородов
Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl3, FeBr3 и др.) с образованием гомологов бензола.
| Например, бензол реагирует с хлорэтаном с образованием этилбензола |
Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др.
| Например, бензол реагирует с этиленом с образованием этилбензола |
| Например, бензол реагирует с пропиленом с образованием изопропилбензола (кумола) |
Алкилирование спиртами протекает в присутствии концентрированной серной кислоты.
| Например, бензол реагирует с этанолом с образованием этилбензола и воды |
2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO3 в серной кислоте (олеум) с образованием бензолсульфокислоты:
Крекинг алканов
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
| Например, при крекинге н-пентана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды. |
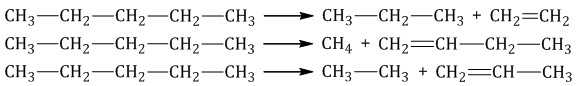
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
Реакции присоединения
Тройная связь состоит из σ-связи и двух π-связей. Сравним характеристики одинарной связи С–С, тройной связи С≡С и связи С–Н:
| Энергия связи, кДж/моль | Длина связи, нм | |
| С–С | 348 | 0,154 |
| С≡С | 814 | 0,120 |
| С–Н | 435 | 0,107 |
Таким образом, тройная связь С≡С короче, чем одинарная связь С–С, поэтому π-электроны тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью и подвижностью. Реакции присоединения по тройной связи к алкинам протекают сложнее, чем реакции присоединения по двойной связи к алкенам.
Для алкинов характерны реакции присоединения по тройной связи С≡С с разрывом π-связей.
1.1. Гидрирование
Гидрирование алкинов протекает в присутствии катализаторов (Ni, Pt) с образованием алкенов, а затем сразу алканов.
| Например, при гидрировании бутина-2 в присутствии никеля образуется сначала бутен-2, а затем бутан. |
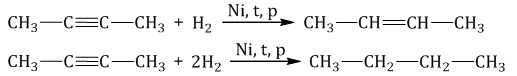
При использовании менее активного катализатора (Pd, СaCO3, Pb(CH3COO)2) гидрирование останавливается на этапе образования алкенов.
| Например, при гидрировании бутина-1 в присутствии палладия преимущественно образуется бутен-1. |
![]()
1.2. Галогенирование алкинов
Присоединение галогенов к алкинам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкинами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на тройную связь. |
| Например, при бромировании пропина сначала образуется 1,2-дибромпропен, а затем — 1,1,2,2-тетрабромпропан. |
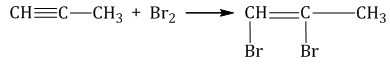
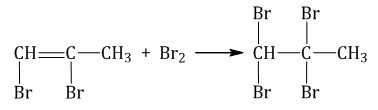
Аналогично алкины реагируют с хлором, но обесцвечивания хлорной воды при этом не происходит, потому что хлорная вода и так бесцветная)
Реакции протекают в присутствии полярных растворителей по ионному (электрофильному) механизму.
1.3. Гидрогалогенирование алкинов
Алкины присоединяют галогеноводороды. Реакция протекает по механизму электрофильного присоединения с образованием галогенопроизводного алкена или дигалогеналкана.
| Например, при взаимодействии ацетилена с хлороводородом образуется хлорэтен, а затем 1,1-дихлорэтан. |
![]()
При присоединении галогеноводородов и других полярных молекул к симметричным алкинам образуется, как правило, один продукт реакции, где оба галогена находятся у одного атома С.
При присоединении полярных молекул к несимметричным алкинам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к несимметричным алкинам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
| Например, при присоединении хлороводорода HCl к пропину преимущественно образуется 2-хлорпропен. |
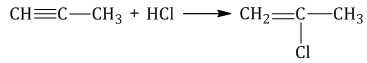
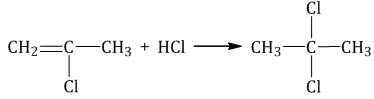
1.4. Гидратация алкинов
Гидратация (присоединение воды) алкинов протекает в присутствии кислоты и катализатора (соли ртути II).
Сначала образуется неустойчивый алкеновый спирт, который затем изомеризуется в альдегид или кетон.
| Например, при взаимодействии ацетилена с водой в присутствии сульфата ртути образуется уксусный альдегид. |
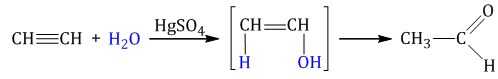
Гидратация алкинов протекает по ионному (электрофильному) механизму.
Для несимметричных алкенов присоединение воды преимущественно по правилу Марковникова.
| Например, при гидратации пропина образуется пропанон (ацентон). |
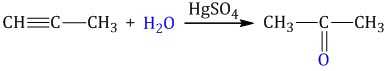
1.5. Димеризация, тримеризация и полимеризация
Присоединение одной молекулы ацетилена к другой (димеризация) протекает под действием аммиачного раствора хлорида меди (I). При этом образуется винилацетилен:
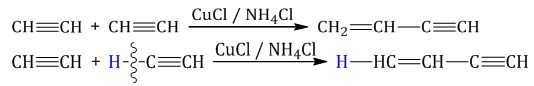
Тримеризация ацетилена (присоединение трех молекул друг к другу) протекает под действием температуры, давления и в присутствии активированного угля с образованием бензола (реакция Зелинского):
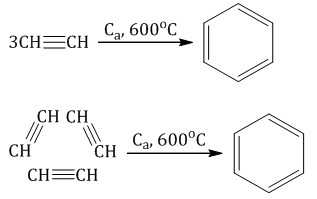
Алкины также вступают в реакции полимеризации — процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Например, при полимеризации ацетилена образуется полимер линейного или циклического строения. |
… –CH=CH–CH=CH–CH=CH–…






























