техника
Нагреть образец
Образец должен быть нагрет, применяя огонь к слайду ниже. Фиксация спиртом может быть сделана, когда мазок не был приготовлен с мокротой (обработанной гипохлоритом натрия для отбеливания) и если он не будет окрашен немедленно..
M. tuberculosis Устраняется отбеливателем и в процессе окрашивания. Термофиксация необработанной мокроты не убьет M. tuberculosis, тогда как фиксация алкоголем является бактерицидной.
Нагреть пятно
Это делается за 5 минут. Вы должны заметить выброс пара (примерно 60 ° C)
Важно не перегревать и не сжигать образец.
Что касается нагревания пятна, то при нагревании фуксинкарбола следует соблюдать особую осторожность, особенно если окрашивание проводится на лотке или другом контейнере, в котором из предыдущего пятна были собраны легковоспламеняющиеся химические вещества.. Под горками следует наносить только небольшое пламя, используя освещенный тампон, предварительно смоченный несколькими каплями кислого спирта, метанола или 70% этанола
Избегайте использования большого тампона, пропитанного этанолом, потому что это может привести к пожару
Под горками следует наносить только небольшое пламя, используя освещенный тампон, предварительно смоченный несколькими каплями кислого спирта, метанола или 70% этанола. Избегайте использования большого тампона, пропитанного этанолом, потому что это может привести к пожару.
Эта стирка должна быть сделана с чистой водой. Если водопроводная вода не чистая, промойте мазок фильтрованной или дистиллированной водой, желательно.
Покройте мазок кислым спиртом
Этот кислый спирт должен быть на 3%. Покрытие проводится в течение 5 минут или до тех пор, пока мазок не станет достаточно обесцвеченным, то есть бледно-розовым.
Необходимо учитывать, что кислотный спирт легко воспламеняется; поэтому, это должно использоваться очень осторожно. Избегайте быть рядом с источниками возгорания
Мытье должно быть чистой дистиллированной водой.
Покройте мазок красителем
Это может быть зеленый малахитовый (0,5%) или метиленовый синий (0,3%) краситель в течение 1 или 2 минут, используя самое продолжительное время, если мазок тонкий.
истощать
Задняя часть предметного стекла должна быть очищена, и пятно должно быть помещено на дренажную полку, чтобы она была высушена на воздухе (не используйте абсорбирующую бумагу для сушки).
Изучите мазок в микроскоп
Следует использовать объектив 100X и иммерсионное масло. Сканируйте мазок систематически и запишите соответствующие наблюдения.
Интерпретировать результаты
Теоретически, микроорганизмы, окрашенные в красноватый цвет, считаются кислотоустойчивыми (AAR +).
Напротив, если микроорганизмы окрашены в синий или зеленый цвет, в зависимости от красителя, используемого в качестве контр-красителя, они считаются кислотой, устойчивой к воздействию алкоголя (AAR-)..
фундамент
В основе этой техники окрашивания лежат свойства клеточных стенок этих микроорганизмов. Стенка образована жирными кислотами, называемыми миколиновой кислотой; Они характеризуются очень длинными цепями.
Когда жирные кислоты имеют очень длинную структуру, они могут легче удерживать красители. Некоторые роды бактерий очень трудно окрашивать по Граму, из-за высокого содержания миколевой кислоты в клеточной стенке.
В окраске Циля-Нильсена используется фенольное соединение карбол-фуксин, основной краситель. Это имеет способность взаимодействовать с жирными кислотами клеточной стенки, которая имеет восковую текстуру при комнатной температуре.
Окрашивание карболом фуксина улучшается в присутствии тепла, потому что воск плавится и молекулы красителя быстрее перемещаются в клеточную стенку.
Кислота, которая используется позже, служит для обесцвечивания клеток, которые не были окрашены, потому что их стенка была недостаточно связана с красителем; следовательно, прочность кислотного обесцвечивателя способна удалять кислотный краситель. Клетки, которые противостоят этому обесцвечиванию, называются кислотоустойчивыми.
Вторичная окраска
После обесцвечивания образца это контрастирует с другим красителем, называемым вторичным красителем. Обычно используется метиленовый синий или малахитовый зеленый.
Вторичный краситель окрашивает фоновый материал и, следовательно, создает контраст со структурами, которые были окрашены на первом этапе. Только обесцвеченные клетки поглощают второй краситель (против пятен) и приобретают свой цвет, в то время как кислотостойкие клетки сохраняют красный цвет.
Эта процедура часто используется для идентификации Микобактерии туберкулеза и Mycobacterium leprae, которые называются кислотоустойчивыми бациллами.
Кислотоустойчивые бактерии и их окраска по методу Циля-Нильсена
Метод назван именами немецких медиков — микробиолога Франца Циля (1857—1926) и патологоанатома Фридриха Нельсена (1854—1898), которые разработали его в 1882—1883 гг.
Метод окраски микроорганизмов для выявления кислотоустойчивых микобактерий (возбудителей туберкулёза, микобактериозов, лепры), актиномицетов и других кислотоустойчивых микроорганизмов.
— Фиксированный на пламени горелки мазок окрашивают в течение 3 – 5 мин. раствором карболового фуксина Циля или окрашенной фуксином бумажкой с подогреванием до появления паров, но не доводя краситель до кипения.
— Дают препарату остыть, бумажку снимают, сливают избыток красителя, препарат промывают водой.
— Окрашенный препарат обесцвечивают 5%-ным раствором серной кислоты в течение 3 – 5 с или 96° этиловым спиртом, содержащим 3% по объему хлористоводородной кислоты, несколько раз погружая стекло с мазком в стаканчик с солянокислым спиртом.
— После обесцвечивания остаток кислоты сливают и тщательно промывают препарат водой.
— Докрашивают дополнительно метиленовым синим Леффлера 3 – 5 мин.
— Окрашенный препарат промывают водой, подсушивают и микроскопируют.
При окраске препаратов кислоустойчивые бактерии окрашиваются фуксином в рубиново-красный цвет и не обесцвечиваются кислотой.
Некислотоустойчивые бактерии, а также элементы ткани и лейкоциты под действием кислоты обесцвечиваются и приобретают цвет дополнительного красителя.
Механизм взаимодействия антигена и антитела.
В н в предложены 2 гипотезы, объясняющие мехнизм реакции между антигеном и антителом: гипотеза Маррека (теория «решетки») и гипотеза Полинга (теория «фермы»).
Маррек полагает, что при соединении антигена с антителом их молекулы располагаются в чередующемся порядке, образуя решетчатые агломераты. Он предложил схему возможных соединений антигена с антителом. При оптимальных соотношениях антигена и антитела образуются прочные комплексы, которые, постепенно увеличиваясь в размерах, становятся видимыми невооруженным глазом. При избытке антигена образуются мелкие, растворимые, невидимые глазом соединения, так как каждый активный центр антитела: «заполнен» молекулой антигена. При избытке антител образующиеся мелкие комплексы также не могут быть связаны вместе из-за отсутствия антигена в достаточном количестве, вследствие чего образование больших агломератов отсутствует.
Гипотеза Полинга основана на предположении, что антитела имеют только две специфические полярные группы (двухвалентны), а антиген поливалентен, т.е. имеет несколько детерминантных групп. Поэтому при соединении антигена с антителом образуются агломераты, напоминающие «фермы». При оптимальных соотношениях антигена и антитела происходит полное насыщение всех их валентностей, в результате чего образуются прочные комплексы, выпадающие в осадка. При избытке антигена в зависимости от его количества образуются мелкие или рыхлые агломераты и выпадение осадка задерживается. При избытке антител многие валентности их остаются незаполненными и образование комплексов становится невозможным.
Соединение антигена и антитела не носит характера прочной химической реакции, поскольку после получения комплекса антиген — антитело его можно разделить на составные части.
Возбудитель возвратного тифа (эпидемического и эндемического), его характеристика и свойства. Источник инфекции и пути заражения. Методы лабораторной диагностики. Препараты для лечения и профилактики.
Эпидемический возвратный тиф Borellia reccurentis
Эндемический возвратный тиф B.dutoni, B.hispanica, B.persica, B.caucasica
Извитые бактерии, имеющие кр неравномерные завитки и заостренные концы. Спор и капсул не имеют. Подвижны за счет микрофибрилл. По Романовскому-Гимзе окрашиваются в сине-фиолетовый цвет.
| Эпидемиология | Эпидемический возвратный тиф Borellia reccurentis ИИ-больной человек Механизм передачи Пути передачи Гемоконтактный Трансмисивный Переносчики –головные и платянные вши. Эндемический возвратный тиф B.dutoni, B.hispanica, B.persica, B.caucasica Резервуар инфекции в природных очагах – грызуны, хищники, а также аргасовые клещи. Механизм передачи Пути передачи Гемоконтактный Трансмисивный |
| Микробиологическая диагностика | Батериологический -обнаружение в мазках крови бореллий в окраске по Романовскому-Гимзе |
| Специфическая профилактика Спец лечение | Не разработаны |
Билет №10
Дата добавления: 2018-04-04 ; просмотров: 1478 ; Мы поможем в написании вашей работы!
Источник
Окрашивание
Интересно, что термин кислотоустойчивые бактерии применяется к микроорганизмам, не в плане их экологических особенностей, а в том смысле, что они окрашиваются по Цилю-Нильсену и не обесцвечиваются после окраски слабыми растворами кислот и этанолом. Эти методы позволяют успешно выявлять кислотоустойчивые формы в мазках. Однако обнаружены и такие особенности этих бактерий, как устойчивость к повышенному содержанию в среде кислот и щелочей.
Стандартные методы окрашивания (например, окраска по Граму) не дают удовлетворительных результатов. Кислотоустойчивые бактерии окрашиваются по Граму, только если применяются большие концентрации красителей или высокие температуры. Такие препараты кислотоустойчивых бактерий можно длительно хранить.
Для выявления кислотоустойчивых бактерий в мазке применяют следующие препараты:
- Генциан фиолетовый, 1% феноловый или спиртовой раствор.
- Раствор Люголя, содержащий кристаллический йод и йодид калия.
- Этиловый спирт 96%.
- Фуксин Пфейффера (фуксин Циля смешивается с дистиллированной водой в пропорции 1:9).
Окраска производится после фиксации стандартных препаратов на пламени. После этого на него накладывают фильтровальную бумагу, смоченную фуксином Циля, и нагревают стекло над пламенем 5 минут, не допуская закипания жидкости. Препарат не должен высыхать. После завершения фиксации его промывают большим количеством воды под малым напором.
После высыхания мазка его обрабатывают слабыми растворами серной или соляной кислоты и еще раз промывают водой. Заключительным этапом является окраска метиленовым синим (краситель Леффлера).
Грам (+) и Грам (-) представители и их воздействие на организм
Итак, клеточная стенка грамположительных бактерий имеет лишь один слой. Единственное исключение, известное в современной микробиологии, – Deinococcus-Thermus. Несмотря на наличие защитной мембраны, при проведении теста она хорошо окрашивается в синий цвет.
Основными представителями Грам (+) бактерий являются:
- Кокковые или шаровидные (кроме протеобактерий Neisseria):
- стафилококк, провоцирующий сепсис крови и гнойные высыпания на коже;
- стрептококк, ведущий к развитию ревматизма и тонзиллитов;
- Палочковидные:
- фирмикуты, служащие источником сибирской язвы и токсических инфекций;
- клостридии, как возбудители столбняка и ботулизма;
- листерия, заражение которой приводит к воспалению мозга.
- Булавовидные:
Грамотрицательные бактерии, более устойчивые к антителам за счет дополнительной мембраны, представлены такими разновидностями:
- Спиралевидные:
- спирохеты, которые являются возбудителями лептоспироза, возвратного тифа и сифилиса;
- спириллы, вызывающие содоку – лихорадкоподобное состояние.
- Палочки:
- риккетсии, чей главной характеристикой служит внутриклеточный паразитизм;
- хламидии – без лечения могут развиться ЗППП, конъюнктивит, пневмония.
Разновидности
Методы выявления кислотоустойчивости разрабатывались для патогенных микроорганизмов – возбудителей туберкулеза и проказы. Однако постепенно среди кислотоустойчивых бактерий обнаружились сапрофитные формы, обладающие аналогичными свойствами клеточной стенки. Они имеют ряд отличий (быстрый рост в культуре, более быстрое или, наоборот, медленное обесцвечивание этанолом), однако для их выявления применяются такие же методы.
Аналогичное строение клеточной стенки наблюдается у большинства актиномицетов. Эти малоизученные микроорганизмы всегда присутствуют в пристеночной микрофлоре человека и животных. В случае ослабления иммунной системы хозяина, они способны вызывать состояния, напоминающие туберкулез.
Интерес к актиномицетам стал причиной того, что методы выявления бактерий с характерной клеточной стенкой начали применяться не только для изучения патогенных и сапрофитных бактерий человека и животных.
Так среди азотфиксирующих организмов были обнаружены бейеринкии (Beijerinckia), имеющие высокую устойчивость в средах с различной кислотностью. Выявлена неплохая кислотоустойчивость у некоторых азотфиксирующих клостридиумов (Clostridium). Исследования с применением изотопов позволили выявить азотфиксирующие формы среди актиномицетов (Actinomyces).
Окраска разведенным карболовым фуксином
Техника. На зафиксированный мазок наносят фуксин Циля, разведенный непосредственно перед окраской, дистиллированной водой в соотношении 1:10. Выдерживают 1-2 минуты, после чего смывают водопроводной водой, высушивают и микроскопируют.
Микроскопическая картина. Все клетки равномерно окрашиваются в розово-красный цвет.Приготовление и окраска препаратов для люминесцентной микроскопии
Препараты для люминесцентной микроскопии готовят так же, как для световой.
Это относится и к их фиксации. Окраска препаратов отличается тем, что для люминесцентной микроскопии применяют специальные красители – флуорохромы. Их отличительная особенность – способность светиться под воздействием ультрафиолетовых и сине-фиолетовых лучей. Среди флуорохромов встречаются самые разнообразные органические вещества. Для окраски микроскопических препаратов применяют очень слабо концентрированные (1:500-1:100000) растворы флуорохромов.
Растворы готовят на дистиллированной воде, изотоническом растворе хлорида натрия или буферных смесях и хранят в темной склянке, избегая действия света.
ссылки
- Апурба С. и Сандхья Б. (2016). Основы практической микробиологии (1-е изд.). Jaypee Brothers Медицинские Издательства.
- Бауман Р. (2014). Микробиология с заболеваниями по системе организма (4-е изд.). Pearson Education, Inc.
- Наследие, Дж., Эванс, Э. и Киллингтон, А. (1996). Вводная микробиология (1-е изд.). Издательство Кембриджского университета.
- Морелло, Дж., Гранато, П. Уилсон, М. и Мортон, В. (2006). Лабораторное руководство и рабочая тетрадь по микробиологии: приложения к уходу за пациентами (11-е изд.). Макгроу-Хилл Образование.
- Васантхакумари Р. (2007). Учебник по микробиологии (1-е изд.). B.I. Публикации PVT.
Приготовление препаратов для бактериоскопического исследования
Для бактериоскопического исследования готовят обычно два препарата: один для обнаружения микобактерий туберкулеза и другой для обнаружения прочих микроорганизмов. Для первого препарата отбирают те же частицы, которые были предназначены для микроскопии, для второго — гнойные частицы. Взятый материал распределяют по предметному стеклу до получения достаточно тонкой ажурной сеточки (материал на первом стекле распределяют на 2/3 его поверхности, на втором — в центре).
Оба препарата фиксируют троекратным проведением над пламенем горелки. Первый препарат окрашивают по Цилю — Нильсену, второй — по Граму.
ОКРАСКА КИСЛОТОУСТОЙЧИВЫХ БАКТЕРИЙ ПО ЦИЛЮ-НИЛЬСЕНУ.
Кислотоустойчивые бактерии отличаются высоким содержанием липидов в клеточной стенке. Они с трудом окрашиваются, но затем удерживают основной краситель при обесцвечивании кислотой. Некислотоустойчивые бактерии обесцвечиваются кислотой и окрашиваются дополнительным красителем. .
Mycobacterium tuberculosis в мокроте больного. Окраска по Цилю-Нильсену. Увеличение х___________________
ОКРАСКА СПОР ПО ОЖЕШКО.
Метод Ожешко сходен с методом Циля-Нильсена, но отличается использованием раствора соляной кислоты в качестве протравы, разрыхляющей оболочку споры, которая плохо воспринимает красители.
Окраска по Ожешко. Увеличение х_
ОКРАСКА ВОЛЮТИНА ПО НЕИССЕРУ.
При окраске метиленовым синим образуется нерастворимый в воде комплекс: краситель + волютин. При промывке водой тело микробной клетки обесцвечивается, а гранулы волютина сохраняют синюю окраску. Тело клетки затем докрашивается везувином в желтый цвет.
Corynebacterium diphtheriae. Окраска по Нейссеру. Увеличение х_
БАКТЕРИОСКОПИЧЕСКИЙ МЕТОД ДИАГНОСТИКИ
Бактериоскопический метод диагностики -______________________________ ____________________________________________________________________________________________________________________________________
Метод используется для диагностики заболеваний, возбудители которых обладают характерными морфологическими, тинкториальными свойствами и типичной локализацией в организме. Например: гонорея, сифилис, возвратные тифы, туберкулез, некоторые микозы.
Показания к применению метода
При подозрениях на туберкулез исследуется мокрота больного. Длительный кашель с обильными выделениями является показанием для проведения подобного исследования. Визуально наличие возбудителей туберкулеза в организме может выдать мокрота характерной жидкой, пенистой консистенции и признаками гноя, а также мокрота, смешанная с кровью. Обнаружение возбудителей туберкулеза – рисовидных телец, известных также как линзы Коха, облегчается при использовании методов окраски образца. Таких как вышеописанный метод Циля-Нильсена или метод Грама, суть которого будет описана ниже.
Рекомендации
- https://www.microrao.com/micronotes/acidfast.htm
- https://paramedicsworld.com/microbiology-practicals/acid-fast-staining-principle-procedure-interpretation/medical-paramedical-studynotes
- https://microbeonline.com/ziehl-neelsen-technique-principle-procedure-reporting/
- https://labhelpline.com/2019/05/23/ziehl-neelsen-staining-technique-for-acid-fast-bacilli/
- https://www.uwyo.edu/virtual_edge/units/acidfast_stain.html
- https://www.ncbi.nlm.nih.gov/pubmed/17533853/
- https://www.differencebetween.com/difference-between-acid-fast-and-vs-non-acid-fast-bacteria/
- https://www.onlinebiologynotes.com/acid-fast-staining-ziehl-neelsen-technique/
- https://microbiologyinfo.com/acid-fast-stain-principle-procedure-interpretation-and-examples/
- https://www.carolina.com/specialty-chemicals-a/acid-alcohol-3-hydrochloric-acid-in-95-ethanol-laboratory-grade-500-ml/841733.pr
- http://whocctblab.fondazionesanraffaele.it/uploads/2/0/8/2/20828554/_ios_ebp-ziehl-neelsen_staining.pdf
- https://www.researchgate.net/post/Why_Are_Mycobacteria_Acid_Fast
- https://quizlet.com/145783763/microbiology-hw-quiz-flash-cards/
- https://en.wikipedia.org/wiki/Kinyoun_stain
- https://en.wikipedia.org/wiki/Acid-fastness
- https://en.wikipedia.org/wiki/Ziehl%E2%80%93Neelsen_stain
Подготовка пятен для окрашивания по Цилю-Нильсену (окрашивание ZN)
Растворы красителей
Карбол-фуксин Циля (раствор А)
- 3% спиртовой маточный раствор фуксина
- Основной фуксин —— 3 г
- Спирт 95% ——- до 100 мл
- Поместите необходимое количество фуксина в мерную колбу (или цилиндр) и добавьте достаточное количество этанола или метилового спирта, чтобы общий объем составил 100 мл. Энергично встряхните, пока фуксин не растворится.
- Перед окрашиванием небольшие порции этого раствора необходимо профильтровать.
Водный раствор фенола (раствор Б)
| Кристаллы фенола | 5 гр |
| Дистиллированная вода, если можно | до 90 мл |
Перед добавлением воды слегка подогрейте кристаллы фенола в колбе, чтобы они растворились.
Для приготовления рабочего раствора науглероженного фуксина Циля соедините 10 мл раствора А с 90 мл раствора Б.
Растворы отбеливающих средств
Спиртово-кислотный раствор
| Алкоголь 95% | 970 мл |
| Концентрированная соляная кислота (35%) | 30 мл |
Или когда алкоголь недоступен:
25% водный раствор серной кислоты:
| Вода, по возможности дистиллированная | 300 мл |
| Концентрированная серная кислота | 100 мл |
Налейте 300 миллилитров воды в литровую колбу Эрленмейера. Медленно вливайте 100 мл чистой серной кислоты по краю колбы по мере добавления. Смесь нагреется.
Никогда не добавляйте воду в концентрированную серную кислоту, так как это может привести к взрыву.
Шаги/процедура окрашивания Ziehl Neelsen Stain
Приготовление мазка
- Возьмите обезжиренное слайд.
- Стерилизовать инокуляционную петлю с помощью горелки Бунзена. Держите его на огне, пока он не станет ярко-красным.
- Используйте стерильную петлю, чтобы перенести полную культуру петли на предметное стекло, а затем приготовьте мазок.
- Высушите мазок на воздухе.
- Нагрейте высушенный мазок, пропуская его через пламя горелки Бунзена.
Процедура кислотостойкого окрашивания
- Равномерно распределите мокроту по центральной поверхности лезвия непрерывным вращательным движением; мы рекомендуем распространение примерно 20 мм на 10 мм.
- Поместите предметные стекла на сушилку раскладывающей поверхностью вверх и дайте примерно 30 минут для высыхания на воздухе.
- Восстановите высушенные предметные стекла, захватив их плоскогубцами и пропустив над пламенем пять раз в течение примерно четырех секунд так, чтобы расправленная сторона была обращена к пламени. Не сушите мокрые доски теплом и избегайте перегрева.
Окрашивание
- Поместите фиксированные предметные стекла на штатив для окрашивания размазанной стороной вверх в соответствии с их порядковым номером. Лезвия должны быть разделены на 1 см и никогда не соприкасаться друг с другом.
- Накройте предметные стекла последовательно отфильтрованным рабочим раствором Ziehl’s 0.3% карболового фуксина.
- Если вставить полоску впитывающей бумаги, такой как фильтровальная бумага или даже газета, красящий раствор сохранится, и на мазке не будут образовываться кристаллы фуксина.
- С помощью пламени горелки Бунзена, спиртовки или ватного тампона, смоченного в спирте, нагревайте предметные стекла снизу до образования пара. Раствор красителя ни в коем случае нельзя кипятить. Избегайте высыхания красителя.
- Покройте предметные стекла горячим и дымящимся раствором карболового фуксина на пять минут, при необходимости проглаживая пламя.
- Аккуратно промойте слайды водой, чтобы устранить избыток карболового фуксина.
- Слейте излишки воды после промывки предметных стекол. Пятна мокроты окрашены в красный цвет.
обесцвечивание
- После трехминутного воздействия на предметные стекла 25% раствором серной кислоты или спиртовой кислоты красный оттенок должен был в основном исчезнуть. При необходимости повторите эту процедуру еще в течение двух минут.
- Вода должна использоваться для мягкого удаления серной кислоты, спиртовой кислоты и избытка пищевого красителя. Удалите излишки воды с предметных стекол.
Контрастное окрашивание
- Покройте слайды один за другим раствором для контрастного окрашивания (0.3% метиленового синего) и подождите 1 минуту, чтобы раствор подействовал.
- Промойте каждое стекло отдельно водой
- Слейте воду и дайте слайдам высохнуть на воздухе.
Вид правильно окрашенного мазка под действием метиленового синего светло-голубой. Если оттенок темно-синий, мазок слишком густой; текст не может быть прочитан через слайд в этих условиях.
| реактив | Кислотно-быстрый | Некислотный быстрый |
| Карбол Фуксин с теплом | Красный (ярко-розовый) | Красный (ярко-розовый) |
| Кислотный спирт | Red | Бесцветный |
| Метиленовый синий/Малахитовый зеленый | Red | Цвет морской волны |
Ziehl Neelsen Stain Steps | Создано с BioRender.com
Суть метода
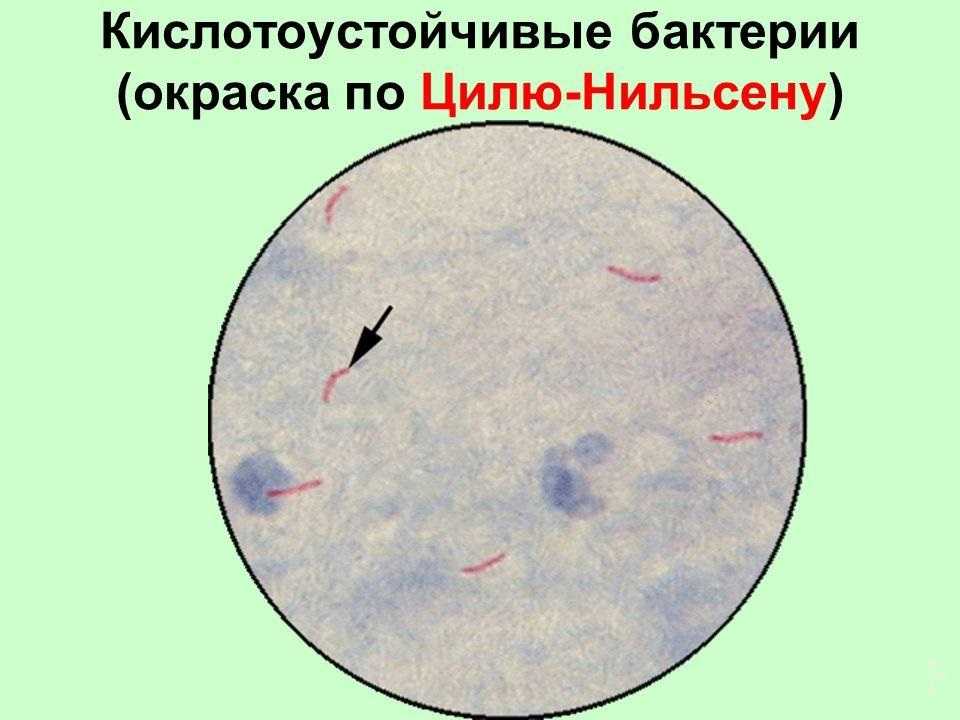
Окрашивание по Цилю-Нильсену позволяет окрасить бактерии, которые устойчивы к воздействию кислот. К таким относятся возбудители туберкулёза, в том числе легочных форм, и лепры. При данной диагностической пробе их окраска получается контрастной по отношению к остальной части мазка.
Сначала подготовленный мазок обрабатывают фуксином Нильсена, нагревают на горелке. Это повторяют несколько раз, добавляя краситель. Затем излишки фуксина смывают водой и обесцвечивают мазок раствором серной кислоты. Следующий этап — окраска метиленовым синим, к которому чувствительно всё, кроме кислотоустойчивых бактерий и структур.
Для диагностики туберкулёза лёгких используют различные методы исследования мокроты, которая выделяется при кашле у пациентов с этой патологией. Этот способ диагностики позволяет дифференцировать болезнь и подтвердить факт выделения микобактерий в окружающую среду.
Обеззараживание мокроты, посуды и предметов, бывших в соприкосновении с ней
После проведенного исследования мокроту сжигают или обеззараживают. Последнее достигается следующими способами: а) автоклавированием в течение одного часа при 1,5 атм.; б) кипячением в течение одного часа в 1-2% растворе соды; в) обработкой 5% раствором лизола, карболовой кислоты или смесью, состоящей из равных объемов 5% раствора хлорамина и 5% раствора сернокислого аммония, в течение 12-24 часов. После обеззараживания посуду тщательно моют водой и высушивают.
Металлические предметы (шпатели, иглы) обеззараживают прокаливанием над огнем. Во избежание переноса микроорганизмов из одной порции мокроты в другую шпатель и иглу немедленно прокаливают после отбора соответствующих частиц.
Покровные стекла опускают в небольшую плоскую чашечку с 40% раствором серной кислоты на 12-24 часа. Затем кислоту сливают, а стекла неоднократно промывают водопроводной и дистиллированной водой. Вымытые стекла высушивают и используют для последующих исследований.
Что такое окрашивание по Цилю-Нильсену (окрашивание ZN)?
Окрашивание по Цилю-Нильсену — это метод окрашивания кислотоустойчивых бактерий, а также еще одна важная процедура дифференциального окрашивания, используемая для различения кислотоустойчивых и некислотоустойчивых бактерий. Вы, должно быть, думаете, что такое кислотостойкое окрашивание? Это процедура окрашивания, при которой бактерии различаются по их способности удерживать краситель при промывании кислым спиртовым раствором. Он в основном различает кислотоустойчивые и некислотоустойчивые бактерии.
Этот метод кислотоустойчивого окрашивания используется для идентификации Микобактериальный туберкулез и М. лепры. Эти два патогена ответственны за туберкулез и проказу соответственно. Они обладают липидсодержащей клеточной стенкой, состоящей из миколовой кислоты, группы гидроксижирных кислот с разветвленной цепью, что предотвращает связывание красителя с клеточной стенкой.
При окрашивании по Цилю-Нильсену мы используем высокую концентрацию фенола и карболового фуксина, а также смачивающее вещество, чтобы ввести краситель карболовый фуксин в клетки микобактерий. Как только этот краситель проник в клетки, клетки не обесцвечиваются подкисленным спиртом (кислотно-спиртовым), и поэтому говорят, что они кислотоустойчивы. Некислотоустойчивые бактерии легко обесцвечиваются кислым спиртом и, таким образом, окрашиваются в другой цвет вторым красителем, называемым контрастным красителем.
Этот метод окрашивания был впервые предложен Паулем Эрлихом и модифицирован двумя немецкими врачами Францем Цилем (бактериолог) и Фридрихом Нильсеном (патологоанатом).
Роберт Кох открыл причину туберкулеза в 1882 году. Пауль Эрлих создал краситель квасцового гематоксилина для микобактерий туберкулеза вскоре после открытия Коха. Затем Франц Зиль модифицировал метод окрашивания Эрлиха, используя карболовую кислоту в качестве протравы. Фридрих Нильсен сохранил выбранную Цилем морилку, но заменил основное пятно карболовым фуксином. Вместе корректировки Циля и Нильсена дали окрашивание Циля-Нильсена. Джозеф Киньюн создал второе кислотостойкое окрашивание, исключив стадию нагревания в методе окрашивания Циля-Нильсена. Пятно Киньюна — это название этого нового пятна.
Способы окраски бактерий
Простой метод окраски
Препарат помещают на подставку для окраски, исследуемым материалом вверх. Пипеткой наносят на него раствор красителя
По истечении указанного времени краситель осторожно сливают, препарат промывают водой и высушивают фильтровальной бумагой. При простом методе используют один краситель
Метиленовым синим и щелочным синим Леффлера окрашивают препарат в течение 3-5 мин, фуксином Пфейффера — 1-2 мин.
На окрашенный и высушенный препарат наносят каплю иммерсионного масла и микроскопируют с помощью иммерсионной системы.
Сложные методы окраски
Окраска по Граму (универсальный метод). Наиболее распространенным методом дифференциальной окраски является окраска по Граму.
В зависимости от результатов окраски все микроорганизмы делят на две группы — грамположительные и грамотрицательные.
Грамположительные бактерии содержат в клеточной стенке магниевую соль РНК, которая образует комплексное соединение с йодом и основным красителем (генциановым, метиловым или кристаллическим фиолетовым). Этот комплекс не разрушается при действии спирта, и бактерии сохраняют фиолетовый цвет.
Грамотрицательные бактерии не способны удержать основной краситель, так как не содержат магниевой соли РНК. Под действием спирта краситель вымывается, клетки обесцвечиваются и окрашиваются дополнительным красителем (фуксином) в красный цвет.
- На препарат накладывают бумажку по Синеву и наносят несколько капель воды или раствор генцианового фиолетового. Окрашивают 1-2 мин. Снимают бумагу или сливают краситель.
- Не промывая водой, наносят раствор Люголя до почернения (1 мин), затем краситель сливают.
- Не промывая водой, наносят 96% спирт до отхождения красителя (30-60 с). Можно опустить препарат в стаканчик со спиртом на 1-2 с.
- Промывают препарат водой.
- Докрашивают фуксином Пфейффера 3 мин, промывают водой и высушивают.
Микроскопируют с помощью иммерсионной системы.
Окраска по Цилю — Нильсену (для кислотоустойчивых бактерий). Этот метод применяют для выявления бактерий туберкулеза и проказы, имеющих в оболочке клеток большое количество липидов, воска и оксикислот. Бактерии кислото-, щелоче- и спиртоустойчивы. Для увеличения проницаемости клеточной стенки первый этап окрашивания проводят при подогревании.
- Фиксированный препарат покрывают фильтровальной бумагой и наносят фуксин Циля. Удерживая стекло пинцетом, препарат подогревают над пламенем горелки до отхождения паров. Добавляют новую порцию красителя и подогревают еще 2 раза. После охлаждения снимают бумагу и промывают препарат водой.
- Препарат обесцвечивают 5% раствором серной кислоты, погружая 2-3 раза в раствор или наливая кислоту на стекло, затем несколько раз промывают водой.
- Окрашивают водно-спиртовым раствором метиленового синего в течение 3-5 мин, промывают водой и высушивают.
Микроскопируют с помощью иммерсионной системы.
Кислотоустойчивые бактерии окрашиваются в красный цвет, остальные — в синий.
Окраска по Ожешко (выявление спор).
- На высушенный на воздухе мазок наливают несколько капель 0,5% раствора хлороводородной кислоты и подогревают до образования паров. Препарат высушивают и фиксируют над пламенем.
- Окрашивают по способу Циля — Нильсена. Кислотоустойчивые споры окрашиваются в розово-красный, а бактериальная клетка — в голубой цвет.
Окраска по Бурри — Гинсу (выявление капсулы). Этот метод назван негативным, так как окрашивается фон препарата и бактериальная клетка, а капсула остается неокрашенной.
На предметное стекло наносят каплю черной туши, разведенной в 10 раз. В нее вносят каплю культуры. Ребром шлифовального стекла делают мазок, так же как мазок крови, и высушивают.
Фиксируют химическим способом спиртом или сулемой
Осторожно промывают водой.
Окрашивают фуксином Пфейффера 3-5 мин. Осторожно промывают и высушивают на воздухе.
Микроскопируют с помощью иммерсионной системы. Фон препарата черный, клетки — красные, капсулы — неокрашенные.
Прижизненная окраска микроорганизмов
Для изучения живой культуры используют чаще всего метиленовый синий и другие красители в больших разведениях (1:10000). Каплю исследуемого материала смешивают на предметном стекле с каплей красителя и накрывают покровным стеклом. Микроскопируют с помощью объектива 40×.






























