Опыт 8. Окисление дисахаридов
Дисахариды – это углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счёт взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой).Связи, соединяющие моносахаридные остатки, называются гликозидными.
Примером наиболее распространенных в природе дисахаридов является сахароза (свекловичный или тростниковый сахар). Молекула сахарозы состоит из остатков глюкозы и фруктозы, соединенных друг с другом за счет взаимодействия полуацетальных гидроксилов (1→2)-гликозидной связью:
Сахароза, находясь в растворе, не вступает в реакцию «серебряного зеркала», так как не способна превращаться в открытую форму, содержащую альдегидную группу. Подобные дисахариды не способны окисляться (т.е. быть восстановителями) и называются невосстанавливающими сахарами.
Существуют дисахариды, в молекулах которых имеется свободный полуацетальный гидроксил, в водных растворах таких сахаров существуют равновесие между открытой и циклической формами молекул. Эти дисахариды легко окисляются, т.е. являются восстанавливающими, например, мальтоза.
В мальтозе остатки глюкозы соединены (1→ 4)-гликозидной связью.
Для дисахаридов характерна реакция гидролиза (в кислой среде или под действием ферментов), в результате которой образуются моносахариды:
При гидролизе различные дисахариды расщепляются на составляющие их моносахариды за счёт разрыва связей между ними (гликозидных связей):
Таким образом, реакция гидролиза дисахаридов является обратной процессу их образования из моносахаридов.
Принцип метода. В зависимости от способа связи моносахаридов в молекулах дисахаридов они проявляют разную способность к окислению.
Положительную реакцию с фелинговой жидкостью дают восстанавливающие дисахариды (мальтоза и лактоза), в водных растворах которых вследствие таутомерных переходов имеются свободные альдегидные группы. Раствор, содержащий сахарозу, при нагревании до начинающегося кипения не изменяет своей окраски, так как сахароза относится к невосстанавливающим дисахаридам и не окисляется реактивом Фелинга.
Схема реакции окисления мальтозы реактивом Фелинга:
мальтоза реактивом Фелинга
Уравнение реакций окисления лактозы реактивом Фелинга::
|
|
H
C H O O C H
+ Cu
C H O O C H
H
+ 2 + Cu2O + H2O
Порядок выполнения работы.
В 3 пробирки наливают по 2 мл. 1%-ного раствора сахарозы, мальтозы и лактозы. В каждую пробирку добавляют столько же фелинговой жидкости (Реактива Фелинга, представляет собой щелочной раствор комплексного соединения сульфата меди (II) с виннокислым калий-натрием в 10%-ном р-ре NaOH. Готовят непосредственно перед употреблением.). Затем все пробирки нагревают до начинающегося кипения. В пробирке с сахарозой восстановления меди не наблюдается, в двух других появляются осадки оксида меди (I).
Оксид меди, химическое соединение меди и кислорода, существующее в двух формах: закиси (Сu ₂О), блестящий красный порошок, встречающийся в природе в виде минерала куприта, и окиси (СuО), черного цвета.
Оформление работы: объясните различное взаимодействие гидроксида меди (II) с дисахаридами. Составьте уравнения реакции окисления мальтозы и лактозы.
Лабораторные работы по органической химии (стр. 10 )
| Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 11 12 |
Необходимо помнить, что для изображения пространственной конфигурации циклических форм моносахаридов пользуются проекционными формулами Фишера или перспективными формулами Хеуорса.
Моносахариды – соединения со смешанными функциями, т.е они имеют в молекуле альдегидную и кетонную группы и несколько спиртовых. Поэтому нужно писать реакции с монозами по всем функциональным группам.
Уясните, какой гидроксил называется полуацетальным (гликозидным) и чем его свойства отличаются от спиртовых гидроксилов.
Изучение полисахаридов надо начинать со знакомства с их строением, с отличительных особенностей – структурных формул крахмала и клетчатки, знать особенности ? и ? — гликозидных связей, а также биологическое и практическое значение этих полисахаридов.
В процессе освоения класса углеводов большое внимание необходимо обратить на эфиры сахаров, и в первую очередь на фосфорные эфиры, т.к. они занимают особое место в синтезе и распаде сахаров
ФЕЛИНГА РЕАКТИВ
ФЕЛИНГА РЕАКТИВ (фелингова жидкость), р-р CuSO 4 и тартрата калия-натрия в 10%-ном р-ре NaOH; реактив на восстановители, гл. обр. альдегиды и моносахариды. Готовят непосредственно перед употреблением. Р-цию проводят, добавляя к 10 мл Фелинга реактива ок. 0,5 мл или 0,25-0,5 г исследуемого в-ва. При анализе нелетучих соед. смесь нагревают сразу, а при анализе летучих соед. ее предварительно выдерживают при комнатной т-ре. В присут. восстановителей после нагревания осаждается оксид или гидроксид меди(I); цвет осадка от желтого до красного, иногда зеленого в зависимости от степени дисперсности и размера его частиц.
Аналогично реагируют кетозы (последние в щелочной среде легко изомеризуются в альдозы), многоатомные фенолы, фенилгидразин и др. орг. производные гидразина, а также гидразиды карбоновых к-т. Кетоны (за исключением кето-спиртов), одноатомные фенолы и большинство ароматич. альдегидов не восстанавливают Фелинга реактив. Однако, напр., 2,4-ди-гидроксибензальдегид реагирует с ним. Для обнаружения углеводов иногда используют т. наз. нейтральный Фелинга реактив, к-рый вместо NaOH содержит Na 2 CO 3 .
Ароматич. гидразины взаимод. с Фелинга реактивом с выделением газообразного N 2 ; на этом основаны разл. объемные методы их определения. Фелинга реактив применяют и для количеств, определения восстанавливающих Сахаров. Для определения алифатич. альдегидов чаще используют реактив Бенедикта (содержит CuSO 4 , цитрат Na и Na 2 CO 3 ), к-рый более чувствительный.
Фелинга реактив предложен Г. Фелингом в 1849.
Лит.: Файгл ь Ф., Капельный анализ органических веществ, пер. с англ., M., 1962, с. 168-69; Полюдек-Фабини Р., Бейрих Т., Органический анализ, пер. с нем., Л., 1981, с. 11, 512. H. К. Куцева.
Источник
Характеристика химической активности углеводов.
В соответствии с наличием функциональных групп сахара дают реакции характерные для альдегидов и многоатомных спиртов. Однако существование сахаров в различных таутомерных формах приводит к тому, что эти реакции проводят в иных условиях.
Реакции на альдегидную группу
1.Реакции окисления( «серебряного зеркала»- (р-в Толленса) и реактивом Фелинга) – проводятся в тех же условиях, что и для альдегидов, но в присутствии очень малого количества щелочи (рН 7-8), т.к. избыток щелочи (рН 9-10) вызывает глубокие изменения в молекуле. Окисление в слабощелочной среде ведет у глюкозы к образованию глюконовой кислоты и окислению только по альдегидной группе:
|
НОН2С – (СНОН) – С НОН2С – (СНОН) – С рН 7-8
|
1) С реактивом Толленса (AgNO3 + 2NH4OH) при нагревании выпадает темный осадок серебра (глюкоза, галактоза, лактоза)
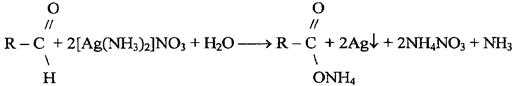
2) С реактивом Фелинга (глюкоза, галактоза, лактоза). При длительном стоянии или нагревании до кипения (по ФС) идет окислительно–восстановительная реакция с образованием кирпично-красного осадка Сu2O. (см. ФА альдегиды).
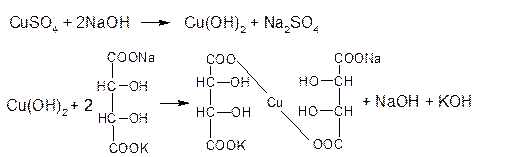
Комплекс синего цвета желтый
2CuOH↓ → Cu2O↓ + H2O
Желтый кирпично-красный осадок
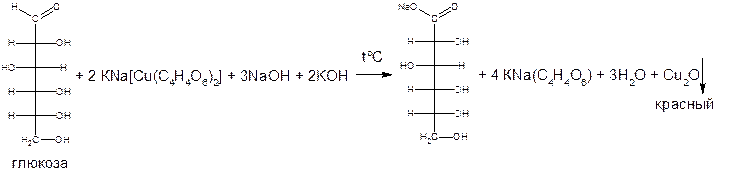
2.Реакции конденсации. Окрашенные продукты конденсации получают при взаимодействии моносахаридов (или гидролизованных дисахаридов)
а) с раствором антрона в концентрированной серной кислоте. Появляется зеленое окрашивание, постепенно переходящее в сине-зеленое.
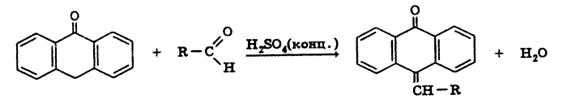
б) с трифенилтетразолия хлоридом (0,5%) в щелочной среде гидроксида натрия при нагревании только восстанавливающие сахара (глюкоза, галактоза, лактоза). Выпадает красный осадок трифенилформазана.
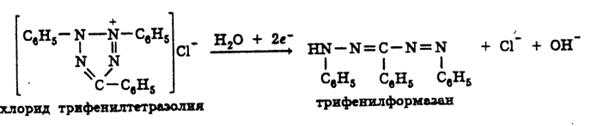
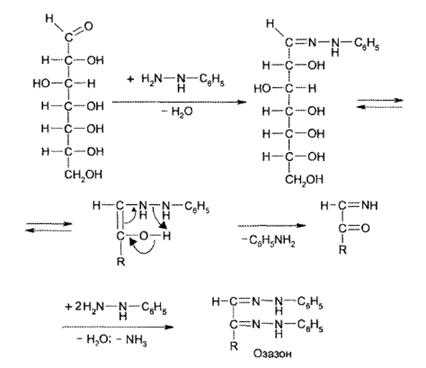
в) с фенилгидразином – реакция образования озазонов.
Растворы глюкозы, галактозы и лактозы образуют (альдегидная группа) выпадающие в осадок фенилгидразоны в кислой среде. При последующем нагревании на водяной бане в ходе перегруппировки и внутримолекулярной окислительно-восстановительной реакции получается окрашенный в желтый цвет осадок озазона.
Озазоны – кристаллические вещества с четкой Т°пл.
Реакция широко используется для установления подлинности восстанавливающих сахаров. Глюкоза взаимодействует с тремя молекулами фенилгидразина, а сахароза не дает положительной реакции.
 или
или 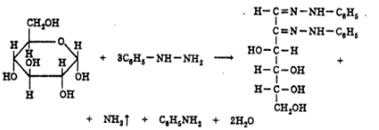
Реакции на спиртовую группу
1. Реакции этерификации по спиртовому гидроксилу.
2. Как многоатомные спирты образуют в присутствии эквивалентного количества натрия гидроксида глюкоза, галактоза и лактоза с раствором меди (II) сульфата растворимый комплекс синего цвета, сахароза с раствором кобальта (II) нитрата комплекс фиолетового цвета.
Амины
Аминами называются производные углеводородов, образованные замещением в последних атомов водорода на группы – NH2, -NHR или -NRR1.
Амины можно рассматривать и как производные аммиака, в молекуле которого атомы водорода замещены на углеводородные радикалы. Однозамещенные производные аммиака называют первичными, двухзамещенные – вторичными, трехзамещенные – третичными аминами.
Химическое поведение аминов определяется наличием в их молекуле аминогруппы. На внешней электронной оболочке атома азота пять электронов, в молекуле амина, как и в молекуле аммиака, азот затрачивает на образование трех ковалентных связей три электрона, а два электрона остаются свободными (неподеленная пара электронов).
Реакция Фелинга
Принцип реакции:в реактиве Фелинга ионы меди (II) находятся в виде комплексного соединения с тартратами. Механизм реакции гексоз (и всех редуцирующих углеводов) с реактивом Фелинга такой же, как и в реакции Троммера. Преимуществом реактива Фелинга является то, что медь при избытке реактива не выпадает в виде окиси меди (II). Дисахариды и полисахариды взаимодействуют с реактивом Фелинга после кипячения с минеральными кислотами.
Материалы и реактивы: раствор глюкозы (5%-ный); реактив Фелинга, который состоит из двух растворов. Для приготовления первого раствора 200 г сегнетовой соли и 150 г гидроксида натрия растворяют в дистиллированной воде и доводят объём до 1 дм 3 . Для приготовления второго раствора 40 г перекристаллизованного сульфида меди растворяют в дистиллированной воде до объёма 1 дм 3 . Равные объёмы первого и второго растворов смешивают перед работой.
Оборудование: стеклянные палочки, пробирки, пипетки градуировочные, штатив для пробирок, горелка.
Порядок проведения работы: в пробирку вносят 1 см 3 раствора глюкозы и 1 см 3 реактива Фелинга. Смесь перемешивают и нагревают в пламени горелки до кипения. Наблюдают образование красного осадка гемиоксида меди.
Источник
Фелинг
Раствор Фелинга приготовляют, смешивая растворы I и II. Раствор I получают растворением 34 6 г пятиводного сульфата меди в 500 мл воды, содержащей несколько капель серной кислоты. Для приготовления раствора II 60 г гидрата окиси натрия и 173 г тетрагидрата виннокислого калия-натрия ( CiHUOeKNa — 4Н2О) растворяют в воде и разбавляют до 500 мл.
Реактив Фелинга применяется для открытия и определения восстановителей, например альдегидов и саха-ров.
Реактивом Фелинга проводить окисление более удобно, чем гидроокисью меди Си ( ОН) 2 в присутствии щелочи, так как при добавлении большего количества сернокислой меди, чем указано в опыте 104, может пройти побочная реакция образования избытка гидроокиси меди Си ( ОН) 2 и частично окиси меди ( II) СиО черного цвета. При окислении реактивом Фелинга сегнетова соль связывает избыток гидроокиси меди ( II) Си ( ОН) 2 и основная реакция окисления глюкозы протекает быстрее и более четко.
Реактив Фелинга применяется для открытия и определения восстановителей, например альдегидов и Сахаров.
Реактивом Фелинга проводить окисление удобнее, чем гидроокисью меди Си ( ОН) 2 в присутствии щелочи, так как при добавлении большего количества сернокислой меди, что указано в опыте 194, может пройти побочная реакция образования избытка гидроокиси меди ( II) Си ( ОН) 2 и частично окиси меди ( II) СиО черного цвета. При окислении реактивом Фелинга сегнетова соль связывает избыток гидроокиси меди ( II) Си ( ОН) 2 и основная реакция окисления глюкозы протекает быстрее и более четко.
Реактив Фелинга применяется для открытия и определения восстановителей, например альдегидов и Сахаров.
Реактивом Фелинга проводить окисление удобнее, чем гидроксидом меди Си ( ОН) 2 в присутствии щелочи, так как при добавлении большего количества сернокислой меди, что указано в опыте 171, может пройти побочная реакция образования избытка гидроксида меди ( II) Си ( ОН) 2 и частично оксида меди ( II) СиО черного цвета. При окислении реактивом Фелинга сегнетова соль связывает избыток гидроксида меди ( II) Си ( ОН) 2 и основная реакция окисления глюкозы протекает быстрее и более четко.
Раствор Фелинга П
Жидкость Фелинга представляет собой смесь равных объемов обоих растворов. Перед употреблением жидкость Фелинга следует проверить: при ее кипячении не должен выпадать осадок закиси меди. Оба раствора смешивают только перед употреблением.
Реакция Фелинга не столь удобна, как реакция Бенедикта, потому что реактивы А и В приходится до анализа хранить отдельно.
Действие жидкости Фелинга можно себе представить следующим образом: при нагревании смеси в присутствии восстанавливающих веществ происходит постепенно гидролитическое расщепление медного алкоголята соли винной кислоты.
Сам реактив Фелинга очень неустойчив, а исходные растворы можно хранить.
Вместо реактива Фелинга можно использовать и аммиачный ра твор соли серебра. К разбавленному ( приблизительно 2 % — ному) растнору нитрата серебра будем постепенно приливать разбавленный водный раствор аммиака — точно до того момента, пока выпавший вначале осадок не растворится снова
В пробирку, тщательно вымытую хромовой смесью и ополоснутую несколько раз дистиллированной водой, нальем 2 мл приготовленного раствора соли серебра и 5 — 8 мл раствора метаналя и осторожно нагреем эту смесь, лучше всего на водяной бане. На стенках пробирки образуется отчетливое зеркало, а раствор благодаря выпавшим мельчайшим частицам серебра приобретает интенсивную черную окраску.
Использование реактива Фелинга позволяет фракционировать полисахариды, относящиеся к группам маннанов и ксиланов.
Окисление реактивом Фелинга служит качественной реакцией на глюкозу.





























