Формулировка периодического закона химических элементов
Русский ученый составлял наброски таблицы около 20 лет, пытаясь подобрать верную закономерность в их размещении. Отметив концепцию цикличности, он превратил её в периодический закон, изложив свое понимание правила:
«Свойства элементов, как и формируемых ими простых и сложных веществ, предполагают периодическую зависимость от их атомного веса».

Развитие науки в течение 20-го столетия несколько видоизменило закон: на смену термину «атомный вес» пришел «заряд ядра атома», вместо «простых и сложных веществ» — «веществ и соединений», к элементам добавилось определение «химическим».
Значение периодической системы Д.И. Менделеева
Создание ученым Дмитрием Ивановичем Менделеевым определило развитие химии и других естественнонаучных дисциплин. Открытие периодического закона показало, что все атомы построены по одному принципу, а их химическое строение должно отображать периодичность свойств элементов.Периодическая система оказала влияние на разработку теории строения атома.
Таблица Д.И. Менделеева – основа неорганической химии. Без нее человек бы не узнал о существовании хлорида натрия NaCl – веществе, которое придает супу соленый вкус.Без периодической системы люди бы не узнали, почему натрий так бурно вступает в реакцию с водой или почему органические вещества горят с копотью. Периодический закон объясняет то, почему некоторые элементы похожи друг на друга. Таблица Дмитрия Ивановича раскрывает тайны человечества и открывает новые границы химической науки.
Элементы таблицы Менделеева

Также есть класс «металлоподобных» полупроводников с неопределенным статусом. Отдельно располагаются благородные газы, не подверженные реакциям.
Часть элементов с номером более 100 открыта сравнительно недавно, их принадлежность к каким-либо группам только предположительна.
Щелочные и щелочноземельные элементы
Представители 1 (IA) и 2 (IIA) групп таблицы Менделеева — металлы со слабой устойчивостью и высокой степенью растворимости:

Щелочные металлы имеют серебристый отблеск, хорошо разламываются и режутся. Из всех размещенных в таблице металлов активнее других вступают в реакцию с молекулами других веществ, отдавая единственный свободный электрон. При контакте с водой создают гидроксиды – щелочи:
2Na + 2H20 = 2NaOH + H2
Щелочноземельные металлы более твердые и тугоплавкие, с бледно-серым оттенком. В их список входят:

Большая часть из них способна создавать щелочь, но не так легко расстается с двумя незанятыми электронами. Другие металлы они замещают, но перед щелочными бессильны и вытесняются ими из молекул.
Лантаноиды и актиноиды
Прежде получили название редкоземельных металлов из-за малого количества месторождений и трудностей в выводе чистого металла из соединений. Им соответствует 3 (III B) группа, хотя это иногда оспаривается.

В рамках семейства лантаноиды («скрытые») имеют схожую форму атома и внешние признаки, но различаются свойствами. Поодиночке почти не встречаются.
Актиноиды, помимо общих черт, радиоактивны. В природе, кроме, урана U 92, почти не встречаются, создаются искусственно.

Для удобства обе группы элементов выведены в 2 строки под общей таблицей.
Галогены и благородные газы
17 (VII A) группа состоит из галогенов:

В противоположность щелочам, эти неметаллы – самые сильные окислители, активно принимающие 8-й электрон к имеющимся семи для заполнения внешней оболочки.
Самый реактивный – фтор F 9 (способен разрушать молекулы воды):
2F2
+ 2H2O = 4HF + O2
3F2
+ 3H2O = OF2 + 4HF + H2O2
С ростом периода свойства элементов слабеют.
Все галогены токсичны, опасны для жизни, поражают дыхательные пути.
В последней, VIII A или 18 группе, находятся инертные газы:

Их внешний уровень электронов равен 8 (полностью заполнен), отчего они не способны вступать в реакцию с другими атомами. Крайне редко создают непрочные молекулы, распадающиеся при нагревании.
Переходные металлы
Представлены всеми подгруппами в традиционной системе или занимают с 3 по 12 столбцы в современных таблицах. Большинство обладает металлическим блеском, по цвету и состоянию различаются (большинство – твердые, но есть исключения, например, жидкая ртуть).
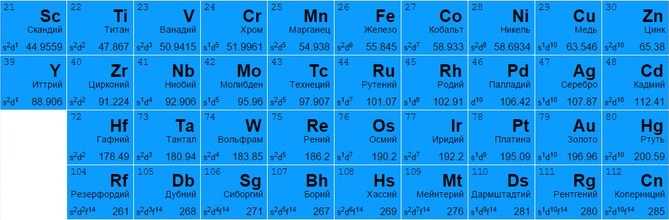
Могут отдавать разное количество электронов с нескольких оболочек для создания вещества (например, титан Ti 22 и железо Fe 26 способны отдавать от 2 до 4, медь Cu 29 – от 1 до 2, цинк Zn 30 – только 2, золото Au 79 и серебро Ag 47 практически не вступают в реакцию).
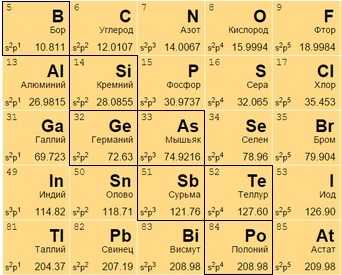
Металлоиды
Располагаются на стыке посреди легких металлов и неметаллов, в диагонали с 13 по 17 группах. В своем большинстве – полупроводники (хуже металлов проводят электрический ток).
Часть из них – металлы внешне, неметаллы по активности, часть – наоборот. Бор B 5, к примеру, является неметаллом с полупроводниковыми качествами.
Постпереходные металлы
Они же «легкие». От переходных аналогов отличаются меньшей твердостью и весом. Имеют иные температуры плавления и кипения. Для соединений отдают электроны только с внешней оболочки. Превосходят полуметаллы по восстановительности. Легкий металл выглядит как вещество с матовым оттенком вместо блеска.
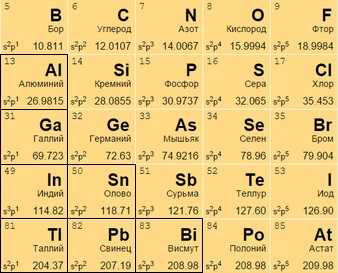
Размещаются после переходных металлов под полупроводниками (в 13-17 столбцах или IIIA – VIIA). Алюминий Al 13 носит неопределенный статус (иногда причисляется к металлоидам).
Неметаллы
Располагаются в правом верхнем углу между полуметаллами и инертными газами (начала 13-17 групп). Имеют больше электронов на внешней оболочке, стремятся присоединить к себе еще больше (в противоположность металлам), чтобы набрать полный уровень электронов.
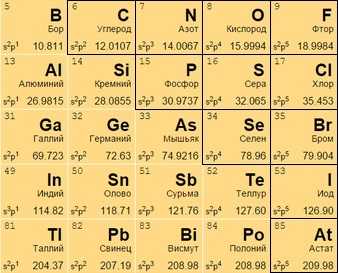
Могут находиться:
-
в виде газа (кислород O 8, азот N 7);
-
жидкости (бром Br 35);
-
в твердом (углерод C 6, кремний Si 14) состоянии.
Интересное положение занимает водород H 1. Его причисляют то к 1, то к 17 группе: он, будучи неметаллом, может проявлять и окислительные, и восстановительные свойства.
Модели атомов
Атом – сфера положительного электричества с плавающими электронами. Если проводить аналогию с кондитерским пудингом, то сфера – тесто, а электроны – изюм.

Эрнест Резерфорд (1911 г.) – планетарная модель
В центре атома располагается небольшое ядро, которое имеет положительный заряд. Вокруг ядра электроны, заряженные отрицательно, движутся как планеты. Т.е. ядро – Солнце нашей галактики, а планеты – это электроны.
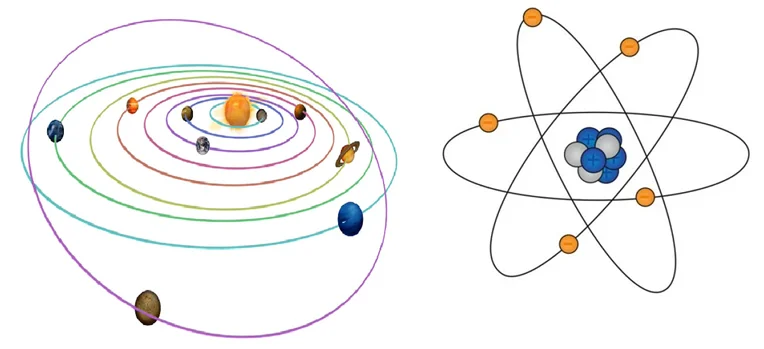
Нильс Бор (1913 г.) – квантовая теория
Положения теории Бора.
- Электрон может вращаться по стационарным круговым орбиталям.
- При движении по орбиталям электроны не излучают энергию.
- Атом излучает или поглощает электромагнитную энергию при переходе электрона на другую орбиталь.
- Квантовая теория (с 1932 г.) – современная теория
Ядро атома включает протоны и нейтроны. Количество электронов равно сумме протонов. Точное расположение электрона определить невозможно, можно только найти его наиболее вероятную область нахождения. При переходе с орбитали на орбиталь испускается или поглощается электромагнитная энергия.
Периодическая таблица Менделеева
До Дмитрия Ивановича собрать элементы в один список пытались многие умы Европы. С начала XIX века они предприняли множество попыток сопоставления веществ.

В 1869 г. свой первый план представляет и Менделеев, через 2 года – завершает доработку и издает последний вариант таблицы.
Основная идея группировки – периодичность. Расположив элементы в порядке увеличения атомной массы, он заметил, что время от времени их свойства повторяются.
Ко 2-й половине XIX века миру было известно намного меньше веществ, чем сегодня, так что химик оставил пустые места в своей таблице, предполагая открытие новых элементов, и даже сумел заранее определить свойства открытых впоследствии галлия Ga 31 и германия Ge 32.
С каждым последующим номером элемента возрастает его атомная масса, заряд ядра, уровень электронов (количество элементов и их связей), показатели активности повторяются в зависимости от периода.
Количество элементов, ряды
118 элемент периодической системы имеет название «оганесон». Впервые он был синтезирован в Дубне в 2002 году. Свое название данный химический элемент получил в 2016 году в честь ученого Ю. Ц. Оганесяна. Этот элемент является последним в таблице на момент Y года.
Согласно длиннопериодному варианту таблица имеет 7 рядов по количеству периодов, а также 2 ряда под основной таблицей – ряд лантаноидов и ряд актиноидов.
Ряды включают в себя:
- Водород Н, Гелий Не.
- Литий Li, Бериллий Be, Бор B, Углерод C, Азот N, Кислород O, Фтор F, Неон Ne.
- Натрий Na, Магний Mg, Алюминий Al, Кремний Si, Фосфор P, Сера S, Хлор Cl, Аргон Ar.
- Калий K, Кальций Ca, Скандий Sc, Титан Ti, Ванадий V, Хром Cr, Марганец Mn, Железо Fe, Кобальт Co, Никель Ni, Медь Cu, Цинк Zn, Галий Ga, Германий Ge, Мышьяк As, Селен Se, Бром Br, Криптон Kr.
- Рубидий Rb, Стронций Sr, Иттрий Y, Цирконий Zr, Ниобий Nb, Молибден Mo, Технеций Tc, Рутений Ru, Родий Rh, Галладий Pd, Серебро Ag, Кадмий Cd, Индий In, Олово Sn, Сурьма Sb, Теллур Te, Йод I, Ксенон Xe.
- Цезий Cs, Барий Ba, Лантан La, Гафний Hf, Тантал Ta, Вольфрам W, Рений Re, Осмий Os, Иридий Ir, Платина Pt, Золото Au, Ртуть Hg, Таллий Tl, Свинец Pb, Висмут Bi, Полоний Po, Астат At, Радон Rn.
- Франций Fr, Радий Ra, Актиний Ac, Резерфордий Rf, Дубний Db, Сиборгий Sg, Борий Bh, Хассий Hs, Мейтнерий Mt, Дармштадтий Ds, Рентгений Rg, Коперниций Cn, Нихоний Nh, Флеровий Fl, Московий Mc, Ливерморий Lv, Теннессин Ts, Оганесон Og.
- Лантаноиды: Лантан La, Церий Ce, Празеодим Pr, Неодим Nd, Прометий Pm, Самарий Sm, Европий Eu, Гадолиний Gd, Тербий Tb, Диспрозий Dy, Гольмий Ho, Эрбий Er, Тулий Tm, Иттербий Yb, Лютенций Lu.
- Актиноиды: Актиний Ac, Торий Th, Протактиний Pa, Уран U, Нептуний Np, Плутоний Pu, Америций Am, Кюрий Cm, Берклий Bk, Калифорний Cf, Эйнштейний Es, Фермий Fm, Менделевий Md, Нобелий No, Лоуренсий Lr.
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
<<Форма демодоступа>>
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.

Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Тренировочные задания
1. Среди перечисленных химический элемент с максимальным радиусом атома — это
1) неон 2) алюминий 3) калий 4) кальций
2. Среди перечисленных химический элемент с минимальным радиусом атома — это
1) алюминий 2) бор 3) калий 4) неон
3. Наиболее ярко металлические свойства выражены у элемента
1) Rb 2) Li 3) Mg 4) Ca
4. Наиболее ярко неметаллические свойства выражены у элемента
1) F 2) S 3) O 4) N
5. Наибольшее число валентных электронов у элемента
1) фтор 2) водород 3) натрий 4) сера
6. Наименьшее число валентных электронов у элемента
1) кислород 2) кремний 3) водород 4) кальций
7. Металлические свойства элементов возрастают в ряду
1) Ba, Li, Cs, Mg 2) Al, Mg, Ca, K 3) Li, Cs, Mg, Ba 4) Na, Mg, Li, Al
8. Неметаллические свойства элементов ослабевают в ряду:
1) N, S, Br, Cl 2) O, S, Se, Te 3) Se, I, S, O 4) N, P, O, F
9. Химические элементы перечислены в порядке возрастания атомного радиуса в ряду
1) углерод, бериллий, магний 2) калий, магний, алюминий 3) хлор, натрий, фтор 4) азот, фосфор, фтор
10. Химические элементы перечислены в порядке убывания атомного радиуса в ряду
1) водород, бор, алюминий 2) углерод, кремний, калий 3) натрий, хлор, фтор 4) сера, кремний, магний
11. Кислотные свойства водородных соединений усиливаются в ряду
1) HI – PH3 – HCl – H2S 2) PH3 – H2S – HBr – HI 3) H2S – PH3 – HCl – SiH4 4) HI – HCl – H2S – PH3
12. Кислотные свойства водородных соединений ослабевают в ряду
1) HI – PH3 – HCl – H2S 2) PH3 – H2S – HBr – HI 3) H2S – PH3 – HCl – SiH4 4) HI – HBr – HCl – HF
13. Основные свойства соединений усиливаются в ряду
1) LiOH – KOH – RbOH 2) LiOH – KOH – Ca(OH)2 3) Ca(OH)2 – KOH – Mg(OH)2 4) LiOH – Ca(OH)2 – KOH
14. Основные свойства соединений ослабевают в ряду
1) LiOH – Ba(OH)2 – RbOH 2) LiOH – Ba(OH)2 – Ca(OH)2 3) Ca(OH)2 – KOH – Mg(OH)2 4) LiOH – Ca(OH)2 – KOH
15. Во втором периоде Периодической системы элементов Д.И. Менделеева с увеличением заряда ядра у химических элементов:
1) возрастает электроотрицательность 2) уменьшается заряд ядра 3) возрастает атомный радиус 4) возрастает степень окисления
16. Наиболее сильной кислотой, образованной элементом второго периода, является
1) угольная 2) азотная 3) фтороводородная 4) азотистая
17. Наиболее сильное основание образует химический элемент
1) магний 2) литий 3) алюминий 4) калий
18. Наиболее сильная бескислородная кислота соответствует элементу
1) селен 2) фтор 3) йод 4) сера
19. В ряду элементов Li → B → N → F
1) убывает атомный радиус 2) возрастают металлические свойства 3) уменьшается число протонов в атомном ядре 4) увеличивается число электронных слоёв
20. В ряду элементов Li → Na → K → Rb
1) убывает атомный радиус 2) ослабевают металлические свойства 3) уменьшается число протонов в атомном ядре 4) увеличивается число электронных слоёв
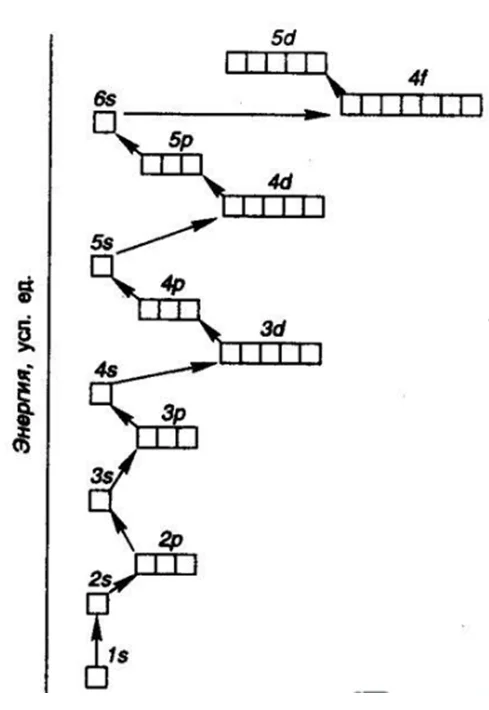
Правила заполнения орбиталей
В многоэлектронном атоме стабильной является та конфигурация, для которой достигается минимум полной энергии. В первую очередь электроны идут на орбитали с меньшей энергией в соответствии с рядом Клечковского:
1s>2s>2p>3s>3p>4s>3d>4p>5s>4d>5p>6s>4f>5d>6p>7s>5f>6d>7p
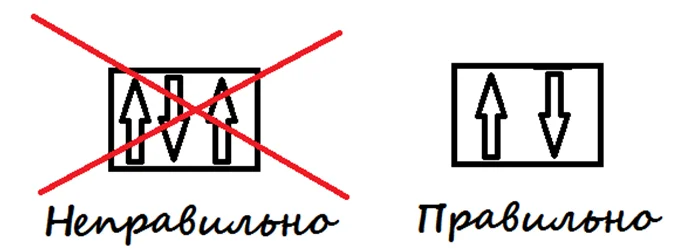
Принцип Паули
На орбитали могут находиться только один-два электрона.
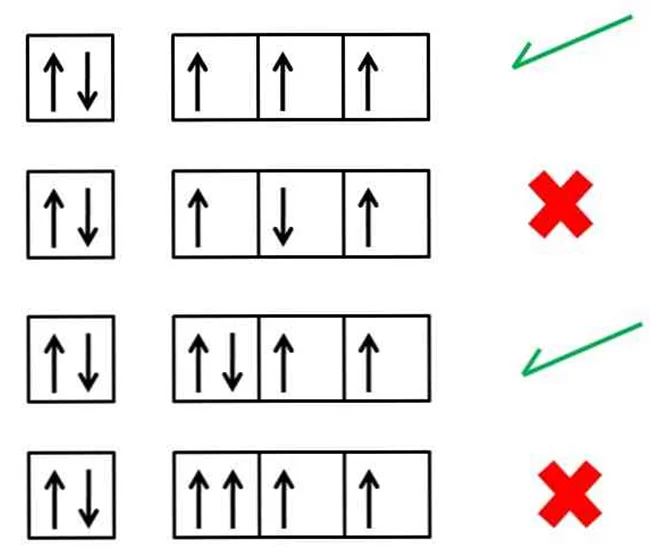
Правило Гунда
В пределах одного подуровня электроны по одному переходят на свободные орбитали. Только после того, как на каждой орбитали находится по одному электрону, могут формироваться пары.Стоит отметить, что правило Гунда характеризует основное состояние атома.
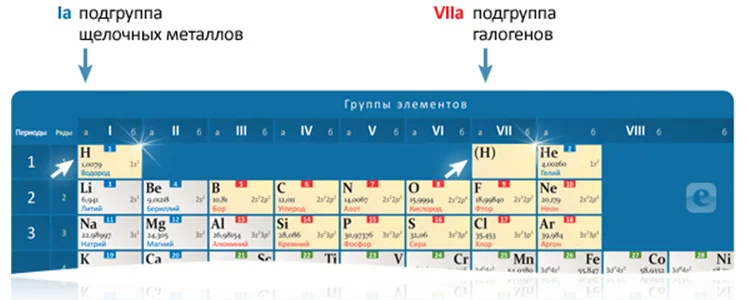
Группы
Вертикальные столбики элементов в периодической таблице — группы состоят из подгрупп: главной и побочной, они иногда обозначаются буквами А и Б соответственно.
В состав главных подгрупп входят s- и р-элементы, а в состав побочных — d- и f-элементы больших периодов.
Главная подгруппа — это совокупность элементов, которая размещается в периодической таблице вертикально и имеет одинаковую конфигурацию внешнего электронного слоя в атомах.
Как следует из приведенного определения, положения элемента в главной подгруппе определяется общим количеством электронов (s- и р-) внешнего энергетического уровня, равным номеру группы. Например, сера (S — 3s2 3p4 ), в атоме которого на внешнем уровне содержится шесть электронов, относится к главной подгруппе шестой группы, аргон (Ar — 3s2 3p6 ) — к главной подгруппе восьмой группы, а стронций (Sr — 5s2 ) — к ІІА-подгруппе.
Элементы одной подгруппы характеризуются сходством химических свойств. В качестве примера рассмотрим элементы ІА и VІІА подгрупп (табл.2). С ростом заряда ядра увеличивается количество электронных слоев и радиус атома, но количество электронов на внешнем энергетическом уровне остается постоянной: для щелочных металлов (подгруппа IА) — один, а для галогенов (подгруппа VIIА) — семь. Поскольку именно внешние электроны наиболее существенно влияют на химические свойства, то понятно, что каждая из рассмотренных групп элементов-аналогов имеет подобные свойства.
Но в пределах одной подгруппы наряду с подобием свойств наблюдается их некоторое изменение. Так, элементы подгруппы ІА все, кроме Н — активные металлы. Но с ростом радиуса атома и количества электронных слоев экранирующих влияние ядра на валентные электроны, металлические свойства усиливаются. Поэтому Fr более активный металл, чем Сs, a Cs — более активный, чем R в и т.д. А в подгруппе VIIA по той же причине ослабляются неметаллические свойства элементов при росте порядкового номера. Поэтому F — более активный неметалл по сравнению с Cl, a Cl — более активный неметалл сравнению с Br и т.д.
Таблица 2 — Некоторые характеристики элементов ІА и VІІА-подгрупп
| период | Подгруппа IA | Подгруппа VIIA | ||||||
|---|---|---|---|---|---|---|---|---|
| Символ элемента | Заряд ядра | Радиус атома, нм | Внешняя электронная конфигурацiя | Символ элемента | Заряд ядра | Радиус атома, нм | Внешняя электронная конфигурацiя | |
| II | Li | +3 | 0,155 | 2 s 1 | F | +9 | 0,064 | 2 s 2 2 p 5 |
| III | Na | +11 | 0,189 | 3 s 1 | Cl | +17 | 0,099 | 3 s 2 3 p 5 |
| IV | K | +19 | 0,236 | 4 s 1 | Br | 35 | 0,114 | 4 s 2 4 p 5 |
| V | Rb | +37 | 0,248 | 5 s 1 | I | +53 | 0,133 | 5 s 2 5 p 5 |
| VI | Cs | 55 | 0,268 | 6 s 1 | At | 85 | 0,140 | 6 s 2 6 p 5 |
| VII | Fr | +87 | 0,280 | 7 s 1 | — | — | — | — |
Побочные подгруппа — это совокупность элементов, размещаемых в периодической таблице вертикально и имеют одинаковое количество валентных электронов за счет застройки внешнего s- и втором снаружи d-энергетических подуровней.
Все элементы побочных подгрупп относятся к d-семейству. Эти элементы иногда называют переходными металлами. В побочных подгруппах свойства изменяются более медленно, поскольку в атомах d-элементов электроны застраивают второй извне энергетический уровень, а на внешнем уровне находятся только один или два электрона.
Положение первых пяти d-элементов (подгруппы IIIБ- VIIБ) каждого периода можно определить с помощью суммы внешних s-электронов и d-электронов второго снаружи уровня. Например, из электронной формулы скандия (Sc — 4s2 3d1 ) видно, что он размещается в побочной подгруппе (поскольку является d-элементом) третьей группы (поскольку сумма валентных электронов равна трем), а марганец (Mn — 4s2 3d5 ) размещается в побочной подгруппе седьмой группы.
Положение последних двух элементов каждого периода (подгруппы IБ и IIБ) можно определить по количеству электронов на внешнем уровне, поскольку в атомах этих элементов предыдущий уровень является полностью завершенным. Например, Ag ( 5s1 5d10 ) размещается в побочной подгруппе первой группы, Zn ( 4s2 3d10 ) — в побочной подгруппе второй группы.
Триады Fe-Co-Ni, Ru-Rh-Pd и Os-Ir-Pt размещены в побочной подгруппе восьмой группы. Эти триады образуют две семьи: железа и платиноидов. Кроме указанных семей отдельно выделяют семью лантаноидов (четырнадцать 4f-элементов) и семью актиноидов (четырнадцать 5f-элементов). Эти семьи принадлежат к побочной подгруппе третьей группы.
Рост металлических свойств элементов в подгруппах сверху вниз, а также уменьшение этих свойств в пределах одного периода слева направо обусловливают появление в периодической системе диагональной закономерности. Так, Be очень похож на Al, B — на Si, Ti — на Nb. Это ярко проявляется в том, что в природе эти элементы образуют подобные минералы. Например, в природе Те всегда бывает с Nb, образуя минералы — титанониобаты.
Положение водорода в периодической системе
Если посмотреть на периодическую таблицу, то можно заметить, что у водорода двойственное положение. Водород – элемент, порядковый номер которого 1. Его электронная формула: 1s1. Водород – элемент, у которого на единственной орбитали располагается только один электрон.
Водород – двойной агент, который может быть как окислителем, так и восстановителем. Он может входить как в I, так и в VII группу. Это связано с тем, что он имеет черты сходства и со щелочными металлами, и с галогенами.
Если водород выступает в роли восстановителя, то он стоит в первой группе. В этом случае ему характерна степень окисления +1. Например, водород-восстановитель в соединениях Н2О, HCl.Если водород выступает в роли окислителя, то он стоит в седьмой группе.В этом случае для элемента характерна степень окисления -1. Например, водород-окислитель в соединениях NaH, CaH2.
Двойственность водорода связана с тем, что у него только один электрон. На s-уровне может находиться только два электрона. Поэтому водород с легкостью отдает свой единственный электрон или отнимает электрон у другого элемента.
Строение атома
Атомы – частицы, из которых состоят молекулы. Понятие «атом» ввел Демокрит. Он считал эти частицы первоначалом мироздания. С греческого языка атом переводится как неделимый.
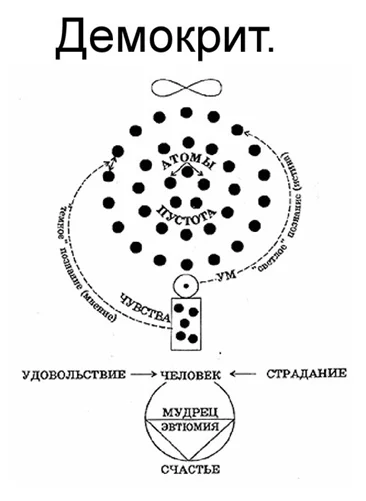 Представление Демокрита о месте атомов в мире.
Представление Демокрита о месте атомов в мире.
После Демокрита учение об атомах было забыто на несколько веков. Возродил атомистическую теорию Джон Дальтон.Он установил, что атомы одного элемента одинаковы. Джон Дальтон определил атом, как «неделимый, вечный и неразрушимый».
В начале XX в. было установлено, что атом делим. Этот вывод был сделан исходя из ряда научных открытий.
- Катодные лучи – поток электронов в вакуумной трубке, содержащей катод и анод.
- Фотоэффект – испускание металлом электронов под действием падающего на него света.
- Рентгеновские лучи – электромагнитное излучение подобное свету с гораздо более высокой частотой, испускаемой при действии на них катодных лучей.
- Радиоактивность – явление самопроизвольного превращения одного химического элемента в другой, которое сопровождается испусканием электронов или других частиц и рентгеновского излучения.
Экспериментальные данные показывают, что атом – сложная частица. На протяжении многих лет ученые спорили о строении и свойствах атома.
Строение периодической системы
Для начала рассмотрим понятия таблица и система. Вы не один раз видели таблицу, она состоит из строк и столбцов. Но почему творение Менделеева имеет названия как таблица, так система да еще и с добавлением периодическая.
В таблице содержится упорядоченная информация в определённом порядке. Система указывает, что сведения связаны между собой. Периодичность означает, что через какой-то промежуток или отрезок происходит повторение свойств.
Как уже известно, в периодической системе находятся элементы. Принцип их расположения — это увеличение их атомной массы.
В таблице имеются строки – это периоды, и столбцы – группы.
Существует несколько вариантов ПСХЭ, так называемый короткий и длинный вариант.
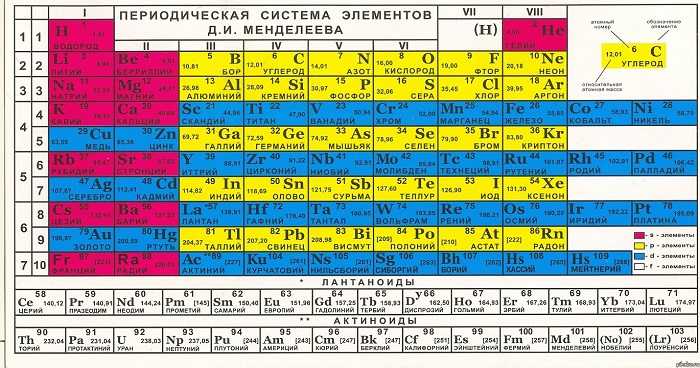
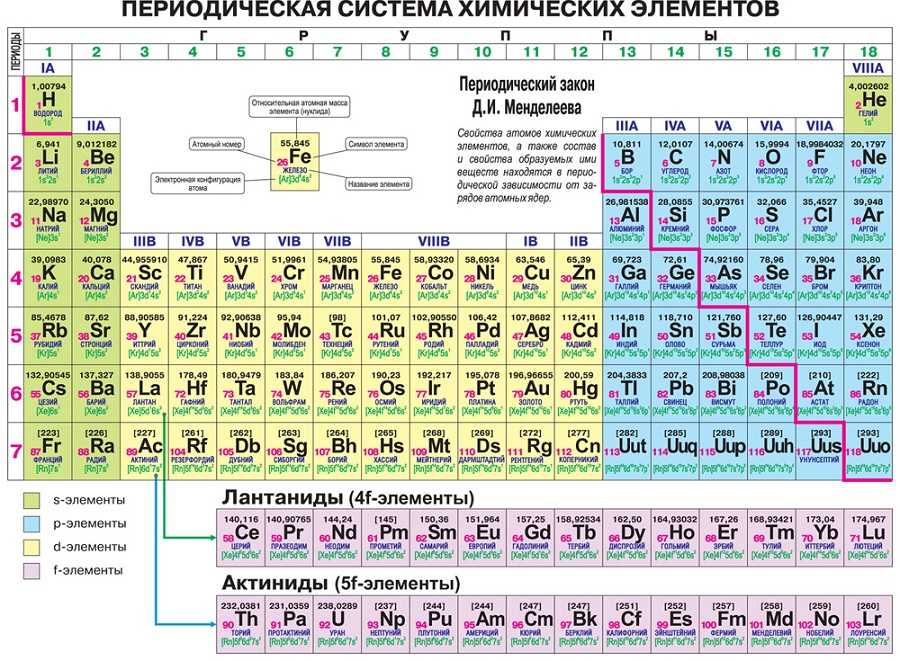
Короткий вариант имеет 8 групп, номера которых указаны римскими цифрами I, II…VIII, содержит главную (А) и побочную (В) группы. Длинный формат вмещает 18 групп, нумерация осуществляется арабскими цифрами I, II…XVIII,
Если посмотреть на таблицу, то видим закономерность, так как абсолютно каждый период будет начинаться активным металлом и заканчиваться инертным газом. Такая периодичность сохраняется 7 раз.
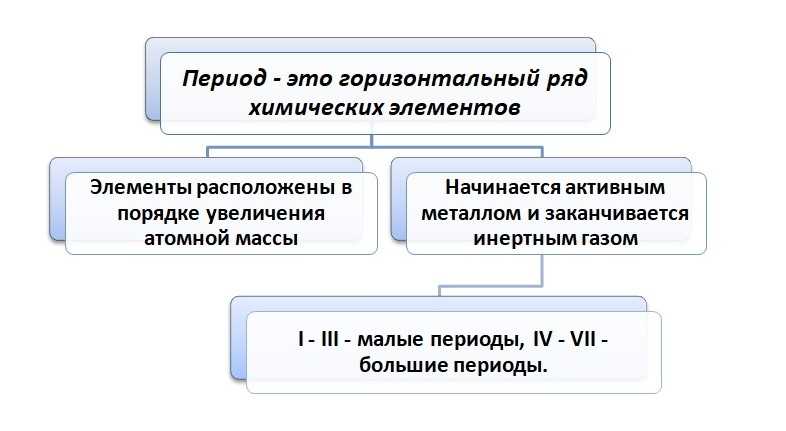
Как видно из таблицы, I период включает 2 элемента, II и III состоят из 8, IV и V содержат 18, самые большие – это VI и VII вмещают 32 элемента (VII период незаконченный).
В периоде с ростом атомной массы металлические свойства уменьшаются, неметаллические – увеличиваются.
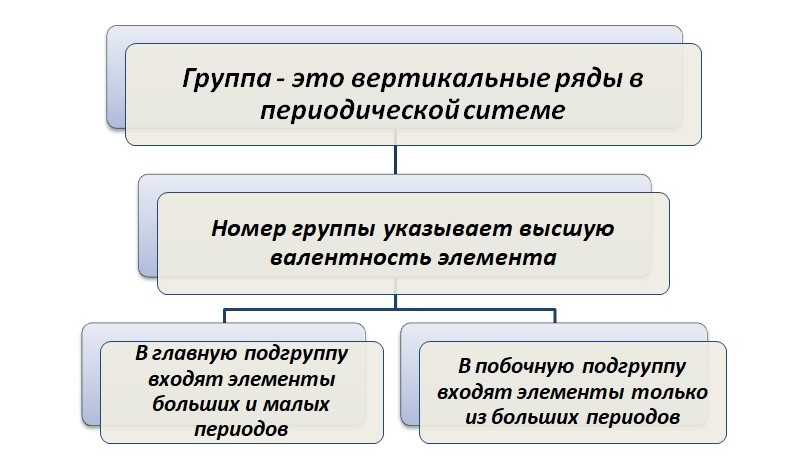
Вертикальные столбцы образуют группы. Это условно компании, где собираются единомышленники. Точнее, располагаются элементы, подобные по своим свойствам.

Обратите внимание, что подобие характерно только в пределах подгруппы. Так, натрий и медь принадлежат одной I группе, но располагаются в разных подгруппах
Натрий – элемент главной подгруппы, медь – побочной. Именно по этой причине они будут иметь разные физические и химические свойства.
В пределах группы с ростом атомной массы металлические свойства увеличиваются, неметаллические – уменьшаются.
Таким образом, периодическую систему можно условно назвать домом химических элементов, где каждый из них занимает своё определённое место (порядковый номер) согласно его свойствам.


Рассмотрим подробнее на примере 2 и 3 периода. Что показывает сравнение: оба периода начинаются с активных металлов Li и Na, для которых характерно существование в виде соединений, в свободном виде могут находиться только под слоем керосина. Они относятся к группе щелочных металлов. Анализируя схему, мы видим, что первые три группы образованны металлами. С IV – VII находятся неметаллы. «Закрывают период» инертные газы.
Особое внимание располагают к себе элементы VI и VII периоды, которые образуют «семейство» лантаноидов (Лантан № 57) и актиноидов (Актиний 89), они формально близки к скандию. Но из-за их количества они вынесены за пределы системы
Характеристика элемента по его положению в периодической системе
Зная «прописку» элементов в таблице, мы можем прогнозировать их свойства. Составим план, согласно которому сможем описать свойства элементов, рассматривать будем на примере серы.
Первое, что нам необходимо знать — это какой символ имеет сера, чтобы по нему найти её в ПСХЭ. Обозначение S занимает ячейку 16. (порядковый номер).
Уточняем «прописку». III период, VI группа, главная подгруппа. Зная эти элементарные сведения, мы предполагаем, что это неметалл (принадлежность к VI группе и нахождение в малом ряду даёт нам основание для предположения).
Формула высшего оксида и его свойства. Поскольку сера элемент VI группы, высшая валентность будет равна VI. Формула оксида SO3. Пользуясь таблицей-шпаргалкой, определяем характер – кислотный. С курса физики известно, что противоположности притягиваются. Как плюс притягивает минус, так и кислотные оксиды взаимодействуют с основными, которые образованы элементами-металлами с валентностью I или II. Возьмём, например, барий, который образует оксид и гидроксид, соответственно ВаO и Вa(OH)2.
ВаO + SO3 → ВаSO4
Ва(ОН)2 + SO3 → ВаSO4 + H2O
Формула высшего гидроксида и его свойства. Снова обратимся к нашей шпаргалке, высшие гидроксиды VI группы имеют формулу H2ЭO4, а именно H2SO4. Образованный гидроксид имеет кислотные свойства, для которого свойственны реакции с основными оксидами и основаниями. К примеру, возьмём двухвалентный стронций, формула оксида и гидроксида соответственно SrO и Sr(OH)2.
SrO + H2SO4→ SrSO4 + H2O
Sr(OH)2 + H2SO4 → SrSO4 + 2H2O
Как элемент-неметалл образует летучее водородное соединение состава H2S.
На данном примере убеждаемся, что зная расположение элемента в ПСХЭ, можно прогнозировать его свойства, а также свойства веществ, в состав которых он входит.














![Периодическая система элементов и структура электронной оболочки атомов [1972 семишин в.и. - периодическая система химических элементов д. и. менделеева]](http://mapisa-plitka.ru/wp-content/uploads/2/d/0/2d0c7fd85f007e03f133ccd9fe982c83.jpeg)















