Способы получения и добычи
Добыча и обработка проводится на природных рудниках. Потом расходное сырье доставляется до литейного предприятия, где происходит его переработка в конечный материал. Способы получения:
- Порошковый. При изготовлении сплавов используются порошки — смесь основных компонентов сплава по ГОСТу. С помощью специального оборудования порошок спрессовывается, ему придают определенную форму. После этого расходный материал спекают в промышленной печи.
- Литейный способ. Все компоненты будущего сплава сначала расплавляются, а потом перемешиваются. Смесь должна застыть.
Природные источники
Самое большое количество металлов содержится в земной коре. Их соединения можно найти в разных продуктах питания, воде, воздухе, химических веществах.
Природные соединения
Природные соединения:
- сульфиды — киноварь, цинковая обманка, серный колчедан;
- хлориды — каменная соль, сильвинит;
- сульфаты — гипс, глауберова соль;
- карбонаты — магнезит, доломит, известняк, мрамор, мел;
- оксиды — красный, магнитный, бурый железняк;
- нитраты — чилийская селитра.

Добыча руды
Способы добычи
Существует два способа добычи металлических руд:
- Открытый. Подразумевает разработку огромного карьера, который углубляется к центру. С его глубины на карьерных самосвалах руда вывозится наверх, где проходит дальнейшую переработку. Средняя глубина карьеров — 300 метров. Для разработки применяются крупные экскаваторы, земснаряды, карьерная техника. Карьерный метод добычи металлической руды применяется только, если после проверки почвы в ней было обнаружено более 57% руды. Главный недостаток карьера — малая глубина разработки.
- Закрытый. Подразумевает разработку шахт, которые могут уходить вниз на глубину нескольких сотен метров. Применяется, когда на поверхности после проверки было обнаружено менее 57% полезных руд. Внешне шахта напоминает колодец, который разветвляется в стороны на большой глубине. Главный недостаток — опасность для рабочих (частые обвалы, взрывы газов, большая вредность для здоровья).
Один из современных способов добычи металлической руды — СГД. Представляет собой гидромеханических метод добычи руды, который подразумевает создание глубокой шахты, снабженной трубопроводом с гидромонитором. Струя воды под большим напором подается в трубопровод. С ее помощью откалываются горные породы, которые всплывают наверх шахты. Эффективность данного способа небольшая, но он полностью безопасен для людей.

Шахта
Богатые рудники
Богатые железные рудники:
- Бакчарское железорудное месторождение.
- Абаканское железорудное месторождение.
- Абагасское железорудное месторождение.
- Курская магнитная аномалия.
Самые богатые месторождения алюминиевых руд находятся в
- Венгрии;
- Франции;
- Индии;
- Южной Африке;
- Казахстане;
- России;
- Югославии;
- Кольском полуострове;
- Сибири.
Богатые месторождения медной руды расположены в США, Швеции, Канаде, России, Финляндии, ЮАР.
Гидрометаллургия
Методика, которая основана на проведении химических реакциях. Они протекают в различных растворах. Наиболее распространенные материалы, которые получаются подобным способом — никель, цинк, золото.
Пирометаллургия
Из расходного сырья металл извлекается под воздействием высоких температур. Для проведения данного способа применяются печи, плавильни. Этим методом получают чугун, свинец, сталь, никель, медь, хром
Для изготовления активных металлов важно использовать восстановители
Электрометаллургия
Подразумевает обработку расходного сырья электрическим током. Сила тока изменяется зависимо от преобладающих в составе руды компонентов. С помощью электрометаллургии получаются разные металлы — щелочноземельные, щелочные. Основные из них — алюминий, магний.
- С помощью металлов. Этот процесс называют металлотермией.
- С помощью водорода. С помощью этой методики можно получить материал с наименьшим количеством посторонних вкраплений.
- С помощью углерода или оксида углерода. Эта методика называется карботермией.
Оборудование
Для получения и обработки применяется разное оборудование:
- Для термической обработки — печи, плавильни, горны.
- Для изменения шероховатостей поверхностей — шлифовальные станки, пескоструи.
- Для создания углублений, обработки кромок, торцов — долбежные, сверлильные, фрезеровальные станки.
- Для придания простой или сложной цилиндрической формы — токарные станки.
- Для разрезания заготовок — пилы, лазерные или гидроабразивные резаки.
Современное оборудование оснащается автоматическими системами управления, что ускоряет производство, минимизирует физические затраты со стороны человека.
Самодельный горн (Фото: Instagram / vetal7070)
3.5. Восстановление металлов из оксидов водородом
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Как правило, взаимодействие оксидов металлов с водородом протекает в жестких условиях – под давлением или при нагревании.
CuO + H2 = Cu + H2O
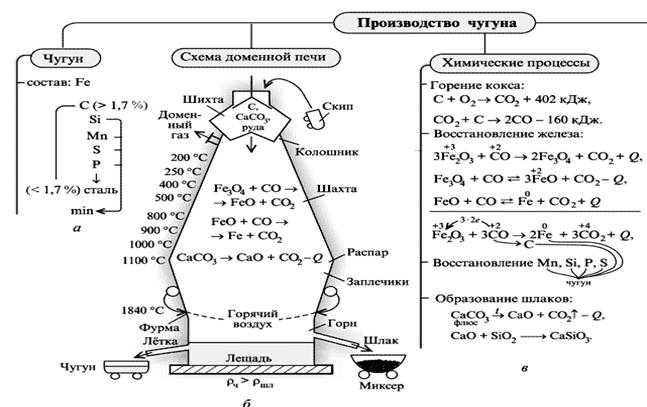
4. Производство чугуна
Чугун получают из железной руды в доменных печах.
Печь последовательно загружают сверху шихтой, флюсами, коксом, затем снова рудой, коксом и т.д.
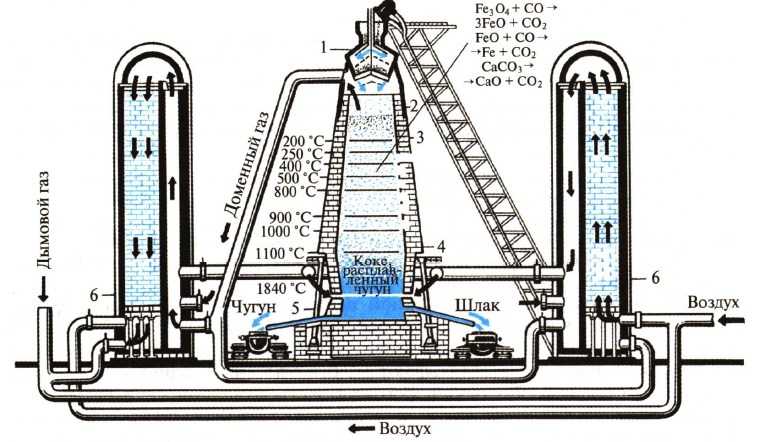
1- загрузочное устройство, 2 — колошник, 3 — шахта, 4 — распар, 5 — горн, 6 — регенератор
Доменная печь имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть доменной печи — колошник, средняя — шахта, а нижняя часть — распар.
В нижней части печи находится горн. Внизу горна скапливается чугун и шлак и отверстия, через которые чугун и шлак покидают горн: чугун через нижнее, а шлак через верхнее.
Наверху печи расположено автоматическое загрузочное устройство. Оно состоит из двух воронок, соединенных друг с другом. Руда и кокс сначала поступают в верхнюю воронку, а затем в нижнюю.
Из нижней воронки руда и кокс поступают в печь. во время загрузки руды и кокса печь остается закрытой, поэтому газы не попадают в атмосферу, а попадают в регенераторы. В регенераторах печной газ сгорает.
Шихта — это железная руда, смешанная с флюсами.
Снизу в печь вдувают нагретый воздух, обогащенный кислородом, кокс сгорает:
C + O2 = CO2
Образующийся углекислый газ поднимается вверх и окисляет кокс до оксида углерода (II):
CO2 + С = 2CO
Оксид углерода (II) (угарный газ) — это основной восстановитель железа из оксидов в данных процессах. Последовательность восстановления железа из оксида железа (III):
Fe2O3 → Fe3O4 (FeO·Fe2O3) → FeO → Fe
Последовательность восстановления оксида железа (III):
3Fe2O3 + CO → 2Fe3O4 + CO2
Fe3O4 + CO → 3FeO + CO2
FeO + CO → Fe + CO2
Суммарное уравнение протекающих процессов:
Fe2O3 + 3CO → 2Fe + 3CO2
При этом протекает также частичное восстановление примесей оксидов других элементов (кремния, марганца и др.). Эти вещества растворяются в жидком железе.
Чтобы удалить из железной руды тугоплавкие примеси (оксид кремния (IV) и др.). Для их удаления используют флюсы и плавни (как правило, известняк CaCO3 или доломит CaCO3·MgCO3). Флюсы разлагаются при нагревании:
CaCO3 → CaO + CO2
и образуют с тугоплавкими примесями легкоплавкие вещества (шлаки), которые легко можно удалить из реакционной смеси:
CaO + SiO2 → CaSiO3
§ 45. Общие способы получения металлов
Пирометаллургические методы
Пирометаллургические методы получения металлов основаны на восстановлении металлов из их руд при высокой температуре различными веществами с восстановительными свойствами. Наиболее распространённые восстановители — уголь, оксид углерода(II), водород, алюминий. В качестве примеров приведём используемые для получения металлов как в промышленности, так и в лаборатории реакции восстановления цинка углём и оксидом углерода(II), меди и вольфрама — водородом, железа и хрома — алюминием:
Рассмотрим более подробно процесс получения железа в составе его сплавов — чугуна и стали.
Основной источник железа — это руды, содержащие такие минералы, как магнетит (Fe3O4) и гематит (Fe2О3). Полезными примесями, улучшающими качество выплавляемого из руды железа, являются соединения Mn, Ni, Co, Сг, В, V. Их называют легирующими добавками. Соединения As, P, S, Pb, Zn — вредные примеси, ухудшающие свойства железа.
В настоящее время в производстве стали используют два основных способа.
Согласно первому традиционному способу получение стали проводят в две стадии. На первой из них получают чугун, который на второй стадии перерабатывают в сталь.
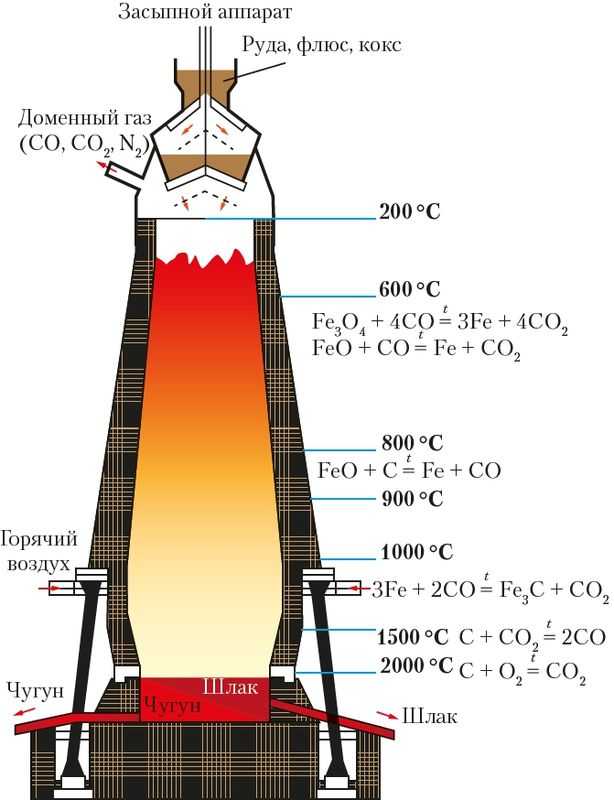 Засыпной аппарат
Засыпной аппарат
Для получения чугуна железо восстанавливают углеродом и угарным газом, который образуется при неполном сгорании угля. В доменную печь загружают смесь железной руды, специально обработанного угля, называемого коксом, и добавляют для понижения температуры плавления известняк. Такую смесь, называемую шихтой, вводят в доменную печь сверху, откуда она перемещается вниз в зону более высокотемпературного нагревания, где температура поднимается до 1600 °С и смесь расплавляется.
Вдуваемый снизу в доменную печь воздух обеспечивает горение углерода с выделением большого количества теплоты и образованием угарного газа, который восстанавливает железо из его оксидов. Восстановленное железо уже при температуре около 1000 °С науглероживается, и образуется сплав, называемый чугуном. В нём, помимо железа, содержатся графит и цементит — карбид железа Fe3C с суммарным содержанием углерода приблизительно от 2 до 6 %.
Расплав чугуна периодически отбирают, изолируя его от шлака. Химические процессы, протекающие в разных зонах доменной печи, представлены на рисунке.
При переработке чугуна в сталь на второй стадии процесса избыточный углерод, а нередко и другие примеси, например кремния, фосфора, серы, окисляют при высокой температуре кислородом воздуха. Для этого используют разные установки — мартеновские печи, конвертеры, электропечи. Образующиеся оксиды неметаллов всплывают в виде шлака или испаряются. Наряду с окислением примесей происходит также частичное окисление железа с образованием оксида железа(II), который растворяется в расплавах чугуна и стали. Оксид железа(II) восстанавливают, добавляя в расплав кремний, марганец или алюминий в качестве восстановителей. Образующийся шлак из оксидов отделяют от расплава железа.
Второй способ производства стали одностадийный, его называют прямым. В нём стадия получения чугуна отсутствует, меньше выброс углекислого газа в атмосферу. Являясь более экономичным, он постепенно вытесняет первый способ. Для получения стали железную руду измельчают, а затем обжигают с относительно небольшим количеством кокса во вращающихся печах. Полученные железорудные окатыши, содержащие оксиды железа, подвергают действию газообразного восстановителя в специальных реакторах.
В качестве восстановителя используют смесь метана, оксида углерода(II) и водорода. Водород и оксид углерода(II) образуются из метана при его окислении кислородом в присутствии катализатора в специальных аппаратах по реакции:
Образование металлического железа можно представить уравнениями реакций:
Полученное при восстановлении губчатое железо (окатыши) подвергают переплавлению в электродуговых печах. При этом, вводя необходимые добавки, железо легируют для получения того или иного сорта высококачественных сталей — коррозионностойких, инструментальных, конструкционных, электротехнических, жаропрочных и др.
§ 45. Общие способы получения металлов
Электрохимические методы
Электрохимический метод получения металлов (электрометаллургия) предполагает выделение металлов из руд электролизом. Электролиз — это окислительно-восстановительный процесс, протекающий под действием постоянного электрического тока, проходящего через раствор или расплав электролита. Его отличие от обычных окислительно-восстановительных реакций заключается в том, что процессы окисления и восстановления разделены в пространстве и протекают на электродах, помещённых в раствор или расплав электролита.
Процесс получения металлов электролизом проводят в аппаратах, называемых электролизёрами. В них имеется источник электрического питания, подсоединённый к электродам, которые погружены в ванну с токопроводящим водным раствором или расплавом соли металла.
Выбор условий проведения электролиза и состава электролита определяется положением металла в ряду активности. Электролизом водного раствора можно выделить только те металлы, которые находятся в ряду активности правее алюминия (например, Zn, Ni, Sn, Cr, Pb, Co, Cu, Ag, Au, Pd и др.). Алюминий, магний, щелочные и щёлочноземельные металлы, титан извлекают электролизом расплавов их оксидов или хлоридов.
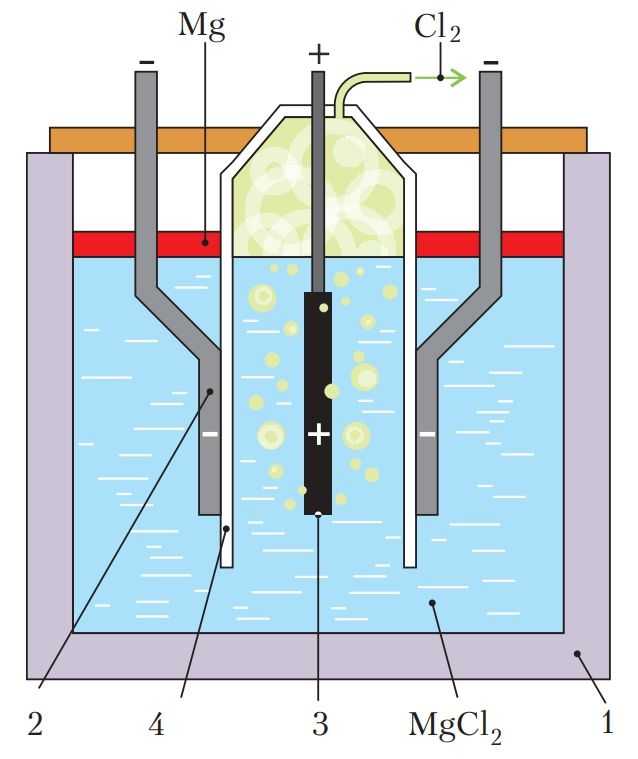 Рис. 108. Схема электролизёра
Рис. 108. Схема электролизёра
Рассмотрим процесс электролиза на примере получения магния из его хлорида (рис. 108).
Ванну электролизёра (1) заполняют расплавленным MgCl2. Для снижения его температуры плавления и повышения электропроводности расплава в него вводят NаСl, СаСl2, КСl и небольшие количества NaF и СаF2. Температуру поддерживают в пределах 720 °С. В этих условиях хлорид магния и другие соли диссоциируют на ионы:
MgCl2 → Mg2+ + 2Cl–.
На катоде — электроде, подключённом к отрицательному полюсу источника постоянного тока (2), протекают процессы восстановления — передача электронов от катода катионам магния:
Mg2+ + 2e– = Mg.
Другие металлы при заданных условиях электролиза не восстанавливаются, потому что концентрация их ионов мала.
Выделяющийся на катоде металлический магний всплывает в катодном пространстве на поверхность электролита, поскольку плотность магния меньше плотности электролита-расплава. Магний периодически удаляют с помощью вакуумного ковша.
На аноде — электроде, подключённом к положительному полюсу источника постоянного тока (3), протекают процессы окисления — электроны переходят от анионов к электроду:
Катодное и анодное пространство электролита разделено перегородкой (4), чтобы выделяющийся хлор не окислял магний и удалялся из электролизёра.
Общие представления о промышленных способах получения важнейших веществ
Ключевые слова конспекта: о промышленных способах получения важнейших веществ, общие способы получения металлов, научные принципы химического производства, химическое загрязнение окружающей среды, природные источники углеводородов, переработка нефти и каменного угля, высокомолекулярные соединения (ВМС), реакции полимеризации и поликонденсации.
Содержание (быстрый переход):
Таблица 4.2. Общие и частные научные принципы химических производств.
4.2.1. Понятие о металлургии: общие способы получения металлов
Таблица 4.2.1.а) Производство чугуна.
Чугун — сплав железа, содержащий более 1,7% углерода, а также кремний, марганец, серу и фосфор.
Таблица 4.2.1.б) Производство стали.
Сталь — сплав железа, содержащий 0,1-2 % углерода и небольшие количества кремния, марганца, фосфора и серы.
Таблица 4.2.2.а) Промышленное производство аммиака
Таблица 4.2.2.б) Промышленное производство серной кислоты.
Таблица 4.2.2.в) Промышленное производство азотной кислоты.
Вы смотрите конспект
«О промышленных способах получения важнейших веществ».
Таблица 4.2.2.г) Промышленное получение метанола.
Химическое загрязнение окружающей среды и его последствия. Многие химические соединения оказывают негативное воздействие на живые организмы. При попадании в организм они могут вызывать химические ожоги, отравления, серьёзные заболевания. Это едкие вещества — кислоты и щёлочи; токсичные вещества — галогены, угарный газ, белый фосфор, сероводород, оксиды азота, метанол, анилин и другие.
Получаемые на химических предприятиях соединения небезопасны для окружающей среды и могут вызывать её загрязнение.
Любое производство имеет отходы. Они попадают в воздух, воду или почву и оказывают отрицательное действие на живые организмы.
К загрязнению почвы и воды приводит неграмотное использование ядохимикатов и минеральных удобрений. Из почвы и воды эти вещества по цепям питания попадают в организм человека. Наиболее опасны азотные удобрения (нитраты), которые могут вызывать тяжёлые отравления.
Большой проблемой является попадание в окружающую среду полимерных материалов (пластиковых бутылок, полиэтиленовых пакетов и др.). Полимеры разлагаются очень медленно и являются источником ядовитых выделений.
Один из способов защиты окружающей среды — создание малоотходных и безотходных технологий. На любом производстве обязательно должна осуществляться очистка отходов.
4.2.3. Природные источники углеводородов, их переработка
Таблица 4.2.3. Переработка нефти.
Октановое число – число, характеризующее детонационную стойкость бензина
Попутный нефтяной газ разделяют на фракции:
- сухой газ — смесь метана и этана
- пропан-бутановая смесь
- газовый бензин — смесь пентана и гексана
Основной способ переработки каменного угля — коксование (прокаливание без доступа воздуха).
Вы смотрите конспект
«О промышленных способах получения важнейших веществ».
Общие способы получения металлов.
Природные соединения металлов:
|
хлориды |
сильвинит КСl ∙ NaCl, каменная соль NaCl; |
|
сульфиды |
серный колчедан FeS2, киноварь HgS, цинковая обманка ZnS; |
|
карбонаты |
мел, мрамор, известняк СаСО3, магнезит MgCO3, доломит CaCO3 ∙ MgCO3; |
|
сульфаты |
глауберова соль Na2SO4 ∙ 10 H2O, гипс CaSO4 ∙ 2Н2О; |
|
оксиды |
магнитный железняк Fe3O4, красный железняк Fe2O3, бурый железняк Fe2O3 ∙ Н2О. |
|
нитраты |
чилийская селитра NaNO3; |
Минералы и горные породы, содержащие металлы и их соединения и пригодные для промышленного получения металлов, называются рудами.
Отрасль промышленности, которая занимается получением металлов из руд, называется металлургией.
Способы получения металлов из руд.
При этом подвергают электролизу расплавы оксидов, гидроксидов или хлоридов:
NaCl (расплав) D Na+ + Cl-
катод Na+ + e à Na0 ¦ 2
2Cl — — 2e à Cl20 ¦ 1
суммарное уравнение: 2NaCl (распл.) – (э. ток)à 2Na + Cl2
Современный способ получения алюминия был изобретен в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит растворяет Al2O3, как вода растворяет сахар.
Al2O3 (расплав) D Al3+ + AlO33–
катод Al3+ +3e à Al 0 ¦ 4
анод 4AlO33– –12 e à 2Al2O3 +3O2 ¦ 1
суммарное уравнение: 2Al2O3(распл.) – (э. ток)à 4Al + 3O2 .
|
Алюмотермия Fe+32O3 +2Al = 2Fe0 + Al2O3 |
Получают железо, хром. |
|
Восстановление оксидов металлов водородом (водородотермия): Cu +2O + H2 –(t)à Cu0 + H2O |
Получают малоактивные металлы – медь, вольфрам. |
|
Получение чугуна: В вертикальной печи кокс окисляется до СО, затем происходит постепенное восстановление железа из руды: |
3Fe2O3 + CO –(t)à 2Fe3O4 + CO2 , Fe3O4 + 4CO –(t)à 3FeО + 4CO2 FeO + CO –(t)à Fe+ CO2 |
|
Восстановление углём (коксом): ZnO + C –(t)à Zn + CO |
Получают цинк, никель. |
3. Гидрометаллургический способ основан на растворении природного соединения с целью получения раствора соли этого металла и вытеснением данного металла более активным. Например, руда содержит оксид меди и ее растворяют в серной кислоте: CuO + H2SO4 = CuSO4 + H2O, затем проводят реакцию замещения:
CuSO4 + Fe = FeSO4 + Cu.
Таким способом получают серебро, цинк, молибден, золото, ванадий.
Если для восстановления требуется оксид металла, то в процессе переработки сначала получают оксид:
а) из сульфида – обжигом в кислороде: 2ZnS + 3O2 = 2ZnO + 2SO2
б) из карбоната – разложением: СаСО3 –(t)à СаО + СО2
Чугун и сталь.
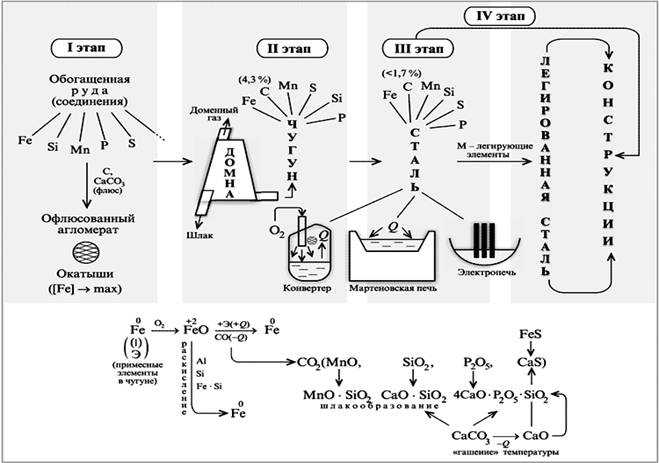
Производство железа основано на карботермическом восстановлении оксидных металлсодержащих руд.
1) Сульфидные и другие руды вначале подвергают окислительному обжигу: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2.
2)Восстановление оксидных руд осуществляется в доменных печах, при этом протекают следующие реакции:
3Fe2O3 + CO –(t)àCO2 + 2Fe3O4, Fe3O4 + CO–(t)àCO2 + 3FeO, FeO + CO–(t)àCO2 + Feили FeO + C –(t)àCO + Fe.
Полученное железо насыщено углеродом. 3)Затем происходит «выжигание» углерода в сталеплавильных или конверторных печах с образованием стали.
Свинцовые сплавы.
Обычный припой (третник) представляет собой сплав примерно одной части свинца с двумя частями олова. Он широко применяется для соединения (пайки) трубопроводов и электропроводов. Из сурьмяно-свинцовых сплавов делают оболочки телефонных кабелей и пластины аккумуляторов. Сплавы свинца с кадмием, оловом и висмутом могут иметь точку плавления, лежащую значительно ниже точки кипения воды (~70° C); из них делают плавкие пробки клапанов спринклерных систем противопожарного водоснабжения. Пьютер, из которого ранее отливали столовые приборы (вилки, ножи, тарелки), содержит 85–90% олова (остальное – свинец). Подшипниковые сплавы на основе свинца, называемые баббитами, обычно содержат олово, сурьму и мышьяк.
Получение активных металлов
Активные металлы (щелочные и щелочноземельные) классическими «химическими» методами получить из соединений нельзя. Такие металлы в виде ионов — очень слабые окислители, а в простом виде — очень сильные восстановители, поэтому их очень сложно восстановить из катионов в простые вещества. Чем активнее металл, тем сложнее его получить в чистом виде — ведь он стремится прореагировать с другими веществами.
Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях.
Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl = 2Na + Cl2
Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С:
Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl = 2Cs + CaCl2
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C:
4BaO+ 2Al = 3Ba + Ba(AlO2)2
Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6:
Производство меди в России и мире
По данным аналитических агентств Российская Федерация уверенно занимает пятую позицию среди стран, занимающихся добычей и получением чистой меди. Производство меди в России в среднем за год составляет 860 тысяч тонн. Основу современной структуры производства меди составляют три крупных холдинга: ОАО «ГМК» Норильский никель» («Норникель»), ООО «УГМКХолдинг» (УГМК) и ЗАО «Русская медная компания» (РМК). Эти компании осуществляют полный цикл производства от добычи руды до изготовления готовых слитков, проката и проволоки. В каждый холдинг входит несколько предприятий, оснащённых самыми совершенными технологиями производства. Благодаря динамическому развитию в прошлом году удалось повысить производство меди на семь процентов.

Мировое производство меди достаточно консолидировано. Почти 35% этого металла производиться пятью крупнейшими компаниями. К ним относятся:
- Codelco (Чили).
- Freeport-McMoRan (США).
- Glencore (Швейцария).
- BHP Billiton (Австралия).
- Southern Copper (Мексика).
Эти компании почти 80% меди получают из первичного сырья (то есть осуществляют полный цикл переработки) и 20% производят в результате переработки поступающего лома. В Европе наиболее крупными производителями меди являются: Польша, Португалия и Болгария. Каждый завод способен осуществлять выпуск широкого ассортимента медной продукции. Несмотря на современный кризис, медь по-прежнему остаётся востребованным металлом. Одним из серьёзных недостатков, присущих этому производству являются экологические проблемы. Оценка выбросов на медеплавильных заводах показали высокий уровень загрязнения окружающего воздуха. В его составе присутствует большое количество вредных для здоровья химических соединений (кадмия, ртути, мышьяка, свинца, оксидов азота и углерода).
§ 81. Способы промышленного получения металлов
Современная металлургия охватывает производство очень большого числа продуктов — около 75 металлов и на их основе многих тысяч сплавов. Способы их промышленного получения многочисленны и разнообразны. Однако перед металлургией любого металла, за редким исключением, стоят две общие задачи: восстановление металла из его окисла или какого-либо другого соединения и отделение металла от других одновременно образующихся веществ. Так, при доменном производстве железо восстанавливается из его окислов и чугун отделяется от образовавшегося шлака.
Путь от руды к металлу складывается часто из десятков последовательно осуществляемых разнообразных механических и химических операций, начиная с обогащения руды и кончая очисткой (рафинированием) металла. Их характер зависит прежде всего от того, каким способом решается основная задача — восстановление металла, какой восстановитель выбран для этой цели.
В промышленности для восстановления железа и многих цветных металлов — цинка, свинца и др.- используют в качестве восстановителей каменноугольный кокс и окись углерода.
Восстановление происходит при высоких температурах, в ряде случаев сопровождается растворением углерода в металле и образованием карбидов. Так, в восстановленном железе растворяется углерод, а также образующийся карбид железа Fe3C Аналогично протекает восстановление углеродом марганца, хрома, ванадия и некоторых других металлов.
Поэтому если необходим сплав с малым содержанием углерода, то часто применяют в качестве восстановителя металлы. Например, хром восстанавливают из окиси хрома алюминием:
Cr2O3 + 2Al = Al2O3 + 2Cr + Q
Реакция начинается после подогрева смеси порошков окиси хрома и алюминия. Она протекает с выделением большого количества теплоты, достаточного для расплавления хрома. Вместо алюминия можно использовать более дешевый кремний.
Восстановление металлов из их соединений другими металлами или кремнием называется металлотермией.
Металлотермические методы получили широкое применение. Кроме хрома, так получают марганец, титан и некоторые другие металлы. В качестве восстановителей, кроме алюминия и кремния, применяют магний, натрий.
Восстановление алюминием называется алюминотермией.
Металлы, отличающиеся большой химической активностью, образуют очень прочные соединения с кислородом и другими элементами. Получение их восстановлением углеродом затруднительно или невозможно вследствие образования соединений углерода с металлом. Также не всегда возможно и часто неэкономично получать такие металлы металлотермическим методом. Их получают электролизом.
Электрохимический способ получения металлов широко применяется в промышленности. Посредством электролиза получают щелочные и щелочноземельные металлы, алюминий, магний, бериллий.
Эти металлы выделяют из электролитов, не содержащих ионов водорода, так как при электролизе водных растворов их солей на катоде выделяется не металл, а водород (вспомните электролиз водного раствора иодида калия).
Электролит не должен содержать также ионы металлов, способных при данных условиях электролиза выделяться на катоде и загрязнять продукт
Поэтому большое внимание уделяют чистоте веществ, подвергаемых электролизу. Получение их часто составляет наиболее сложную часть всей цепи производственных операций в производстве металла из руды
Электрохимический способ применяют и для очистки (рафинирования) металлов, полученных другими методами. Так, из меди, загрязненной примесями никеля и железа, отливают аноды. Их помещают в ванну с электролитом, содержащим серную кислоту и сульфат меди (II). При прохождении через ванну постоянного электрического тока на катоде (медной пластине) осаждается чистая медь.
Таковы основные методы восстановления металлов, применяемые в промышленности. Процессы восстановления углеродом или металлами протекают при высоких температурах и объединяются в группу пирометаллургических. Перевод полезных компонентов руды в раствор и выделение продукта в чистом виде посредством электролиза относятся к гидрометаллургическим процессам.
- Составьте уравнения реакций восстановления металлов всеми известными вам способами.
- Каковы технические и экономические достоинства и недостатки металлотермии по сравнению с восстановлением углеродом топлива?
- Какие требования предъявляют к составу электролитов при получении металлов?
- Как вы объясните, что электрохимические методы получения металлов получили широкое применение только в XX в., хотя реакции были известны уже в начале XIX в.?


















![§ 81. способы промышленного получения металлов [1971 ходаков ю.в., эпштейн д.а., глориозов п.а. - неорганическая химия. учебник для 9 класса]](http://mapisa-plitka.ru/wp-content/uploads/7/5/9/75926d087888c7038319c1c3ebea968a.jpeg)










![§ 81. способы промышленного получения металлов [1971 ходаков ю.в., эпштейн д.а., глориозов п.а. - неорганическая химия. учебник для 9 класса]](http://mapisa-plitka.ru/wp-content/uploads/a/4/7/a477cf4f4f4c036078644a718e5dcd1f.jpeg)
