Виды окислительно-восстановительного титрования
Различают прямое, обратное и заместительное титрование.
Анализ прямым способом проводят при значении ОВ потенциала ≥ 0,4 В, обратным – при низкой скорости реакции. При использовании заместительного способа – титруют эквивалентное количество продукта, образующегося при реакции реагента с анализируемым компонентом.
Классификация методов окислительно-восстановительного титрования проводится по названиям используемых титрантов.
Перманганатометрия. Основа метода – процесс окисления перманганатом калия (KMnO4), образующего ярко окрашенные растворы, являющиеся индикатором титрования. Находит применение для анализа неорганических и органических веществ.
Дихроматометрия. Основа метода – процесс окисления дихроматом калия, реагирующего с соединениями органической природы менее интенсивно, чем KMnO4, поэтому в основном не используется для их анализа. Для нахождения КТТ необходимы дополнительные индикаторы (дифениламин или др).
Применяется для определения неорганических и ряда органических веществ, химического потребления кислорода (ХПК) в воде.
Йодометрия. Основа метода – процесс окисления йодом (I2) или восстановления йодид-ионами. Недостатки — низкая растворимость I2 в воде.
Броматометрия. Основа метода – процесс окисления броматом калия (KBrO3).
Преимущества — возможность определения ненасыщенных, ароматических и гетероциклических соединений, устойчивость растворов KBrO3. Недостатки – побочные продукты, некоторые реакции проходят нестрого в стехиометрических соотношениях.
Цериметрия. Основа метода – процесс окисления сульфатом церия (IV). Преимущества — устойчивость реагентов, отсутствие побочных продуктов, возможность применения в присутствии соляной кислоты.
В представленной классификации описаны наиболее часто используемые окислительно-восстановительные реакции, применяемые в титровании.
Индикаторное и потенциометрическое титрование.
Индикаторное титрование основано на реакции индикатора с окислителем или восстановителем, который изменяет окраску раствора с приближением к ТЭ.
В потенциометрии установление ТЭ проводят по изменению потенциала электрода в процессе взаимодействия потенциалоопределяющего компонента и титранта.
Преимущества метода заключаются:
-
в получении более точных результатов, титрования веществ, для которых не подобраны индикаторы или если их применение невозможно;
-
в анализе нескольких компонентов в одном растворе;
-
в хорошей воспроизводимости, отсутствии индикаторной ошибки.
Индикаторы, используемые в окислительно-восстановительном титровании, делятся на 4 основные группы: специфические, редокс-индикаторы, комплексные соединения некоторых металлов, органические красители, окисляемые необратимо.
Титрование, проводимое с помощью фотометрического датчика, позволяет определять ТЭ по изменению оптических свойств титруемого раствора (оптической плотности, величин пропускания и поглощения, спектральных характеристик). К преимуществам данного метода относится возможность проведения реакций, в которых визуально невозможно определить КТТ из-за неярко выраженного изменения окраски, а также возможность автоматизации методик индикаторного титрования для нормативных документов, в которых не описана потенциометрия.
Подбор электродов для О-В титрование
Для решения определенной задачи необходимо правильно подобрать систему электродов. В случае потенциометрического титратора GT-200 производителем разработан гид для выбора электродов.
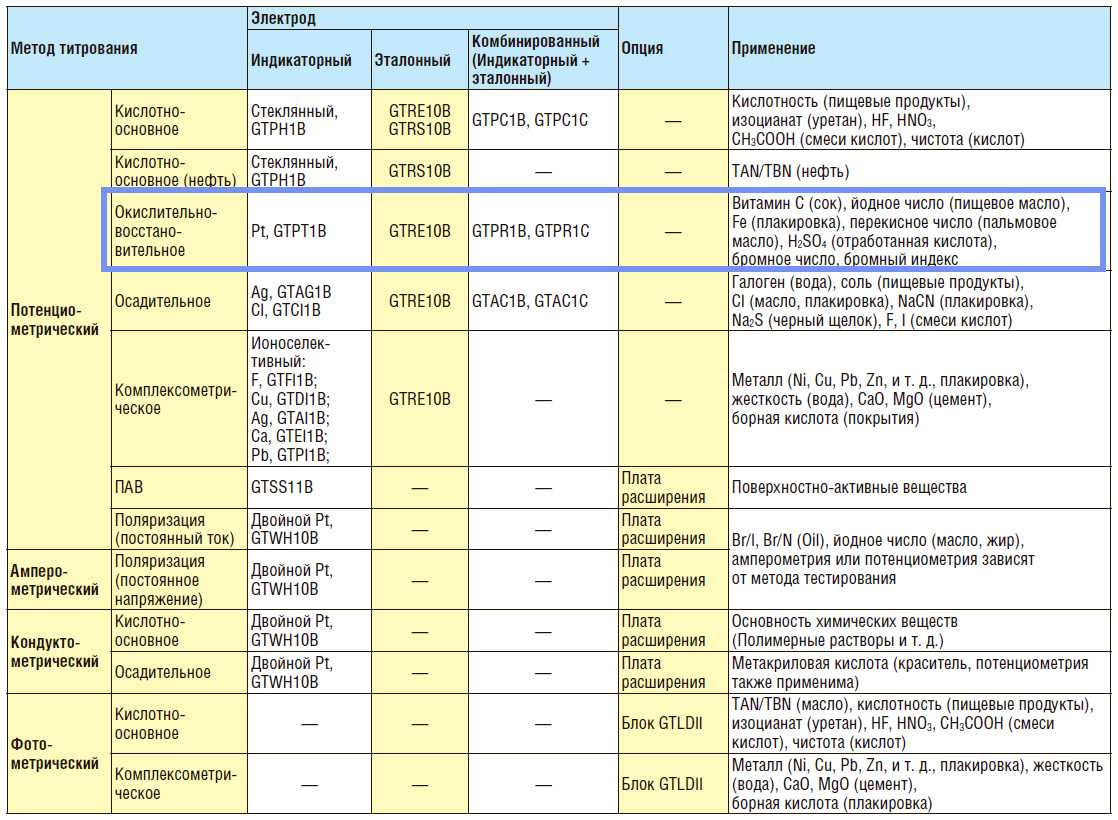
ОВ-электроды изготавливаются из благородных металлов (Pt, Au). Наиболее распространенными являются Pt-электроды.
Для окислительно-восстановительного титрования предлагается использование раздельной пары электродов, состоящей из: измерительного платинового (GTPT1B) и стеклянного хлорсеребряного электрода сравнения (GTRE10B), и комбинированных платиновых электродов (GTPR1B, GTPR1C).
Предусмотрена возможность подключения дополнительного оборудования: весов, автосамплера (GT-200SC), принтера, диспенсера растворителя (GT-200SD), фотометрического детектора (GTLDII).
Иодометрия
основана на полуреакции $\ce {I3^- +2e^- <->3I^-}$. Один из лучших методов О.-в. т., появился в 1826. Значительный вклад в развитие метода внесли: нем. фармацевт А. Ф. Дюфло (1845) – определял $\ce {Fe^{3+}}$, титруя иод, выделяющийся при взаимодействии $\ce {Fe^{3+}}$ с $\ce {KI}$, стандартным раствором $\ce {SnCl2}$ в присутствии индикатора (крахмала); франц. фармаколог А. Ф. Готье де Клобри (1846) – определял $\ce {Sn^{2+}}$, титруя его спиртовым раствором $\ce {I2}$ в присутствии крахмала; нем. химик Г. Шварц (1853) – предложил титровать $\ce {I2}$ раствором $\ce {Na2S2O3}$, и с тех пор методику применяют практически без изменений. Иод – довольно слабый окислитель ($E^0$ = 0,54 В), поэтому определять можно и окислители, и восстановители. Прямое титрование восстановителей (сульфидов, сульфитов, $\ce {As^{3+}}$ в органич. соединениях, альдозы в сахарах) раствором $\ce {I2}$ называют иодиметрией, косвенное (заместительное) титрование окислителей – иодометрией. При определении окислителей к анализируемому раствору прибавляют избыток $\ce {KI}$ (необходим для достижения полноты протекания реакции и превращения образовавшегося $\ce {I2}$ в $\ce {I3^-}$ для снижения потерь из-за летучести $\ce {I2}$), выделившийся иод титруют стандартизованным раствором $\ce {Na2S2O3}$ до бледно-жёлтой окраски раствора, прибавляют крахмал и титруют до появления синей окраски. Иодометрия – незаменимый метод определения $\ce {Cl2}$, $\ce {Br2}$, $\ce {IO3^-}$, $\ce {Cr2O7^{2-}}$, $\ce {Ce^{4+}}$, $\ce {Fe^{3+}}$, а также меди в сплавах, рудах, полупроводниковых материалах, растворённого $\ce {O2}$. Существенный недостаток метода – неустойчивость раствора титранта $\ce {Na2S2O3}$ (разрушается при взаимодействии с $\ce {O2}$и $\ce {CO2}$ воздуха).
Сущность окислительно-восстановительного титрования
Метод окислительно-восстановительного титрования (ОВ) основан на химической реакции между определяемым компонентом и стандартным раствором окислителя или восстановителя (титранта). Количественное содержание анализируемого вещества устанавливается с помощью измерения точных объемов растворов с известными концентрациями, взаимодействующих друг с другом. Возможность и степень прохождения реакции характеризуется окислительно-восстановительным потенциалом.
Для проведения ОВ титрования необходимо выполнение определенных требований:
титрант должен реагировать только с анализируемым компонентом, нацело и быстро;
простота и воспроизводимость обнаружения конечной точки титрования (КТТ).
Зависимость определяемой величины (потенциала) от объема титранта, представленная в виде графика, называется кривой титрования, построение которой нужно для нахождения точки эквивалентности (ТЭ).






























