ОСНОВНЫЕ СТЕХИОМЕТРИЧЕСКИЕ ЗАКОНЫ
1. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
1.Закон сохранения массы и энергии. Это объединенный закон. В него входят два закона.
Масса веществ, вступивших в реакцию, равна массе продуктов реакции.
Этот закон был открыт М.В. Ломоносовым (1748 г.) и дополнен А.Л.Лавуазье в 1789 г.
В процессе реакции сохраняется масса каждого элемента
Этот закон позволяет составлять уравнения химических реакций и осуществлять расчеты на их основе. Он не является абсолютным. Абсолютным является закон сохранения энергии.
Закон сохранения энергии
Энергия не возникает из ничего и не исчезает, а только переходит из одного вида в другой.
Этот закон – результат работ А. Эйнштейна. Он установил связь между энергией и массой вещества (1905 г.):
Е = mc2,
где с – скорость света в вакууме, равная ~ 300 000 км/с.
Поскольку в результате химической реакции выделяется или поглощается энергия, то, в соответствии с уравнением Эйнштейна, изменяется и масса веществ. Однако это изменение столь мало, что на практике не учитывается (так называемый дефект массы).
Следующие законы справедливы только для соединений с постоянным составом молекул (дальтонидов). Они отличаются от соединений, имеющих переменный состав молекул – бертоллидов.
2. Закон постоянства состава (Ж. Пруст, 1801).
Соотношение между массами химических элементов, входящих в состав данного соединения, есть величина постоянная, не зависящая от способа его получения.
Например, как бы не получали воду – при сгорании водорода (2Н2 + О2 = 2Н2О) или при разложении гидроксида кальция (Са(ОН)2 = СаО + Н2О) – отношение масс атомов водорода и кислорода в реакции равно ~ 1:8.
3. Закон кратных отношений (Дж. Дальтон, 1803).
Если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящееся на определенную массу другого, относятся друг к другу как небольшие целые числа.
Этот закон подтвердил атомистическое представление о структуре материи: раз элементы соединяются в кратных отношениях, то химические соединения распадаются на целые атомы. Например, на 1 г азота в его оксидах N2O, NO, N2O3, NO2 и N2O5 приходится 0,57; 1,14; 1,71; 2,28 и 2,85 г кислорода, что соответствует отношению 1:2:3:4:5. Однако в случае соединений переменного состава этот закон неприменим.
4. Закон простых объемных отношений (Ж. Гей-Люссак, 1808).
При равных условиях объем вступающих в реакцию газов относятся друг к другу и к объемам образовавшихся газообразных продуктов как небольшие целые числа.
так, например, в реакции образования аммиака из простых веществ
N2 (г) + 3H2 (г) = 2NH3 (г)
отношение объемов азота (N), водорода (H) и аммиака (NH3) составляет 1:3:2.
5. Закон Авогадро (1811).
В равных объемах различных газов при одинаковых условиях (р и Т) содержится одинаковое число молекул.
Этот закон вытекает из анализа уравнения состояния идеального газа Клапейрона–Менделеева:
рV = nRT.
Это уравнение можно записать для двух газов:
p1V1 = n1RT1;
p2V2 = n2RT2.
При равенстве р1 = р2, Т1 = Т2 и V1 = V2 будут равны и количества вещества газов: n1 = n2 или, с учетом числа Авогадро:
n1· NA = n2· NA,
т.е. будет равно и число молекул газов.
Закон Авогадро имеет следствия:
- Одинаковое число молекул любого газа при одинаковых условиях занимает один и тот же объем.
- Массы газов, взятых в одинаковых объемах при одинаковых условиях (р, Т), относятся друг к другу как их молярные массы:
m1/m2 = M1/M2. (1)
Это следствие вытекает из равенства количеств веществ этих газов n1 = n2.
Подставляя вместо количества вещества отношения его массы к молярной массе n = mMполучим
m1M1= m2M2илиm1m2 = M1M2.
Второе следствие позволяет вывести уравнение для определения молярной массы неизвестного газа по известной величине относительно плотности этого газа по другому известному газу.
После подстановки в числитель и знаменатель левой части уравнения (1) объемов первого и второго газов, которые равны, получаем:
m1 · V2 m2 · V1 = M1M2.
Отношение массы вещества к объему заменяем на плотность (ρ = mV): ρ1/ ρ2 = M1M2
и получим уравнение для расчета молекулярной массы первого газа по второму:
M1 = (ρ1/ρ2) M2 = D1/2M2 (2)
Или в общем виде:
M= DгМг. (3)
где Dг – относительная плотность первого газа по второму.
Если известна плотность данного газа по водороду, то используется уравнение:
М = 2D(Н2). (4)
Если известна плотность газа по воздуху, то используют уравнение:
М = 29 Dвозд. (5)
Расчеты по химическим уравнениям
Расчеты по химическим уравнениям (стехиометрические расчеты) основаны на законе сохранения массы веществ. В реальных химических процессах из-за неполного протекания реакций и потерь масса продуктов обычно меньше теоретически рассчитанной. Выходом реакции (h) называют отношение реальной массы продукта (mp) к теоретически возможной (mт), выраженное в долях единицы или в процентах.
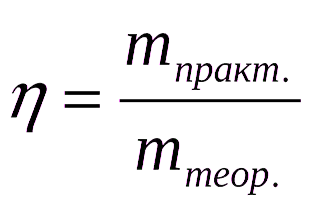
Если в условиях задач выход продуктов реакции не указан, его в расчетах принимают за 100% (количественный выход).
Пример 1
Сколько г меди образуется при восстановлении 8 г оксида меди водородом, если выход реакции составил 82%?
Решение
CuO + H2 = Cu + H2O
- Рассчитаем теоретический выход меди по уравнению реакции: 80 г (1 моль) CuO при восстановлении может образовать 64 г (1 моль) Cu; 8 г CuO при восстановлении может образовать Х г Cu
- Определим, сколько граммов меди образуется при 82% выходе продукта:
6,4 г –– 100% выход (теоретический)
Х г –– 82%
X = (8 • 82) / 100 = 5,25 г
Закон постоянства состава
Сущность закона постоянства состава (Пруст, 1801 г.) заключается в том, что каждое химическое соединение независимо от способа и условий ее добычи имеет определенный массовый состав.
Соотношение между массами элементов, входящих в состав определенной соединения, являются постоянными и не зависят от способа получения этого соединения.
Этот закон не имеет абсолютного обобщенного характера, поскольку в природе существует два типа соединений — с постоянным и с переменным составом.
Соединения, которые имеют постоянный состав и целочисленное атомное соотношение компонентов, называются Дальтониды .
К ним относятся вещества, которые в обычных условиях находятся в газообразном (СО2 , NH3 , NO, HCl) или жидком (Н2О, С6Н6) состоянии или могут быть легко переведены в них, а также кристаллические вещества с молекулярной структурой (I2 , лед).
Соединения переменного состава, в которых стехиометрические соотношения компонентов не соответствуют целым числам, называются бертоллидами .
Бертоллиды не имеют молекулярной структуры. К ним относится подавляющее большинство кристаллических соединений переходных d- и f- элементов: оксиды, гидриды, нитриды, сульфиды, карбиды и другие бинарные соединения. Следует заметить, что на постоянство состава влияет и изотопный состав, например, в обычной воде Н2О и в тяжелой воде D2О массовые доли кислорода различаются.
Итак, состав химических соединений зависит от типа химической связи, агрегатного состояния веществ, изотопного состава и условий их добычи и может быть как постоянным, так и переменным. Поэтому в настоящее формулировки закона постоянства состава внесены некоторые уточнения:
Основные законы химии
Закон постоянства состава был установлен французским учёным Ж. Прустом в 1801 году.
В современной формулировке закон гласит: всякое химически чистое вещество молекулярного строения независимо от способа получения имеет постоянный состав, то есть состоит из одних и тех же химических элементов, атомы которых находятся в постоянных для данного вещества количественных соотношениях.
Закон сохранения массы веществ масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ.
Закон Авогадро в равных объёмах различных газов при одинаковых условиях содержится одинаковое число молекул. Сформулировал закон итальянский учёный А. Авогадро в 1811 году.
Периодический закон Д. И. Менделеева был открыт в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс. Современная формулировка гласит: свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Закон объёмных отношений (закон Ж. Гей-Люссака): объёмы вступающих в реакцию газов относятся друг к другу и к объёмам образующихся продуктов реакции как небольшие целые числа. Подразумевается, что давление и температура неизменны. Закон был сформулирован в 1802 году французским физиком и химиком Жозефом Луи Гей-Люссаком.
Простые и сложные вещества. Валентность
Вещества бывают простые и сложные. Если молекула состоит из атомов одного химического элемента, — это простое вещество:
Если в состав вещества входят атомы только одного химического элемента — это простое вещество. Причём некоторые химические элементы образуют несколько простых веществ. Так, химический элемент кислород образует простое вещество «кислород» О2 и простое вещество «озон» О3*.
А химический элемент углерод образует четыре простых вещества, причём ни одно из них не называется «углерод». Эти вещества отличаются пространственным расположением атомов:
Алмаз — атомы углерода находятся в вершинах воображаемых тетраэдров;
Графит — атомы углерода находятся в одной плоскости;
Карбин — атомы углерода образуют «нити».
В четвертой модификации «углерода» — фуллерене — атомы углерода образуют сферу, т. е. молекулы фуллерена напоминают мячик.
Существование элемента в виде нескольких простых веществ называется аллотропией. Алмаз, графит, карбин, фуллерен — аллотропные модификации элемента «углерод», а кислород и озон — аллотропные модификации элемента «кислород».
Таким образом, не следует путать эти понятия: «химический элемент» и «простое вещество», а также «молекула» и «атом».
Очень часто в письменных записях слова «молекула» или «атом» заменяют соответствующими символами, но не всегда правильно. Так, нельзя писать: «В состав воды входит Н2», так как речь здесь идёт о химическом элементе водороде — Н. Нужно писать: «В состав воды входит (Н)». Аналогично, правильной будет запись: «При действии металла на раствор кислоты выделится Н2», т. е. вещество водород, молекула которого двухатомна.
Молекулы сложных веществ состоят из атомов разных химических элементов:
Как известно, в состав сложных веществ входят атомы разных химических элементов. Эти атомы соединяются между собой химическими связями: ковалентными, ионными, металлическими.
Способность атома образовывать определённое число ковалентных химических связей называется валентностью. (Подробнее см. урок 4 «Химическая связь».) Правильнее всего определять валентность по графическим или структурным формулам:
В таких формулах одна чёрточка обозначает одну ковалентную связь, т. е. «одну валентность». На практике чаще всего валентность определяют по молекулярной формуле, хотя здесь правильнее говорить о степени окисления элемента (см. урок 7). Иногда результат определения степени окисления соответствует реальному значению валентности, но бывают и неодинаковые результаты.
Задание 1.1. Определите «валентность» (степени окисления) атомов кальция и углерода по формуле СаС2. Совпадает ли полученный результат с реальным значением валентности?
В устойчивой молекуле не может быть «свободных», «лишних» валентностей! Поэтому для двухэлементной молекулы число химических связей (валентностей) атомов одного элемента равно общему числу химических связей атомов другого элемента.
Валентность атомов некоторых химических элементов постоянна (табл. 2).
Для других атомов валентность можно определить (вычислить) из химической формулы вещества.
При этом следует учитывать изложенное выше правило о химической связи.
Сделаем практические выводы.
1. Если один из атомов в молекуле одновалентен, то валентность второго атома равна числу атомов первого элемента (см. на индекс!):
2. Если число атомов в молекуле одинаково, то валентность первого атома равна валентности второго атома:
3. Если у одного из атомов индекс отсутствует, то его валентность равна произведению валентности второго атома на его индекс:
4. В остальных случаях ставьте валентности «крест-накрест», т. е. валентность первого атома равна числу атомов второго элемента и наоборот:
Задание 1.2. Определите валентности элементов в соединениях:
Вначале укажите валентности атомов, у которых она постоянна! Аналогично определяется валентность атомных групп (ОН), (РО4), (SО4) и так далее.
Задание 1.3. Определите валентности атомных групп (в формулах выделены курсивом):
Обратите внимание! Одинаковые группы атомов (OH), (РО4), (SO4) имеют одинаковые валентности во всех соединениях. Зная валентности атома или группы атомов можно составить формулу соединения
Для этого пользуются правилами:
Зная валентности атома или группы атомов можно составить формулу соединения. Для этого пользуются правилами:
Если валентности одинаковы, то и число атомов одинаково, т. е. индексы не ставим:
Если валентности кратны (одно число делится на другое), то число атомов элемента с меньшей валентностью определяем делением:
В остальных случаях индексы определяют «крест-накрест»:
Задание 1.4. Составьте химические формулы соединений:
Закон объемных соотношений Гей-Люссака
В химических реакциях с участием газов очень часто наблюдается изменение объема реакционной системы. В отличие от постоянства массы веществ, участвующих в реакции и образуются вследствие нее, при взаимодействии газов объем реакционной системы может увеличиваться, уменьшаться или оставаться неизменным. Соотношение между объемами газов устанавливает закон объемных соотношений Гей-Люссака (1808 г.):
Этот закон справедлив только в том случае, когда объемы газов измерены при одинаковых условиях.
Из закона Гей-Люссака следует, что стехиометрические коэффициенты в уравнении реакции являются кратными к объемам газов, которые взаимодействуют и образуются.
С помощью закона объемных соотношений можно рассчитать объемы газов или устанавливать состав исходного газа.






























