Растворимость газов в жидкостях. Законы Генри—Дальтона и Сеченова.
Растворение газов в жидкостях почти всегда сопро–вождается выделением теплоты. Поэтому раствори–мость газов с повышением температуры согласно принципу Ле Шателье понижается. Эту закономер–ность часто используют для удаления растворенных га–зов из воды (например СО2 ) кипячением. Иногда рас–творение газа сопровождается поглощением теплоты (например, растворение благородных газов в некото–рых органических растворителях). В этом случае повы–шение температуры увеличивает растворимость газа.
Газ не растворяется в жидкости беспредельно. При не–которой концентрации газа Х устанавливается равно–весие:
При растворении газа в жидкости происходит значи–тельное уменьшение объема системы. Поэтому повы–шение давления согласно принципу Ле Шателье долж–но приводить к смещению равновесия вправо, т. е. к увеличению растворимости газа. Если газ малораст–ворим в данной жидкости и давление невелико, то растворимость газа пропорциональна его давлению. Эта зависимость выражается законом Генри (1803г.): количество газа, растворенного при данной тем–пературе в определенном объеме жидкости, при равновесии прямо пропорционально давлению газа.
Закон Генри может быть записан в следующей форме:
Где – концентрация газа в насыщенном раство–ре, моль/л;
Р(Х) – давление газа Х над раствором, Па;
Кr(Х) – постоянная Генри для газа Х, моль×л-1 × Па -1 .
Константа Генри зависит от природы газа, рас–творителя и температуры.
Закон Генри справедлив лишь для сравнительно раз–бавленных растворов, при невысоких давлениях и отсут–ствии химического взаимодействия между молекулами растворяемого газа и растворителем.
Закон Генри является частным случаем общего закона Дальтона. Если речь идет о растворении не одного газооб–разного вещества, а смеси газов, то растворимость каж–дого компонента подчиняется закону Дальтона: раство–римость каждого из компонентов газовой смеси при постоянной температуре пропорциональна парциаль–ному давлению компонента над жидкостью и не зави–сит от общего давления смеси и индивидуальности других компонентов.
Иначе говоря, в случае растворения смеси газов в жидкости в математическое выражение закона Генри вместо подставляют парциальное давление р! дан–ного компонента.
Под парциальным давлением компонента понимают долю давления компонента от общего давления газовой смеси:
Парциальное давление компонента рассчитывают по формуле.
Изучая растворимость газов в жидкостях в присутст–вии электролитов, русский врач-физиолог И. М. Сече–нов (1829—1905) установил следующую закономерность (закон Сеченова): растворимость газов в жидкостях в присутствии электролитов понижается; происходит высаливание газов.
Где рi – парциальное давление компонента Хi;
Робщ – общее давление газовой смеси;
Х(Хi) – молярная доля i-ого компонента.
Изучая растворимость газов в жидкостях в присутствии электролитов, русский враччфизиолог И. М. Сеченов (1829—1905) установил следующую закономерность (закон Сеченова): растворимость газов в жидкостях в присутствии электролитов понижается; происходит высаливание газов.
-
Талантливый человек талантлив во всем реферат
-
Мир человека как культура реферат
-
Алатау тауы туралы реферат
-
Интеграционные процессы в африке реферат
- Государственное регулирование инвестиционной деятельности в рб реферат
Парциальное давление
Общее давление равно 1 атм, или 760 мм.рт.ст., но в законе Генри используется парциальное давление. Например, в системе находится 10 молекул (5 молекул одного газа и 5 молекул другого газа). Чтобы найти парциальное давление, необходимо учитывать только 50 % от общего числа молекул. Т. о. парциальное давление равно 380 мм.рт.ст, т. к. учитывается только 50 % молекул.
Если в системе находится 8 молекул одного газа и 2 молекулы другого газа, то парциальное давление изменится. Для 8 молекул (80 % от общего числа молекул) парциальное давление составляет 680 мм.рт.ст. Т. о., если увеличивается число молекул, значит, увеличивается и парциальное давление.
Распределение растворенного вещества между двумя растворителями
Если водный раствор иода взболтать с хлороформом, то большая часть иода перейдет в хлороформ. Отношение концентрации иода в этих двух фазах, называемое коэффициентом распределения, остается постоянным в области малых концентраций растворенного вещества в каждой фазе. Для иода в хлороформе и в воде при комнатной температуре этот коэффициент равен 250; отсюда следует, что при взбалтывании раствора иода в хлороформе с водой или раствора иода в воде с хлороформом при достижении равновесия концентрация иода в фазе хлороформа будет в 250 раз превышать концентрацию иода в водной фазе.
Из рассмотрения различных равновесий следует, что коэффициент распределения растворенного вещества между двумя растворителями равен отношению растворимостей данного вещества (в виде кристаллической, жидкой или газообразной фазы) в двух растворителях, если растворимости невелики.
Метод взбалтывания раствора с неемешивающимся растворителем широко применяется в органической химии и особенно в химии природных соединений в тех случаях, когда необходимо выделить одно или несколько растворенных веществ из раствора. В неорганической химии этот метод находит иное применение — для определения концентрации того или иного вещества. Так, иод соединяется с иодид-ионом и образует трииодид-ион: I2 + I- → I3— Концентрацию молекулярного иода I2 в растворе, содержащем I2 и I3-, можно определить взбалтыванием с хлороформом, последующим анализом раствора иода в хлороформе и делением установленной таким образом концентрации на коэффициент распределения. (Трииодид-ион в хлороформе не растворяется.)
* Закон открыт английским химиком Уильямом Генри (1775—1836).
** Атмосферный азот содержит 98,8% N2 и 1,2% Аr.
Пример 9.5.
Растворимость атмосферного азота** в воде при 0°С и 1 атм равна 23,54 мл·л-1, а растворимость кислорода при тех же условиях равна 48,89 мл·л-1. В воздухе содержится 79% N2 и 21% О2 по объему. Какой состав имеет растворенный воздух?
Решение. Растворимости азота и кислорода при (Парциальных давлениях 0,79 и 0,21 атм соответственно равны 0,79×23,54=18,60 мл·л-1 и 0,21×48,89 =40,27 мл·л-1. Отсюда можно определить состав растворенного воздуха:
$\frac{18,60}{18,60 + 10,27}=64,4$ % азота и $\frac{10,27}{18,60 + 10,27}=35,6$ % = кислорода.
Растворимость большинства газов в воде по порядку величины не отличается от растворимости воздуха. Исключения составляют газы, которые химически соединяются с водой или сильно диссоциируют на ионы; к их числу относятся СО2 (растворимость 1713 мл·л-1 при 0°С), Н2S (4670 мл·л-1 при 0°С), а также SO2 и NH3, обладающие исключительно высокой растворимостью.
приложений
— Закон Генри может быть применен для расчета поглощения инертных газов (азота, гелия, аргона и т. Д.) В различных тканях человеческого тела, и что вместе с теорией Холдейна являются основой таблиц декомпрессия.
— Важным применением является насыщение газа кровью. Когда кровь ненасыщена, газ растворяется в ней, пока она не насыщается и не прекращает больше растворяться. Как только это происходит, растворенный в крови газ попадает в воздух.
— Газификация безалкогольных напитков является примером применения закона Генри. Безалкогольные напитки имеют СО2 растворяется при высоком давлении, сохраняя тем самым каждый из объединенных компонентов, которые его составляют; а также, он сохраняет характерный вкус гораздо дольше.
Когда бутылка с газировкой открыта, давление на жидкость снижается, сбрасывая давление на месте.
Поскольку давление на жидкость теперь ниже, растворимость СО2 он спускается и уходит в атмосферу (это можно заметить при всплытии пузырьков снизу).

— Когда дайвер спускается на большую глубину, вдыхаемый азот не может вырваться, потому что внешнее давление препятствует ему, растворяясь в крови человека..
Когда дайвер быстро поднимается на поверхность, где внешнее давление становится ниже, азот начинает пузыриться в крови.
Это вызывает то, что известно как дискомфорт декомпрессии. Именно по этой причине дайверы должны медленно подниматься, чтобы азот выходил из крови медленнее.
— Изучение влияния снижения молекулярного кислорода (О2) растворены в крови и тканях альпинистов или практикующих специалистов, связанных с длительным пребыванием на больших высотах, а также у жителей достаточно высоких мест.
— Исследование и усовершенствование методов, используемых для предотвращения стихийных бедствий, которые могут быть вызваны присутствием растворенных газов в огромных водоемах, которые могут быть выброшены с применением силы.
5.Типы растворов жидкостей в жидкостях, причины их разнообразия.
Растворы:
1.
Неограниченная растворимость
(вода-спирт, КСl – KBr ,нефть)
а) Жидкости,растворимые друг в друге в любых отношениях
и не имеющие постоянной температуры кипения.Их подразделяют также на смеси с
идеальными и неидеальными св-ми:
-с
идеальными св-ми — силы ММВ между однородными и разнороными молекулами
равны(бензол+толуол);
-с
реальными в-ми – силы ММВ между однородными мол-ми незначительно больше чем
между разнородными,т.е. происходит диссоциация ассоциатов,образованных из однородных
мол-л(положительные отклонения от св-в идеальных растворов; бензол+ацетон).Или
силы ММВ между разнородными молекулами незначительно больше чем между
однородными,т.е.в растворах создаются прочные сольваты.(отрицательные
отклонения; хлороформ+диэтиловый эфир)
б) Жидкости, неограниченно растворимые друг в друге и
образующие смеси с минимумом Ткип или максимумом давления пара.
в) Жидкости,неограниченно растворимые друг в друге и
образующие смеси с максимумом Ткип или минимумом давления пара.
2.
Ограниченная растворимость ( вода
– эфир,анилин-вода,фенол-вода).Силы ММВ между однородными молекулами гораздо
выше сил ММВ между разнородными.
3.
Практически полная нерастворимость
(вода – керосин,бензол-вода).Силы ММВ между однородными молекуами не равны 0,а
между разнородными по природе мол-ми равны 0.
Различные типы растворов
объясняются:
1.
изм-ием межмолекулярного
взаимодействия
2.
различием в размере молекул
3.
природой молекул.
Вступление
Растворы находят широкое применение в самых различных областях практики. Категории растворов относятся и природный раствор воды, и такие материалы, как сырая нефть и различные нефтепродукты-бензины, керосин, вазелин, парафин, смазочные масла, жидкие сплавы металлов, расплавленные смеси силикатов смеси органических растворителей, различные водноспиртовые смеси и др.
Во второй половине прошлого века существовало две противоположных точки зрения на процесс растворения. Для первой точки зрения характерно рассмотрение процесса растворения как явления химического, для второго — как физического. В химических теориях предполагалось, что растворенное вещество и растворитель химически взаимодействуют между собой. С физической точки зрения растворенное вещество можно рассматривать, как находящееся в газообразном состоянии и применять к нему законы кинетической теории газов.
Каждая из этих теорий была разработана и внесла свой вклад в создание современной теории растворов, в которой принимаются во внимание и химические, и физические факторы. В развитии учения о растворах выдающаяся роль принадлежит работам Д.И
Менделеева. Он рассматривал растворы как неустойчивые химические соединения постоянного состава, находящиеся в состоянии частичной диссоциации. Этим было положено начало химической теории растворов в противовес физическим теориям, игнорировавшим значение химического взаимодействия
В развитии учения о растворах выдающаяся роль принадлежит работам Д.И. Менделеева. Он рассматривал растворы как неустойчивые химические соединения постоянного состава, находящиеся в состоянии частичной диссоциации. Этим было положено начало химической теории растворов в противовес физическим теориям, игнорировавшим значение химического взаимодействия.
Общей теории растворов — теории, которая давала бы возможность определять свойства раствора по известным свойствам компонентов в чистом состоянии и известному составу раствора, — в настоящее время еще нет.
Только для растворов очень разбавленных (в пределе бесконечно разбавленных) удалось еще в 80-х годах прошлого века создать начала количественной теории, дающей возможность определять некоторые свойства растворов по известной их концентрации. В таких растворах молекулы растворенного вещества разобщены друг от другого большим количеством молекул растворителя. Вследствие этого их взаимодействие не проявляется в заметной степени.
отклонение
Для газов, плохо растворимых в жидкостях, решение приближается идеально, в соответствии с законом Генри для растворенного вещества.
Однако когда давление высокое, возникает отклонение от Генри, потому что раствор перестает вести себя как идеально разбавленный.
Что это значит? Что взаимодействия растворенного вещества и растворенного вещества начинают иметь свои собственные эффекты. Когда раствор сильно разбавлен, молекулы газа «исключительно» окружены растворителем, презирая возможные столкновения между собой..
Поэтому, когда раствор перестает быть идеально разбавленным, наблюдается потеря линейного поведения на графике PЯ против ХЯ.
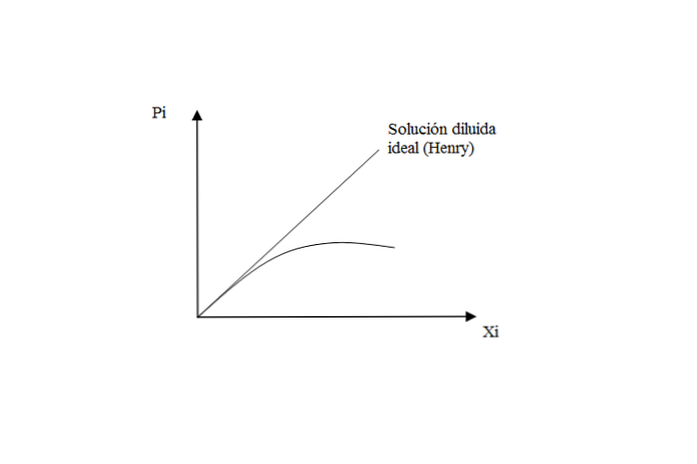
В заключение к этому аспекту: закон Генри определяет давление пара растворенного вещества в идеальном разбавленном растворе. В отношении растворителя действует закон Рауля:






























