Биологическая роль и содержание в живых организмах
Марганец содержится в организмах всех растений и животных, хотя его содержание обычно очень мало, порядка тысячных долей процента, он оказывает значительное влияние на жизнедеятельность, то есть является микроэлементом. Марганец оказывает влияние на рост, образование крови и функции половых желёз. Особо богаты марганцем листья свёклы — до 0,03 %, а также большие его количества содержатся в организмах рыжих муравьёв — до 0,05 %. Некоторые бактерии содержат до нескольких процентов марганца.
Избыточное накопление марганца в организме сказывается, в первую очередь, на функционировании центральной нервной системы. Это проявляется в утомляемости, сонливости, ухудшении функций памяти. Марганец является политропным ядом, поражающим также лёгкие, сердечно-сосудистую и гепатобиллиарную системы, вызывает аллергический и мутагенный эффект.
Соединения марганца в овр
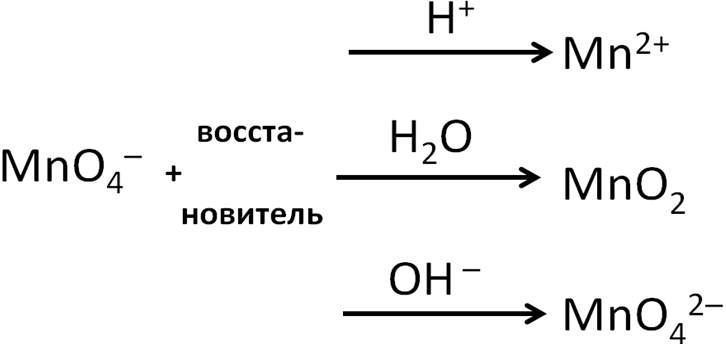
Перманганат-ион
выступает окислителем в любой среде,
от рН среды зависит продукт восстановления
перманганата-иона. Кислую
среду создают серная, азотная, соляная
и другие сильные кислоты, раствор
сернистого газа.
Азотная кислота помимо создания кислой
среды будет проявлять окислительные
свойства, а соляная (и другие
галогеноводородные кислоты, кроме HF)
– восстановительные свойства. Щелочная
среда создается растворами щелочей и
аммиака, сульфидов щелочных металлов.
Тот или иной продукт восстановления
объясняется его устойчивостью в данной
среде. В некоторых заданиях С1 в качестве
продукта восстановления KMnO4вщелочной
среде указывается оксид марганца (IV).
Это объясняется тем, что манганат
(K2MnO4)
в принципе неустойчивое вещество и в
растворе самопроизвольно диспропорционирует
на оксид марганца(IV)
и перманганат.
Схема
1. Поведение перманганат-иона в ОВР
|
KMnO4 |
||
|
в MnO4—+ |
в |
в MnO4—+ |
|
(соль |
MnO2↓ |
Манганат |
|
5K2SO3 |
2КМnО4+ |
K2SO3 |
Приведем
примеры, следуя выше указанной схеме:
KMnO4
+ К2SO3
+ H2SO4
Окислитель
восстановитель создает кислую
среду,
Следовательно
перманганат превратится в сульфат
марганца (II),
сульфит окислится до сульфата, ионы
калия свяжутся сульфат-ионами, ионы
водорода превратятся в воду.
2KMnO4
+ 5К2SO3
+ 3H2SO4=
6К2SO4+
2MnSO4+
3H2O
KMnO4
+ К2SO3+
H2O
Окислитель
восстановитель среда близка к
нейтральной (слабо щелочная из-за
гидролиза сульфита) , следовательно
перманганат превратится в оксид марганца
(IV),
сульфит окислится до сульфата, ионы
калия свяжутся с гидроксид-ионами.
2KMnO4
+ 3К2SO3
+ H2O
= 3К2SO4+
2MnO2+2KOH
KMnO4
+ К2SO3
+ KOH
Окислитель
становитель создает щелочную
среду,
Следовательно
перманганат превратится в манганат
калия, сульфит окислится до сульфата,
побочный продукт — вода:
2KMnO4
+К2SO3
+ 2KOH = К2SO4+
2 K2MnO4+
H2O
2KMnO4
+ 5SO2
+ 2H2O=
К2SO4+
2MnSO4+
2H2
SO4
Создает
кислую среду
Другие соединения марганца:
|
Cоли |
||
|
кислая |
нейтральная |
щелочная |
|
KMnO4 HMnO4 |
оксид |
K2MnO4 |
|
2Mn(NO3)2 2MnSO4+ 2Mn(NO3)2 |
MnCl2 MnO2+ |
MnO2 Mn(OH)2 K2MnO4+ |
Манганат-ион
также может выступать окислителем (в
нейтральной и кислой среде):
Схема
2. Поведение манганат-иона в ОВР
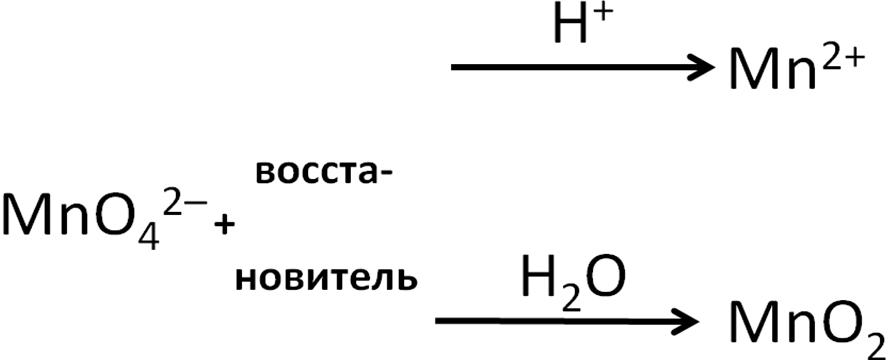
Оксид
марганца (IV)
выступает окислителем в кислой среде
с образованием солей манганца (II):
Cоли
марганца (II),
оксид
марганца (IV)
и манганаты могут выступать восстановителями,
при этом продукт их окисления также
зависит от среды: в нейтральной среде
получится оксид марганца (IV),
в щелочной – манганат, в кислой –
перманганат.
Примеры:
MnCl2
+ O3
+ H2O
= MnO2+
O2+
2HCl
восстановитель
окислитель нейтральная
среда продукт окисления
Mn(OH)2
+ 2Cl2
+ 6KOH =
K2MnO4+
4H2O+
4KCl
восстановитель
окислитель щелочная
среда
продукт окисления
MnO2
+ KNO3
+ 2KOH =
K2MnO4+
H2O+
K NO2
восстановитель
окислитель щелочная
среда
продукт окисления
2MnSO4+
5NaBiO3
+16HNO3
= 2HMnO4
+ 2Na2SO4+
7H2O
+ NaNO3+5Bi
(NO3)3
Восст-ель
окис-ль кислая
среда
продукт окисления
Распространённость в природе
Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). Массовая доля марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. В чиатурском месторождении (район Кутаиси) сосредоточено до 40 % марганцевых руд. Марганец, рассеянный в горных породах, вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10 −7 —10 −6 %), а в глубоких местах океана его концентрация возрастает до 0,3 % вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2·xH2O) и опускается в нижние слои океана, формируя так называемые железомарганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности.
В России является остродефицитным сырьём, известны месторождения: «Усинское» в Кемеровской области, «Полуночное» в Свердловской, «Порожинское» в Красноярском крае, «Южно-Хинганское» в Еврейской автономной области, «Рогачёво-Тайнинская» площадь и «Северо-Тайнинское» поле на Новой Земле.
Минералы марганца
- пиролюзит MnO2·xH2O, самый распространённый минерал (содержит 63,2 % марганца);
- манганит (бурая марганцевая руда) MnO(OH) (62,5 % марганца);
- браунит 3Mn2O3·MnSiO3 (69,5 % марганца);
- гаусманит (Mn II Mn2 III )O4;
- родохрозит (марганцевый шпат, малиновый шпат) MnCO3 (47,8 % марганца);
- псиломелан mMnO·MnO2·nH2O (45-60 % марганца);
- пурпурит Mn 3+ [PO4], (36,65 % марганца).
Химические свойства соединений марганца с точки зрения изменения степеней окисления
В данном разделе реакции выходят за рамки С части ЕГЭ, но могут встретиться в тестовой части экзамена.
Все основные правила составления ОВР для С части, представлены в другом разделе.
Потренироваться составлять реакции онлайн (в рамках ЕГЭ) можно тут.
В кислой среде соединения марганца, как правило, восстанавливаются до Mn+2, образуя соли соответствующих кислот:
Примеры реакций соединений с Mn+7:
2KMnO4 + 16HCl → 2MnCl2 + 5Cl2 + 2KCl + 8H2O
2KMnO4 + 16HBr → 2MnBr2 + 5Br2 + 2KBr + 8H2O
2KMnO4 + 5H2C2O4 + 3H2SO4 → 2MnSO4 + 10CO2 + K2SO4 + 8H2O
2KMnO4 + 5Na2SO3 + 3H2SO4 → 2MnSO4 + 5Na2SO4 + K2SO4 + 3H2O
2KMnO4 + 5SO2 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
2HMnO4 + 5SO2 + 2H2O → 2MnSO4 + 3H2SO4
2KMnO4 + 5Na2O2 + 8H2SO4 → 2MnSO4 + O2 + 5Na2SO4 + K2SO4 + 8H2O
10KMnO4 + 10KHS + 11H2SO4 → 4MnSO4 + 10S + 7K2SO4 + 16H2O
2KMnO4 + 5K2S + 8H2SO4 → 2MnSO4 + 5S + 6K2SO4 + 8H2O
2KMnO4 + 5H2S + 3H2SO4 → 2MnSO4 + 5S + K2SO4 + 8H2O
2KMnO4 + 10KBr + 8H2SO4 → 2MnSO4 + 5Br2 + 6K2SO4 + 8H2O
KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + 5O2 + K2SO4 + 8H2O
8KMnO4 + 5PH3 + 12H2SO4 → 8MnSO4 + 5H3PO4 + 4K2SO4 + 12H2O
6KMnO4 + 10NH3 + 9H2SO4 → 6MnSO4 + 5N2 + 3K2SO4 + 12H2O
Примеры реакций соединений с Mn+4:
MnO2 + HCl → MnCl2 + Cl2 + H2O
MnO2 + 2KI + 2H2SO4 → MnSO4 + I2 + K2SO4 + 2H2O
MnO2 + 2KBr + 2H2SO4 → MnSO4 + Br2 + K2SO4 + 2H2O
MnO2 + 2FeSO4 + 2H2SO4 → MnSO4 + Fe2(SO4)3 + 2H2O
Примеры реакций соединений с Mn+6:
K2MnO4 + 8HBr → MnBr2 + 2Br2 + 2KBr + 4H2O
В щелочной среде, как правило, реакции протекают с образованием соединений Mn+6, т.е. манганат-иона:
Примеры реакций соединений с Mn+7:
2KMnO4 + Na2SO3 + 2KOH → 2K2MnO4 + Na2SO4 + H2O
2KMnO4 + NaNO2 + 2KOH → 2K2MnO4 + NaNO3 + H2O
KMnO4 + FeCl2 + 3KOH → K2MnO4 + Fe(OH)3 + 2KCl
2KMnO4 + 2FeSO4 + 6NaOH → K2MnO4 + 2Fe(OH)3 + Na2MnO4 + 2Na2SO4
6KMnO4 + Cr2(SO4)3 + 16KOH → 6K2MnO4 + 2K2CrO4 + 3K2SO4 + 8H2O
4KMnO4 + 8KOH → 4K2MnO4 + 2O2 + 4H2O
6NaMnO4 + 2NH3 + 6NaOH → 6Na2MnO4 + N2 + 6H2O
8KMnO4 + PH3 + 11KOH → 8K2MnO4 + K3PO4 + 7H2O
Примеры реакций соединений с Mn+2:
3MnSO4 + 2O3 + 12KOH → 3K2MnO4 + 3K2SO4 + 6H2O
MnSO4 + 2Br2 + 8KOH → K2MnO4 + 4KBr + Na2SO4 + 4H2O
3MnSO4 + 3KClO3 + 12KOH → 3K2MnO4 + 2KCl + 3K2SO4 + 6H2O
3MnO + 2KClO3 + 6KOH → 3K2MnO4 + 2KCl + 3H2O
Примеры реакций соединений с Mn+4 в щелочной среде:
3MnO2 + KClO3 + 6KOH → 3K2MnO4 + KCl + 3H2O
MnO2 + KNO3 + K2CO3 → K2MnO4 + KNO2 + CO2
MnO2 + O2 + 4KOH → 2K2MnO4 + 2H2O
В нейтральной среде соединения Mn+7, как правило, восстанавливаются до Mn+4, образуя оксид марганца (IV):
Примеры реакций соединений с Mn+7:
2KMnO4 + 3Na2SO3 + H2O → 2MnO2 + 2Na2SO4 + 2KOH
2KMnO4 + 3KNO2 + H2O → 2MnO2 + 3KNO3 + 2KOH
2KMnO4 + 3K2S + 4H2O → 2MnO2 + 3S + 8KOH
Реакции с H2S и NH3 протекают аналогично нейтральной среде:
2HMnO4 + 3H2S → 2MnO2+ 3S + 4H2O
2NaMnO4 + 2NH3 → 2MnO2 + N2 + 2NaOH + 2H2O
2KMnO4 + 2NH3×H2O → 2MnO2 + N2 + 2KOH + 4H2O
Примеры реакций соединений с Mn+2:
3MnSO4 + 2KMnO4 + 2H2O → 5MnO2 + K2SO4 + 2H2SO4.
Токсичность
Токсическая доза для человека составляет 40 мг марганца в день. Летальная доза для человека не определена.
При пероральном поступлении марганец относится к наименее ядовитым микроэлементам. Главными признаками отравления марганцем у животных являются угнетение роста, понижение аппетита, нарушение метаболизма железа и изменение функции мозга.
Сообщений о случаях отравления марганцем у людей, вызванных приёмом пищи с высоким содержанием марганца, нет. В основном отравление людей наблюдается в случаях хронической ингаляции больших количеств марганца на производстве. Оно проявляется в виде тяжёлых нарушений психики, включая гиперраздражительность, гипермоторику и галлюцинации — «марганцевое безумие». В дальнейшем развиваются изменения в экстрапирамидной системе, подобные болезни Паркинсона.
Чтобы развилась клиническая картина хронического отравления марганцем, обычно требуется несколько лет. Она характеризуется достаточно медленным нарастанием патологических изменений в организме, вызываемых повышенным содержанием марганца в окружающей среде (в частности, распространение эндемического зоба, не связанного с дефицитом йода).
НЕОРГАНИЧЕСКАЯ ХИМИЯ. ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
17. Марганец
Свойства элементов
VII B группы.
|
Свойства |
25 Mn |
43 Tc |
75 Re |
|
Атомная масса |
54,938 |
99 |
186,21 |
|
Электронная конфигурация* |
|||
|
0,126 |
0,136 |
0,137 |
|
|
0,743 |
0,728 |
0,787 |
|
|
Энергия ионизации |
7,43 |
7,28 |
7,87 |
|
Относительная электроотрицательность |
1,6 |
— |
1,46 |
|
Возможные степени окисления |
+2, +4, +6, +7 |
+4, +5, +7 |
+2, |
|
кларк, ат.% (распространненость в природе) |
0,03 |
— |
9×10-9 |
|
Агрегатное состояние (н. у.) |
Т В Е Р Д Ы Е В Е Щ Е С Т В А |
||
|
Цвет |
Серебристый |
серебристо-коричневый |
серебристо-белый |
|
1245 |
2200 |
3180 |
|
|
2120 |
4600 |
5625 |
|
|
Плотность |
7,4 |
14,49 |
21,04 |
*Приведены конфигурации внешних электронных уровней атомов соответствующих элементов. Конфигурации остальных электронных уровней совпадают с таковыми для благородных газов, завершающих предыдущий период и указанных в скобках.
Марганец.
Металлический марганец реагирует с кислотами, образуя соли марганца
В различных соединениях марганец проявляет степени окисления 2+, 4+, 6+ и 7+. Чем выше степень окисления, тем более ковалентный характер имеют соответствующие соединения. С возрастанием степени окисления марганца увеличивается также кислотность его оксидов.
При нагревании марганец взаимодействует с кислородом, галогенами, углеродом, бором, кремнием, серой. При взаимодействии марганца с кислородом образуются смешанные оксиды:
Диспергированный марганец при нагревании реагирует с водой:
Одной из особенностей марганца является способность поглощать кислород.
Марганец пассивируется в обычных условиях концентрированными кислотами окислителями, хотя при нагревании реакция идет:
![]()
При взаимодействии с разбавленными кислотами выделяется водород:
На самом деле в растворе существует аквакомплекс
[Mn(H2O)6]Cl2.
Марганец взаимодействует со щелочами в присутствие окислителя:
![]()
Оксид марганца (
II).
Оксид марганца (II) можно получить восстановление оксида марганца (IV):
Этот оксид обладает основными свойствами. Так, он не реагирует с водой, а при взаимодействии с кислотами образуются соли марганца (
II):
Гидроксид марганца (
II).
При взаимодействии солей марганца (II) со щелочами выпадает белый, нерастворимый осадок Mn(OH)2:
![]()
При взаимодействии с ки
cлотами от дает соли марганца (II):
![]()
При стоянии на воздухе гидроксид марганца (
II) переходит в оксогидроксид, который далее окисляется до оксида марганца (IV):
![]()
Аналогичная реакция протекает с сульфидом марганца MnS, но с выпадением осадка серы.
Соли марганца (II). Марганец (II) при взаимодействии с сильными окислителями переходит в различные степени окисления в зависимости от реакции среды:
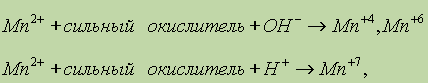
что можно проиллюстрировать следующими примерами:
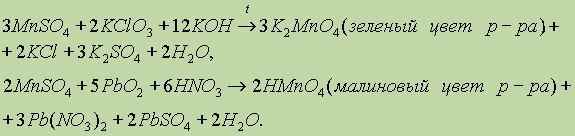
К трудно растворимым солям марганца (II) относятся фторид, карбонат и фосфат.
Оксид марганца (
IV). Наиболее важным соединением марганца(IV) является его оксид MnO2. Это соединение коричнево-черного цвета не растворяется в воде. Оксид марганца (IV) — сильный окислитель, который, например, окисляет концентрированную соляную кислоту до хлора:
![]()
Эта реакция часто используется для получения хлора в лаборатории.
Этот оксид обладает амфотерными свойствами, равно как и оксогидроксид
MnO(OH)2и гидроксид Mn(OH)4марганца (IV):
![]()
Манганат калия.
манганатK2MnО4 устойчив в щелочной среде. Он образуется при восстановлении перманганата калия в щелочной среде, например:
![]()
Вообще для
Mn6+ характерны следующие продукты окислительно-восстановительных реакций:
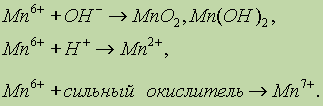
Например:
![]()
Перманганат калия.
n2О7 и перманганате калия КмnO4. Последнее вещество — кристаллы фиолетового цвета, хорошо растворимые в воде.
Перманганат калия — сильнейший окислитель.
В кислойn2+:
в щелочной
среде — до К2МnO4 (см. выше), а в нейтральнойсреде — до MnO2:
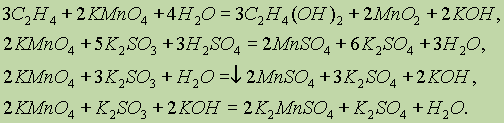
|
Вы находитесь на сайте Xenoid v2.0: |
Copyright 2005-2013 Xenoid v2.0
Использование материалов сайта возможно при условии указания активной ссылкиХимия: решение задач
Применение в промышленности
Применение в металлургии
Марганец в виде ферромарганца применяется для раскисления стали при её плавке, то есть для удаления из неё кислорода. Кроме того, он связывает серу, что также улучшает свойства сталей. Введение до 12—13 % Mn в сталь (так называемая сталь Гадфильда), иногда в сочетании с другими легирующими металлами, сильно упрочняет сталь, делает её твёрдой и сопротивляющейся износу и ударам (т. н. «наклёп»). Такая сталь используется для изготовления шаровых мельниц, землеройных и камнедробильных машин, броневых элементов и т. д. В «зеркальный чугун» вводится до 20 % Mn.
В 1920—1940-х годах применение марганца позволяло выплавлять броневую сталь. В начале 1950-х годов в журнале «Сталь» возникла дискуссия по вопросу о возможности снижения содержания марганца в чугуне, и тем самым отказа от поддержки определённого содержания марганца в процессе мартеновской плавки, в которой вместе с В. И. Явойским и В. И. Баптизманским принял участие Е. И. Зарвин, который на основе производственных экспериментов показал нецелесообразность существовавшей технологии. Позже он показал возможность ведения мартеновского процесса на маломарганцовистом чугуне. С пуском ЗСМК началась разработка передела низкомарганцовистых чугунов в конвертерах.
Сплав 83 % Cu, 13 % Mn и 4 % Ni (манганин) обладает высоким электросопротивлением, мало изменяющимся с изменением температуры. Поэтому его применяют для изготовления реостатов и пр.
Марганец вводят в бронзы и латуни.
Применение в химии
Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов, MnO2 используется в таких элементах в качестве окислителя-деполяризатора.
Соединения марганца также широко используются как в тонком органическом синтезе (MnO2 и KMnO4 в качестве окислителей), так и промышленном органическом синтезе (компоненты катализаторов окисления углеводородов, например, в производстве терефталевой кислоты окислением p-ксилола, окисление парафинов в высшие жирные кислоты).
Арсенид марганца обладает гигантским магнитокалорическим эффектом, усиливающимся под давлением.
Теллурид марганца — перспективный термоэлектрический материал (термо-ЭДС 500 мкВ/К).
Практическая часть
2.1 Исследование свойств марганца и его соединений
Марганец
Важнейшими соединениями марганца являются пиролюзит МnО2 и перманганат калия КМnO4. Чтобы обнаружить этот металл в сплавах, необходимо провести сложное химическое разделение. Однако следующие реакции часто применяют для доказательства наличия марганца. Для опытов лучше всего использовать загрязненный марганец, или пиролюзит из старой батарейки для карманного фонарика.
Растворим кусочек исследуемого марганца в разбавленной соляной кислоте, выпарим раствор на открытом воздухе или под тягой и сначала проверим остаток с помощью перла буры. При внесении в окислительную зону пламени бунзеновской горелки перл окрасится в фиолетовый цвет, который перейдет при охлаждении в красно-фиолетовый. Если перл станет черным, значит мы взяли слишком много марганца. Окраска полностью исчезнет, если еще раз нагреть перл, но уже в зеленом восстановительном конусе пламени бунзеновской горелки.
Благодаря своему окислительному действию пиролюзит применяется в производстве стекла для осветления мутных стекольных расплавов.
Специфическую реакцию марганца мы получим при сплавлении остатка выпаренного раствора с щелочью и селитрой
(Осторожно! Держаться на надлежащем расстоянии!) При этом образуется манганат калия К2МnO4, который придаст расплаву зеленый цвет. На присутствие марганца укажет также красный цвет, который появляется при нагревании остатка с калийной селитрой и фосфорной кислотой
(Осторожно! Опасность ожога и разбрызгивания!).
MnO2 + KNO3 + 2KOH К2МnO4 + KNO2 + H2O
2.2. Получение марганца
Смешаем 6 г. оксида марганца (пиролюзита) МnО2 и 2 г алюминиевых опилок или очень тонкой стружки. Смесь положим на большой фарфоровый или глиняный черепок, помещенный на огнеупорной подставке. Для воспламенения насыплем на смесь небольшое количество (!) магниевого порошка и воткнем кусок магниевой ленты, которую осторожно подожжем. Чтобы можно было держаться на надлежащем расстоянии, укрепим бунзеновскую горелку на палке длиной около 1 м. Смесь также можно поджечь непосредственно бунзеновской горелкой, если направить на нее несветящееся пламя. Реакция протекает с яркой вспышкой. После охлаждения мы обнаружим темный комочек сплавленного марганца (содержание марганца 95-98%). Металл очень хрупок, его можно раздробить в порошок молотком — только делать это надо на стальной подставке. Свежие сколы на металле серебристо-белые, но на воздухе они быстро темнеют.
Алюминий превращается в оксид алюминия по следующему уравнению:
ЗМnО2 + 4Аl 2Al2О3 + ЗМn
При проведении опыта следует надеть защитные очки, так как в ходе реакции могут вылетать очень горячие искры. Вблизи не должно быть никаких легковоспламеняющихся предметов и веществ.
Если вас постигла неудача (воспламенения не произошло) ни в коем случае нельзя пытаться сразу близко рассматривать смесь. Подождите по меньшей мере 5 минут, так как нередко может последовать неожиданное «позднее зажигание».
Заключение
Таким образом, марганец и его соединения являются практически значимыми веществами. Они широко используются в химической промышленности, в сталеварении, в аналитической химии и медицине. Соединения марганца играют важнейшую биологическую роль в живых организмах. Эта тема мне стала очень интересна. Работу я буду продолжать в старших классах. Я буду заниматься перманганометрией для исследования состава водопроводной воды. Также я ставлю перед собой цель – более глубокое изучение соединений марганца с высокими степенями окисления.
Список использованной литературы:
- Ахметов Н. С. Общая и неорганическая химия: учебник для вузов. – М.: Высшая школа, 1981 – 679 с., ил.
- Карапетьянц М.Х., Дракин С.И., Общая и неорганическая химия. — М.: Химия, 1993
- Методическое пособие для поступающих, Ярославская государственная медицинская академия.
- Некрасов Б.В., Учебник общей химии. — М.: Химия, 1981
- Химия для любознательных: Основы химии и занимательные опыты/Пер. с нем. Л. Н. Исаевой (гл. 1-3) и А. Б. Томчина (гл. 4-8). – 3-е изд., — Л.: Химия, 1987.
- Химия элементов. Соврем. курс/А. И. Врублевский, Е. В. Барковский. – Мн.: ООО “Юнипресс”, 2002.
История открытия
Один из основных минералов марганца — пиролюзит — был известен в древности как чёрная магнезия и использовался при варке стекла для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом чёрной магнезии, к которому магнит «равнодушен». В 1774 году шведский химик К. Шееле показал, что в руде содержится неизвестный металл. Он послал образцы руды своему другу химику Ю. Гану, который, нагревая в печке пиролюзит с углем, получил металлический марганец. В начале XIX века для него было принято название «манганум» (от нем. Manganerz — марганцевая руда).
Изотопы
Марганец является моноизотопным элементом — в природе существует только один устойчивый изотоп 55 Mn. Все другие изотопы марганца нестабильны и радиоактивны, они получены искусственно. Известны 25 радиоактивных изотопов марганца, имеющие массовое число А в диапазоне от 44 до 70. Наиболее стабильными из них являются 53 Mn (период полураспада T1/2 = 3,7 млн лет ), 54 Mn ( T1/2 = 312,3 суток ) и 52 Mn ( T1/2 = 5,591 суток ). Преобладающим каналом распада лёгких изотопов марганца ( А ) является электронный захват (и иногда конкурирующий с ним позитронный распад) в соответствующие изотопы хрома. У тяжёлых изотопов ( А > 55 ) основным каналом распада является β − -распад в соответствующие изотопы железа. Известны также 7 изомеров (метастабильных возбуждённых состояний) с периодами полураспада более 100 нс .
Определение методами химического анализа
Марганец принадлежит к пятой аналитической группе катионов.
Специфические реакции, используемые в аналитической химии для обнаружения катионов Mn 2+ , следующие:
1. Едкие щёлочи с солями марганца (II) дают белый осадок гидроксида марганца (II):
Осадок на воздухе меняет цвет на бурый из-за окисления кислородом воздуха.
Выполнение реакции. К двум каплям раствора соли марганца добавляют две капли раствора щёлочи. Наблюдают изменение цвета осадка.
2. Пероксид водорода в присутствии щёлочи окисляет соли марганца (II) до тёмно-бурого соединения марганца (IV):
Выполнение реакции. К двум каплям раствора соли марганца добавляют четыре капли раствора щёлочи и две капли раствора H2O2.
3. Диоксид свинца PbO2 в присутствии концентрированной азотной кислоты при нагревании окисляет Mn 2+ до MnO4 − с образованием марганцевой кислоты малинового цвета:
Эта реакция даёт отрицательный результат в присутствии восстановителей, например хлороводородной кислоты и её солей, так как они взаимодействуют с диоксидом свинца, а также с образовавшейся марганцевой кислотой. При больших количествах марганца провести эту реакцию не удаётся, так как избыток ионов Mn 2+ восстанавливает образующуюся марганцевую кислоту HMnO4 до MnO(OH)2, и вместо малиновой окраски появляется бурый осадок. Вместо диоксида свинца для окисления Mn 2+ в MnO4 − могут быть использованы другие окислители, например, персульфат аммония (NH4)2S2O8 в присутствии катализатора — ионов Ag + или висмутат натрия NaBiO3:
Выполнение реакции. В пробирку вносят стеклянным шпателем немного PbO2, а затем 5 капель концентрированной азотной кислоты HNO3 и нагревают смесь на кипящей водяной бане. В нагретую смесь добавляют 1 каплю раствора сульфата марганца II MnSO4 и снова нагревают 10—15 мин, встряхивая время от времени содержимое пробирки. Дают избытку диоксида свинца осесть и наблюдают малиновую окраску образовавшейся марганцевой кислоты.
При окислении висмутатом натрия реакцию проводят следующим образом. В пробирку помещают 1—2 капли раствора сульфата марганца (II) и 4 капли 6 н. HNO3, добавляют несколько крупинок висмутата натрия и встряхивают. Наблюдают появление малиновой окраски раствора.
4. Сульфид аммония (NH4)2S осаждает из раствора солей марганца сульфид марганца II, окрашенный в телесный цвет:
Осадок легко растворяется в разбавленных минеральных кислотах и даже в уксусной кислоте.
Выполнение реакции. В пробирку помещают 2 капли раствора соли марганца (II) и добавляют 2 капли раствора сульфида аммония.






























