Что такое термодинамика
Слово термодинамика с греческого переводится как «тепло» и «сила».
В термодинамике изучают состояния и процессы, для описания которых необходимо ввести понятие температуры.
Процессы, происходящие в термодинамической системе, описываются макроскопическими параметрами, которые вводятся для описания систем, состоящих из большого числа частиц, и не применимы к отдельным молекулам и атомам, в отличие от величин, вводимых в механике или электродинамике. Пример макроскопических величин — это температура, давление, объем, концентрация компонентов системы, которые могут изменяться в ходе процесса.
Термодинамика изучает:
- переходы энергии из одной формы в другую, от одной части системы к другой;
- энергетические эффекты, которые сопровождают различные процессы, их зависимость от условий протекания процессов;
- возможность, направление и пределы протекания самопроизвольного течения самих процессов.
Не только физика, но химия живет по правилам термодинамики.
Как в физике, так и в химии в основе термодинамики лежат три закона или «три начала термодинамики».
Первый закон термодинамики, формулы
С помощью первого начала термодинамики конкретизируют общую физическую закономерность, описывающую явление сохранения энергии в случае термодинамических систем. Согласно традиционному подходу, первое начало представляет собой отношение, формулирующее взаимосвязь внутренней энергии, работы и теплоты.
Согласно пониманию У. Томсона первое начало термодинамики представляют в виде дефиниции внутренней энергии для закрытых систем. Таким образом, внутренняя энергия U в некотором процессе изменяется на величину, вычисляемую путем суммирования количества тепловой энергии Q, участвующей в обмене между системой и внешней средой, и работы A , которую совершает непосредственно рассматриваемая система, либо произведенной над этой системой: \(\Delta U\equiv Q+A\).
Проанализировав математическое соотношение, можно заметить, что в данном случае допустимо использовать термодинамический принцип знаков для теплоты и работы. Применительно к этим величинам, в термодинамике оперируют определениями из смежных физических направлений. С другой стороны, понятие количества чистоты используют лишь в термодинамике.
Исходя из вышесказанного, целесообразно определять первое начало термодинамики по Клаузиусу. Тогда теплоту рассчитывают по известным величинам внутренней энергии и работы. В таком случае формула примет следующий вид:
\(Q\equiv \Delta U+A \)
Если воспользоваться принципом знаков для теплоты и работы, то следует поменять знак у работы А на противоположный. Тогда соотношение будет записано таким образом:
\(Q\equiv \Delta U-A.\)
Применение первого начала термодинамики к изопроцессам. Уравнение Майера
Рассмотрим применение первого закона термодинамики к изопроцессам, происходящим с идеальным газом. В изотермическом процессе температура постоянная, следовательно, внутренняя энергия не меняется. Тогда уравнение первого закона термодинамики примет вид: , т. е. количество теплоты, переданное системе, идет на совершение работы при изотермическом расширении, именно поэтому температура не изменяется.
В изобарном процессе газ расширяется и количество теплоты, переданное газу, идет на увеличение его внутренней энергии и на совершение им работы: .
При изохорном процессе газ не меняет своего объема, следовательно, работа им не совершается, т. е. А = 0, и уравнение первого закона имеет вид , т. е. переданное количество теплоты идет на увеличение внутренней энергии газа.
Уравнение Майера
Оно показывает, что расширение моля идеального газа при постоянном давлении и изменении его температуры на 1 Кельвин требует дополнительного, по сравнению с изобарическим расширением, количества теплоты, необходимого для совершения работы. Это значение равно универсальной газовой постоянной. ![]()
Уравнение Пуассона
(Показатель адиабаты или коэффициент Пуассона)
21. Обратимые и необратимые термодинамические процессы. Второе начало термодинамики. Принцип работы тепловых машин. К.П.Д. обратимых и необратимых тепловых машин.
Обратимый процесс (то есть равновесный) — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений.
Обратимый процесс можно в любой момент заставить протекать в обратном направлении, изменив какую-либо независимую переменную на бесконечно малую величину.
Обратимые процессы дают наибольшую работу. Бо́льшую работу от системы вообще получить невозможно
Это придает обратимым процессам теоретическую важность. На практике обратимый процесс реализовать невозможно
Он протекает бесконечно медленно, и можно только приблизиться к нему.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы. Примеры необратимых процессов: диффузия, термодиффузия, теплопроводность, вязкое течение и др. Переход кинетической энергии макроскопического движения через трение в теплоту, то есть во внутреннюю энергию системы, является необратимым процессом.
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю.
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Принцип работы тепловых машин:В современной технике механическую энергию получают главным образом за счет внутренней энергии топлива. Устройства, в которых происходит преобразование внутренней энергии в механическую, называют тепловыми двигателями.
Для совершения работы за счет сжигания топлива в устройстве, называемом нагревателем, можно воспользоваться цилиндром, в котором нагревается и расширяется газ и перемещает поршень.Газ, расширение которого вызывает перемещение поршня, называют рабочим телом. Расширяется же газ потому, что его давление выше внешнего давления. Но при расширении газа его давление падает, и рано или поздно оно станет равным внешнему давлению. Тогда расширение газа закончится, и он перестанет совершать работу. Для того чтобы двигатель работал непрерывно, необходимо, чтобы поршень после расширения газа возвращался каждый раз в исходное положение, сжимая газ до первоначального состояния. Сжатие же газа может происходить только под действием внешней силы, которая при этом совершает работу (сила давления газа в этом случае совершает отрицательную работу). После этого вновь могут происходить процессы расширения и сжатия газа. Значит, работа теплового двигателя должна состоять из периодически повторяющихся процессов (циклов) расширения и сжатия.
Изменение величины внутренней энергии с помощью работы
Итак, в соответствии с первым законом термодинамики внутренняя энергия вещества, из которого состоит данное тело, изменится если над ним будет совершена работа внешними силами, либо само тело совершит работу. Приведем ряд примеров:
- Когда мы забиваем гвоздь молотком в доску, или отрезаем ножовкой по металлу кусок трубы, то легко обнаружить, что происходит повышение температуры (разогрев) всех “участников” произведенных действий: гвоздя, молотка, ножовки и трубы. В обоих случаях была произведена работа по преодолению силы трения;
- Если взять металлическую проволоку, и произвести некоторое количество сгибаний и разгибаний, то также нетрудно будет заметить, что температура металла за счет этих деформаций увеличилась;
- Так как величина внутренней энергии пропорциональна температуре тела, то, следовательно, произошло ее увеличение за счет произведенной нами работы. Приведенные примеры описываются формулой (1);
-
Работа, которую совершает нагретый пар в тепловом двигателе, вращая турбину, уменьшает его внутреннюю энергию. Для этого примера справедлива формула (2).
Изменение величины внутренней энергии с помощью передачи тепла
Количество теплоты Q, полученное телом извне или, наоборот, переданное от себя другому телу — второй механизм, приводящий к изменению внутренней энергии ΔU. Передача энергии от одного тела к другому без совершения работы называется теплообменом или теплопередачей. Теплообмен возможен только между телами, имеющими разную температуру, в результате чего происходит передача части внутренней энергии от тела с более высокой температурой к телу, имеющему низкую температуру.
Существует три основных механизма теплопередачи: теплопроводность, конвекция и излучение:
- Механизм теплопроводности связан с передачей тепла от более нагретого тела к менее нагретому. Например, когда кастрюля с холодной водой ставится на разогретую газовую или электроплиту, то нагрев происходит за счет этого механизма, суть которого заключается в передаче энергии “горячих” молекул газового пламени или молекул раскаленной электрической спирали;
- Конвекция представляет собой перенос внутренней энергии в газах и жидкостях в результате циркуляции потоков вещества и последующего перемешивания. Простым примером для понимания характера этого механизма служит работа кондиционера в помещении, когда поток охлажденного им воздуха начинает перемешиваться с более теплым, что приводит к общему понижению температуры в квартире или офисе;
- Передача тепла с помощью излучения происходит в виде электромагнитных волн. Этот механизм может проистекать даже в вакууме. Часть внутренней энергии преобразуется в электромагнитную энергию, которая распространяется в пространстве и после попадания на другое тело, поглощается им. Таким образом происходит изменение внутренней энергии обоих тел. Чем больше температура тела, тем больше энергии передается с помощью излучения.
Рис. 1. Излучение – один из механизмов теплопередачи.
Термодинамическая система и определение энергии
 Рисунок 1. Внутренняя энергия термодинамической системы. Автор24 — интернет-биржа студенческих работ
Рисунок 1. Внутренняя энергия термодинамической системы. Автор24 — интернет-биржа студенческих работ
Определение 1
Термодинамическая система представляет собой систему, в которой производится процесс материального обмена между составляющими ее частями (речь идет о массообмене и теплообмене).
Различают (в зависимости от степени изолированности) следующие разновидности систем:
- изолированные (представляют системы, которые не взаимодействуют с внешней средой);
- закрытые (не производят обмен с внешней средой веществом (атомами, ионами, молекулами и пр.), но при этом взаимодействуют с ней, благодаря процессу механической работы, излучения и теплового обмена);
- открытые (данный вид систем обменивается с внешней средой механической работой, веществом, излучением и теплотой).
Энергия (в переводе с греческого, — действие) представляет собой общую количественную меру движения и взаимодействия всех разновидностей материи. Энергия не может возникать из ничего и исчезать.
В изолированной системе энергия способна к переходу из одной формы в другую, однако в количественном отношении она сохраняет свое постоянство.
При не изолированности системы ее энергия способна к изменениям, однако, при параллельном изменении энергии внешней среды на аналогичную величину (или посредством энергии взаимодействия с внешней средой).
В процессе перехода системы из одного состояния в другое степень изменения энергии не будет зависеть от того, каким именно способом (вследствие каких превращений) был произведен данный переход. Энергия, иными словами, является не функцией процесса, а функцией состояния.
Энергия представляет неотъемлемое свойство системы в том плане, что абсолютно любая система будет обладать определенными запасами энергии.
Внутренняя энергия системы
 Рисунок 2. Изменение внутренней энергии. Автор24 — интернет-биржа студенческих работ
Рисунок 2. Изменение внутренней энергии. Автор24 — интернет-биржа студенческих работ
В природе выделяют три вида энергии:
- движения (кинетическая);
- положения и взаимодействия (потенциальная);
- состояния (внутренняя энергия).
Определение 2
Внутренняя энергия системы считается в физике суммой потенциальной энергии взаимодействия каждой ее частицы в совокупности между собой, а также кинетической энергии их движения.
Внутренняя энергия включает такие составляющие:
- энергию поступательного, колебательного, вращательного движений молекул;
- энергии внутриатомного, межмолекулярного, внутримолекулярного, внутриядерного взаимодействия;
- энергии излучения и гравитации и т.д.
Внутренняя энергия представляет собой суммарный энергетический запас системы за вычетом кинетической и потенциальной энергий ее пространственного положения
Абсолютная величина у внутренней энергии остается неизвестной, однако важно знать изменение внутренней энергии в процессе перехода системы из одного состояния в другое
Внутренняя энергия остается независимой от пути процесса, последовав которому система пришла в подобное состояние, и однозначно определяется исключительно самим состоянием. Поскольку внутренняя энергия зависима от массы, она представляет собой экстенсивную величину (объем, количество и масса вещества). В то же время, интенсивными величинами будут считаться: давление, температура и все удельные характеристики.
Изменение внутренней энергии с помощью химических реакций
Внутренняя энергия системы, представляющая собой смесь разных веществ, может изменяться в результате химических реакций, в которые эти вещества вступают между собой. При этом в результате тепло Q может либо выделяться (экзотермическая реакция), либо поглощаться (эндотермическая реакция). В первом случае внутренняя энергия уменьшается, а во втором — увеличивается.
Примером реакции с выделением тепла Q может служить реакция горения метана в кислороде:
$ СH_4 + 2O_2 = CO_2 + 2*H_2O + Q $ (3).
Пример реакции с поглощением тепла — разложение карбоната кальция СaCO3 на углекислый газ CO2 и оксид кальция (негашеная известь) CaO:
$ СaCO_3 = CaO + CO_2 – Q $ (4).
Все перечисленные способы изменения внутренней энергии можно представить в виде следующей таблицы:.
 Рис. 2. Таблица изменений внутренней энергии физических тел.
Рис. 2. Таблица изменений внутренней энергии физических тел.
Физики научились регистрировать и измерять тепловое излучение, что позволило создать удивительные приборы, которые называются тепловизорами. Этими устройствами можно бесконтактно (на расстоянии) измерять температуру на поверхности различных тел, в том числе на теле человека. Тепловизоры применяются в медицине, в военной технике, в промышленности.
 Рис. 3. Тепловизор — прибор, использующий тепловое излучение.
Рис. 3. Тепловизор — прибор, использующий тепловое излучение.
Что мы узнали?
Итак, мы узнали, что внутреннюю энергию тела можно изменить либо с помощью совершения работы А, либо с помощью передачи количества теплоты Q. Существует три основных механизма теплопередачи: теплопроводность, конвекция и излучение. Внутренняя энергия может также изменяться в результате химических реакций.
-
/10
Вопрос 1 из 10
Изопроцессы в термодинамике
Простейшими процессами перехода термодинамической системы из одного состояния в другое являются:
Изобарный процесс p=const
Q=ΔU+A’
Изохорный процесс V=const
Q=ΔU
Газ не меняет своего объема, работа им не совершается. Т.о переданное количество теплоты идет на увеличение внутренней энергии газа.
Изотермический процесс T=const
Q=A’
Внутренняя энергия не меняется. Следовательно количество теплоты, переданное системе идет на совершение работы
Адиабатный процесс Q=0
A=ΔU
Процесс происходящий в системе без теплообмена с окружающей средой. При совершении работы над газом внутренняя энергия системы увеличивается, следовательно увеличивается и температура газа.
Опорный конспект:
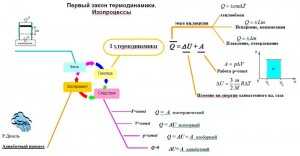
Основные изопроцессы
Поскольку тепловые двигатели могут пройти сложную последовательность шагов, упрощённая модель часто используется для иллюстрации принципов термодинамики. В частности, можно рассмотреть газ, который расширяется и сжимается в цилиндре с подвижным поршнем при заданном наборе условий. Применение первого закона термодинамики к изопроцессам содержит два таких набора:
- Одно условие, известное как изотермическое расширение, включает в себя поддержание постоянной температуры газа. Поскольку он работает против сдерживающей силы поршня, то должен поглощать тепло для сохранения энергии. В противном случае он будет охлаждаться при расширении или, наоборот, нагреваться при сжатии. Это пример, в котором поглощённое тепло полностью превращается в работу со стопроцентной эффективностью. Однако этот процесс не нарушает фундаментальных ограничений по эффективности, поскольку само по себе расширение не является циклическим процессом.
- Второе условие, известное как адиабатическое расширение (от греческого «адиабатос», что означает «непроходимый»), — это состояние, при котором предполагается, что цилиндр идеально изолирован, так что тепло не может течь внутрь него или наружу. При применении первого начала термодинамики для адиабатического процесса газ охлаждается при расширении, потому что работа, выполняемая против сдерживающей силы на поршне, может исходить только от внутренней энергии газа. Таким образом, изменение этого показателя должно быть ΔU = -W, о чём свидетельствует снижение его температуры. Газ остывает, хотя теплового потока нет, потому что он работает за счёт собственной внутренней энергии. Точное количество охлаждения можно рассчитать по теплопроводности газа.
Многие природные явления адиабатны, потому что времени для значительного теплового потока недостаточно. Например, когда тёплый воздух поднимается в атмосферу, он расширяется и охлаждается по мере того, как давление падает при наборе высоты. Но он является хорошим теплоизолятором, поэтому нет значительного теплового потока от него. В этом случае окружающий воздух играет роль стенок изолированного цилиндра и подвижного поршня.
Тепло, подаваемое при постоянном давлении, также известно как изобарный процесс. При нем не происходит изменения давления во время подачи тепла в систему.
Первое начало термодинамики рассматривается многими как основа концепции сохранения энергии. В основном это говорит о том, что энергия, которая поступает в систему, не может быть потеряна по пути, но должна быть использована для того, чтобы изменить внутреннюю энергию, либо выполнить работу. С этой точки зрения он является одним из самых обширных научных понятий, когда-либо обнаруженных.
Энергия и ее сохранение
Энергия – это общая физическая мера взаимодействий и движений в Природе. Понятие энергии было использовано еще Аристотелем для обозначения механической работы. Позже оно было математически формализовано Г. Лейбницем (он, фактически описал кинетическую энергию), а впервые использовано в современном смысле Т. Юнгом.
Одно из важнейших свойств энергии – ее сохранение в замкнутой системе. Энергия не может возникать и исчезать. Все процессы в Природе лишь перераспределяют энергию между различными телами и видами.
Однако, доказать это свойство удалось далеко не сразу. Если рассмотреть примеры различных механических процессов с потерей энергии в результате трения, то все выглядит так, как будто механическая энергия исчезает. То, что при трении происходит нагрев, было известно давно, однако, то, что тепло является энергией, которая при трении перешла из кинетической во внутреннюю, впервые отмечено лишь в конце XVIIв Г. Лейбницем.
Современный вид закон сохранения энергии принял в работах Р. Майера.
Рис. 1. Р. Майер.
Позже он был расширен Дж. Джоулем, а окончательную строгую формулировку получил в трудах Г. Гельмгольца.
Полное теоретическое обоснование закона было получено лишь в 1918 г Э. Нёттер. Было доказано, что закон сохранения энергии – это следствие симметрии времени (равноправности всех моментов времени в замкнутой инерциальной системе).
Вечный Двигатель и Первый Закон термодинамики
Устройство, совершающее работу без затрат энергии, называется Вечным Двигателем первого рода. Применение такого устройства сулит пользователю огромную выгоду. Многие изобретатели прошлого пытались построить такую машину, но всегда терпели неудачу.
 Рис. 3. Примеры Вечного Двигателя первого рода.
Рис. 3. Примеры Вечного Двигателя первого рода.
Причина кроется в нарушении таким Вечным Двигателем Первого Закона термодинамики.
Если система не получает тепло, то полезная работа (то есть, работа, которую совершает система над внешними объектами) может быть совершена только за счет уменьшения внутренней энергии:
$$А_{полезн}=-ΔU$$
А значит, рано или поздно запасы внутренней энергии будут израсходованы, и двигатель не сможет совершать полезную работу. Смысл же Вечного Двигателя в постоянном совершении работы.
Что мы узнали?
Первый Закон термодинамики гласит, что изменение внутренней энергии системы равно сумме работы внешних сил и количества теплоты, переданной системе. Этот закон является следствием закона сохранения энергии, который, в свою очередь, является следствием симметрии времени. Первый Закон термодинамики обосновывает невозможность существования Вечного Двигателя первого рода.
-
/10
Вопрос 1 из 10
Свойства
При рассмотрении свойств внутренней энергии целесообразно принять это понятие за компонент полной энергии. Исходя из этого, перечислим следующие свойства внутренней энергии:
Внутренняя энергия представляет собой индифферентный скаляр
Важно заметить, что к ней не относят кинетическую энергию, которой обладают система в виде единого целого и внутренняя среда системы. К таковым причисляют энергию смещения простейших областей в процессе деформирования твердых объектов, энергию потоков жидких и газообразных сред.
Внутренняя энергия является аддитивной величиной
Смысл этого утверждения состоит в равенстве внутренней энергии системы суммарным величинам внутренних энергий, характерных для подсистем.
Внутреннюю энергию определяют с точностью до неизменяемого слагаемого, которое зависит от заданного отчетного нуля и не влияет на величину изменения внутренней энергии, полученной путем измерений в процессе экспериментов.
Пример 1
Предположим, что имеется некий закупоренный сосуд с небольшим количеством воды на дне. Если в него закачивать воздух, то, спустя определенное время, крышка будет выдавлена давлением. При этом в сосуде формируется туман. Если проанализировать описанное явление, то можно прийти к выводу о том, что воздух внутри резервуара обладал некоторой силой. Когда пробка вылетела, воздухом совершалась работа. С другой стороны, такая возможность характерна лишь для объектов, имеющих энергетический запас. Исходя из вышесказанного, можно заключить, что воздух в сосуде обладал определенной энергии.
Основные законы термодинамики
Существует три основных закона термодинамики:
- Первый закон — закон сохранения энергии: в любых процессах энергия не создается и не исчезает, а переходит из одной формы в другую или от одного тела к другому, при этом ее значение сохраняется. Формулы: ΔU=Q+A (когда работу совершают над телом), ΔU=Q-A (когда работу совершает тело), где ΔU — изменение внутренней энергии (Дж); Q — количество теплоты (Дж); A — работа (Дж).
- Второй закон: любое действие, связанное с преобразованием энергии, не может происходить без ее потери в виде рассеянного в пространстве тепла — полный переход одного вида энергии в другой невозможен. Формула: ΔS=Q/T, где ΔS — изменение энтропии (Дж/моль*К); Q — количество теплоты (Дж); T — температура (К).
- Третий закон: при стремлении температуры к абсолютному нулю, энтропия (мера необратимого рассеивания энергии или бесполезности энергии) системы приближается к постоянному минимуму. Формула: S=0, где S — энтропия.
Способы изменения внутренней энергии
Внутренняя энергия тела меняется при изменении температуры, массы или агрегатного состояния. Но также существует еще два важных метода изменения внутренней энергии:
- Совершение работы. Внутренняя энергия тела увеличивается, когда работу совершают над телом. Внутренняя энергия уменьшается, когда работу совершает само тело. Работа является мерой изменения внутренней энергии при превращении механической энергии во внутреннюю или внутренней энергии в механическую.
- Теплообмен — процесс изменения внутренней энергии без совершения работы. Если в результате теплообмена тело остывает, то его внутренняя энергия уменьшается. Если нагревается, то энергия увеличивается. Теплообмен продолжается до тех пор, пока не установится тепловое равновесие.
Теплообмен в свою очередь делится еще на три вида:
- Теплопроводность — это процесс передачи энергии от одного тела к другому или от одной части тела к другой благодаря тепловому движению частиц. При теплопроводности не происходит перемещения вещества: от одного тела к другому, или от одной части тела к другой передается энергия. Разные вещества обладают разной теплопроводностью.
- Конвекция — это вид теплопередачи, при котором энергия передается слоями жидкости или газа. Конвекция связана с переносом вещества, поэтому она может осуществляться только в жидкостях и газах.
- Излучение — это перенос энергии путем испускания электромагнитных волн. Может происходить в вакууме.
Наглядная схема:
Первый закон термодинамики
Внутренняя энергия термодинамической системы может меняться за счет той работы, которую будут совершать над ней внешние тела, или же сама система осуществит над внешними телами. К примеру, приложив внешнюю силу, мы можем сжать газ, что приведет в результате к повышению его температуры, и, следовательно, — к росту внутренней энергии. Также внутреннюю энергию возможно изменить за счет передачи системе (или отнимая у нее) некоторого количества теплоты.
Замечание 1
Если основываться на закон сохранения энергии, то можно прийти к выводу, что изменение внутренней энергии системы приравнивается к сумме полученной ею теплоты и работы, совершенной над ней. Такая формулировка закона по сохранению энергии, применительно к термодинамическим системам, получила название «первый закон термодинамики».
Ученые акцентируют внимание на том, что, в отличие от внутренней энергии (энергии состояния), работа и количество теплоты являются зависимыми не только от начального и конечного состояния системы, но и от того пути, по которому производилось изменение ее состояния
Первый закон термодинамики и внутренняя энергия
Когда работа A совершается в результате механического движения тела как целого, или его взаимодействия с другими телами, то знание величины внутренней энергии U не требуется для расчетов. Напротив, когда работа сопровождается передачей тепла Q, то без знания закономерности, отражающей связь этих величин между собой, уже не обойтись. Эту связь устанавливает первый закон термодинамики, который формулируется следующим образом: изменение внутренней энергии ΔU в неизолированной термодинамической системе равно сумме работы внешних сил A и количества теплоты Q, переданного системе, что выражается в виде формулы:
$ ΔU = { Q + A } $ (1).
Если же сама термодинамическая система, получив тепло Q, совершает работу А, то формула (1) принимает следующий вид:
$ ΔU = { Q – A } $ (2).
Представления о внутренней энергии сложились далеко не сразу. В течение ХIХ века существовала теория теплорода, предложенная французским ученым Лавуазье. Считалось, что теплород — это некая субстанция (особый вид материи), при втекании которой в тело, его температура увеличивается, а при вытекании происходит уменьшение температуры. Многочисленные эксперименты, проведенные в начале ХIХ века, полностью опровергли эту теорию и развеяли миф о теплороде.
Краткие итоги:
Термодинамика – это теория тепловых явлений, происходящих в макротелах и их системах без учета атомно-молекулярного строения тел.
Термодинамика изучает свойства термодинамической системы в состоянии термодинамического равновесия и процессы перехода этих систем из одного состояния в другое.
Состояние термодинамической системы характеризуется рядом физических величин, главной из которых является внутренняя энергия. Внутреннюю энергию можно изменить в процессе теплопередачи и совершения работы. Существование двух форм изменения внутренней энергии – работы и теплообмена, отражает первый закон термодинамики, который является законом сохранения и превращения энергии применительно к тепловым процессам. Открытие этого закона в середине XIX в. связано с работами Р.Майера, Д.Джоуля и Г.Гельмгольца.
Простейшими процессами перехода термодинамической системы из одного состояния в другое является изотермический, изобарный, изохорный и адиабатный.
Термодинамика позволяет объяснить работу тепловых машин, выполнить расчеты тепловых процессов.






























