Получение водорода в лаборатории
Водород в лаборатории можно получить различными методами.
Под действием электрического тока вода разлагается на водород и кислород:
При взаимодействии минеральных кислот (не сильных окислителей) с активными металлами и металлами средней активности также образуется водород.
Например , соляная кислота реагирует с цинком с образованием водорода:
Zn + 2HCl → ZnCl2 + H2
Собирать водород можно методом вытеснения воздуха, так как водород — гораздо более легкий газ, чем воздух.
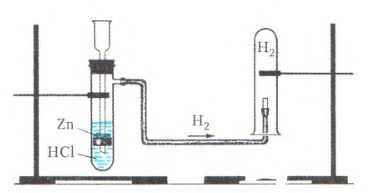
Также для собирания водорода подходит метод вытеснения воды, так как водород плохо растворим в воде:
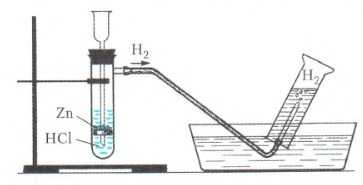
Водород выделяется также при взаимодействии активных металлов (расположенных в ряду активности до магния) с водой.
Например , натрий активно реагирует с водой с образованием водорода:
2Na + 2H2O → 2NaOH + H2
Получение в промышленности
Получение диоксида углерода в промышленности методологически разнообразно. Он находится в дымовых отходах, выпускаемых в атмосферу ТЭЦ и электростанциями, получается при брожении спирта и выступает как продукт реакции с природными карбонатами.
Индустрия получения двуокиси углерода широка. Газ можно абсорбировать несколькими способами из одного источника. Во всех случаях это поэтапный процесс очистки от примесей (для достижения требований ГОСТа) и достижения нужной консистенции, агрегатного состояния.
Получение газообразной двуокиси углерода
Газообразный CO2 извлекают из промышленных (нефтяных) дымов путем адсорбции моноэтаноламина (коммерчески выгодно) и карбонатом калия (редко). Принцип сбора частиц углерода одинаков для обоих веществ. Они направляются по трубопроводу к отходам и собирают в себя углекислый газ. После сбора, насыщенные углекислотой газы направляются на очистку.
В специальных емкостях происходит реакция в при повышенной температуре или заниженном давлении. В процессе высвобождается чистая углекислота и продукты распада (аммиак и другие).
Схематически процесс выглядит так:
- Отходящий дым смешивается с адсорбентами (газообразным карбонатом калия или моноэтаноламином);
- Накопившие в себе двуокись углерода газы поступают в специальный газгольдер для очистки;
- В реакции с высокой температурой или низким давлением происходит отделение углекислого газа от адсорбента.
В лаборатории извлечь много CO2 не получается. Но это возможно в реакции с гидрокарбонатами и кислотами. В отдельности CO2 можно выделить на промышленных станках для получения кислорода, аргона или азота. Углекислый газ здесь выступает как побочный продукт. Хранится он в специальных баллонах, поставляемых потребителю.
Получение жидкой углекислоты
Добыча жидкой углекислоты поэтапно связана с получением ее из газа. Из летучего газообразного состояния, при обработке водородом, раствором перманганата калия и углем, образуется жидкая двуокись.
Сжижение происходит из-за низкого давления, сопровождающего реакцию. После многоступенчатой очистки, жидкий диоксид углерода попадает в компрессор. Там он сжимается и подается для сушки в 2 адсорбера, поочередно перенимающие работу для восстановления. Параллельно сжатая жидкость очищается от запахов и переводится в конденсатор, а оттуда – на хранение.
Этот метод сжижения применяется для газов спиртового брожения. Он актуален для пропана, бутана и т.д. Его используют на крупных пивоварнях, а получаемая очищенная углекислота имеет высокие показатели качества.
Получение твердого диоксида углерода
Твердый диоксид образуют из жидкого путем обработки низкой температурой (-56°). В промышленных условиях только 20% переходят в твердое состояние, а остальные – испаряются.
Порядок извлечения углекислотных кристаллов (сухого льда):
- Из емкости брожения газ переходит в емкость для промывки;
- В газгольдере после мытья он сжимается и сжижается;
- Многократно сжимаясь и нагреваясь, газообразный углерод охлаждается в специальных холодильниках;
- Жидкость очищается активированным углем;
- Поступает в холодильник, где охлаждается и дополнительно очищается от примесей;
- Охлажденный CO2 направляется на испарение и пресс, где комплектуется сухой лед.
Угольная кислота и карбонаты
Химические свойства угольной кислоты и карбонатов
Угольная кислота – слабая двухосновная кислота
Угольная кислота существует только в водном растворе, где количество ее молекул и анионов в сотни раз меньше, чем количество растворенных молекул углекислого газа CO2
Диссоциирует по 2-м ступеням с образованием гидрокарбонат- и карбонат ионов:
H2CO3 как индивидуальное соединение неустойчиво и не имеет практического значения, но ее соли устойчивы и нашли широкое применение.
- Растворимыми являются карбонаты щелочных металлов. Высокая степень гидролиза является причиной щелочной реакции их водных растворов рН(0,1 М р-ра)
Все карбонаты, кроме карбонатов щелочных металлов и аммония при нагревании (более 900ºС) разлагаются до оксида металла и оксида углерода (IV):
Карбонат аммония при нагревании разлагается иначе:
Качественной реакцией является взаимодействие с кислотами является на ионы СО3 2─ и НСО3 − в результате которой происходит выделение СО2:
при взаимодействии с разбавленными растворами соляной или серной кислот происходит выделение углекислого газа, который затем пропускают через раствор известковой воды. При этом наблюдается помутнение раствора:
При дальнейшем пропускании раствор вновь становится прозрачным, помутнение исчезает:
Переход в гидрокарбонаты при пропускании CO2 через растворы карбонатов или постепенном добавлении кислот:
Гидрокарбонаты все, кроме NaНCO3 легко растворяются в воде. Водные растворы также имеют щелочную реакцию вследствие гидролиза:
при нагревании гидрокарбонаты переходят в карбонаты или гидроксиды:
Напитки с углекислотой
Газирование напитков может происходить одним из двух путей:
- При производстве популярных сладких и минеральных вод используется механический способ газирования, который предполагает насыщение углекислым газом какой-либо жидкости. Для этого необходимо специальное оборудование (сифоны, акратофоры, сатураторы) и баллоны со сжатым углекислым газом.
- При химическом способе газирования углекислоту получают в процессе брожения. Таким образом получается шампанское вино, пиво, хлебный квас. Углекислота в содовых водах получается в результате реакции соды с кислотой, сопровождающейся бурным выделением углекислого газа.

Диоксид углерода (углекислый газ)
Способы получения углекислого газа
CO2 – Конечный продукт окисления органических веществ в клетках аэробных организмов
Образуется при действии сильных кислот на карбонаты (растворимые и нерастворимые)и гидрокарбонаты металлов:
При взаимодействии растворимых карбонатов с растворимыми солями алюминия, железа (III) и хрома (III), которые необратимо гидролизуются в водном растворе:
При термическом разложении нерастворимых карбонатов и при разложении растворимых гидрокарбонатов:
При сжигании всех видов топлив:
При спиртовом брожении глюкозы под действием ферментов:
Химические свойства углекислого газа
Углекислый газ — типичный кислотный оксид. Проявляет слабые окислительные свойства
Качественная реакция на углекислый газ — помутнение известковой воды:
Взаимодействует с водой, но реакция сильно обратима, и с водой соединяется лишь 1% молекул угольной кислоты:
С основными оксидами и сильными основаниями (щелочами), с образованием карбонатов или гидрокарбонатов. При этом возможно образование как кислых, так и средних солей:
С карбонатами, с образованием гидрокарбонатов:
С водными растворами солей, образованными кислотами, слабее угольной (очень слабые кислоты):
С некоторыми восстановителями:
2Мg + CO2→ C + 2MgO
Внимание! Магний горит в атмосфере углекислого газа, поэтому горящий магний нельзя тушить углекислотными огнетушителями. В листьях растений на свету из CO2 и H2O образуются углеводы и кислород:
В листьях растений на свету из CO2 и H2O образуются углеводы и кислород:
С пероксидом натрия, с образованием карбоната натрия:
Синтез карбамида (мочевины):
Получение питьевой соды по методу Сольвэ:
Применение в промышленности
Применение углекислого газа в различных областях промышленности связано с химическими и физическими свойствами вещества. Он не горит, не опасен в минимальных концентрациях для человека и животных и является основным компонентом для жизнедеятельности растений.

Химическая промышленность:
- Участвует в синтезе искусственных химикатов;
- Регулирует температуру в реакциях;
- Нейтрализует щелочи;
- Очищает ткани животных и растений;
- Может восстанавливаться до метана.
Металлургия:
- Осаждение отходящего дыма;
- Регулирует направления течения воды при отводе шахт;
- Некоторые лазеры используют CO2 в качестве источника энергии (неон).
Производство бумаги:
- Регулирует водородный показатель в древесной массе или целлюлозе;
- Усиливает в мощности производственные машины.
Особую роль в промышленной и смежных индустриях играет сухой лед. Он применяется как:
- Источник охлаждения в морозильных камерах при перевозках;
- Охлаждение при затвердевании сплавов;
- Очистка сухим льдом оборудования (криобластинг).
41.573. Способы получения углеводородов
Основные способы получения алканов
Алканы выделяют из природных источников
(природный и попутный газы, нефть, каменный уголь).
1. Крекинг нефти (промышленный способ)
При крекинге алканы получаются вместе с непредельными соединениями (алкенами). Этот способ важен тем, что при разрыве молекул высших алканов получается очень ценное сырье для органического синтеза: пропан, бутан, изобутан, изопентан и др.
2. Гидpиpование непредельных углеводоpодов:
CnH2n + H2 = CnH2n+2
CnH2n-2 + 2H2 = CnH2n+2
3. Из синтез-газа (СО + Н2) получают смесь алканов:
$t, kat$
CO + 3H2 = CH4 + H2O
4. Синтез более сложных алканов из галогенопроизводных с меньшим числом атомов углерода – реакция Вюрца
$CH_3$$-CL + 2Na + Cl-$$CH_3 = CH_3-CH_3+2NaCl$
5. Реакция Дюма
$CH_3$$COONa + NaOH$$ = CH_4 + Na_2CO_3$
6. реакция Кольбе (электролиз солей карбоновых кислот)
$2CH_3COOK + 2H_2O \stackrel{\text{эл.ток}}{\longrightarrow} H_2 + 2KOH + C_2H_6 + 2CO_2$
7. Разложение карбида алюминия
Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
Основные способы получения алкенов:
1. Дегидрирование алканов:
CnH2n+2 = CnH2n +H2
2. Гидрирование алкинов:
$Ni, t, P$
CnH2n-2 + H2 = CnH2n
3. Дегидратация спиртов:
R-CH2-CH2-OH = R-CH=CH2 + H2O (катализатор: серная кислота и нагревание выше 180 градусов)
Правило Зайцева:
«Отрыв атома водорода происходит от наименее гидрогенизированного атома углерода»
4. Дегидрогенирование моногалогеналканов (по правилу Зайцева):
R-CH2-CH2-Г +NaOH(спиртовой раствор)→R-CH=CH2+NaГ+H2O
5. Дегалогенирование дигалогеналканов:
CH2Cl-CH2Cl + Zn (пыль) = tCH2=CH2 + ZnCl2
Основные способы получения алкинов
1. Термический крекинг метана:
2СН4 = С2H2 + 3H2 (Температура = 1500)
2. Гидролиз карбида кальция:
CaC2 + 2H2O = C2H2 + Ca (OH)2
3. Вследствие большой энергоемкости этот метод экономически менее выгоден. Для синтеза гомологов ацетилена применяют следующие методы.
Дегидрогалогенирование дигалогеналканов спиртовым раствором щелочи (щелочь и спирт берутся в избытке):
$R-CH_2-CBr_2-R + 2KOH \stackrel{\text{спирт}}{\longrightarrow} R-C \equiv C-R + 2KBr+2H_2O \\ R-CHBr-CHBr-R + 2KOH \stackrel{\text{спирт}}{\longrightarrow} R-C \equiv C-R + 2KBr +2H_2O$
4. Удлинение цепи (алкилирование ацетиленидов) при действии на ацетилениды алкилгалогенидами:
$CH_3-C\equiv CNa + Br-C_2H_5\longrightarrow CH_3-C\equiv C-C_2H_5 + NaBr$
Основные способы получения алкадиенов
Общие способы получения диенов аналогичны способам получения алкенов.
1. Каталитическое двухстадийное дегидрирование алканов (через стадию образования алкенов). Этим путем получают в промышленности дивинила из бутана, содержащегося в газах нефтепереработки и в попутных газах:
$CH_3-CH_2-CH_2-CH_3 \stackrel{Cr_2O_3, Al_2O_3}{\longrightarrow} CH_2=CH-CH=CH_2 + 2H_2$
2. Каталитическим дегидрированием изопентана (2-метилбутана) получают изопрен: $\chemfig{CH_3-CH(-CH_3)-CH_2-CH_3} \rm\overset{Cr_2O_3, Al_2O_3}{\longrightarrow} \chemfig{CH_2=C(-CH_3)-CH=CH_2 }+ 2H_2$
3. Синтез дивинила по Лебедеву:
$2C_2H_5OH \underset{400-500^{\circ}C}{\stackrel{MnO, ZnO}{\longrightarrow}} CH_2=CH-CH=CH_2 + 2H_2O + H_2$
4. Дегидратация гликолей (двухатомных спиртов, или алкандиолов):
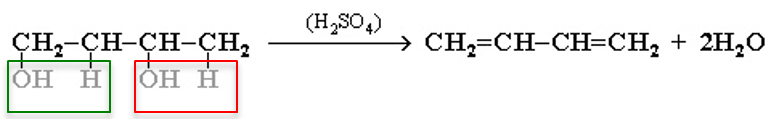
5. Действие спиртового раствора щелочи на дигалогеналканы:
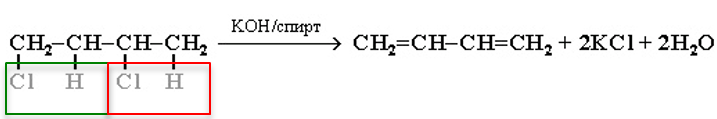
Основные способы получения циклоалканов
1. Циклоалканы содержатся в значительных количествах в нефтях некоторых месторождений. При переработке нефти выделяют главным образом циклоалканы (С5 — С7)
2. Действие активных металлов на дигалогензамещенные алканы (реакция Вюрца) приводит к образованию различных циклоалканов:
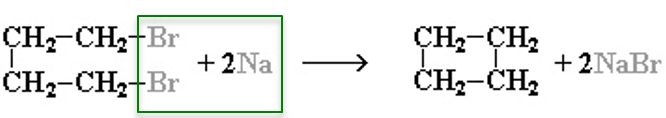
(вместо металлического натрия используется также порошкообразный цинк).
Строение образующегося циклоалкана определяется структурой исходного дигалогеналкана. Этим путем можно получать циклоалканы заданного строения.
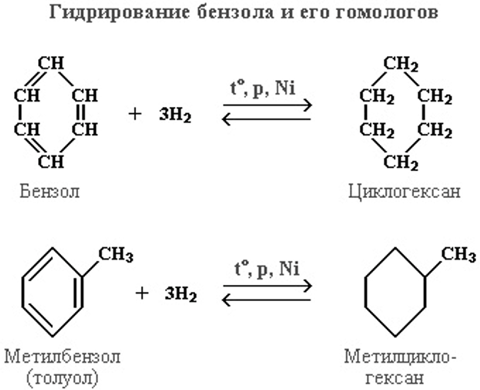
3. циклогексан и его алкильные производные получают гидрированием бензола и его гомологов, являющихся продуктами нефтепереработки.
Прочитано
Отметь, если полностью прочитал текст
Углерод, как простое вещество
Как простое вещество углерод может находиться в виде нескольких аллотропных модификаций:
- Алмаз
- Графит
- Фуллерен
- Карбин
Алмаз
Рис. Кристаллическая решетка алмаза.
Свойства алмаза:
- бесцветное кристаллическое вещество;
- самое твердое вещество в природе;
- обладает сильным преломляющим эффектом;
- плохо проводит тепло и электричество.
Рис. Тетраэдр алмаза.
Исключительная твердость алмаза объясняется строением его кристаллической решетки, которая имеет форму тетраэдра — в центре тетраэдра находится атом углерода, который связан равноценно прочными связями с четырьмя соседними атомами, образующими вершины тетраэдра (см. рисунок выше). Такая «конструкция» в свою очередь связана с соседними тетраэдрами.
Графит
Рис. Кристаллическая решетка графита.
Свойства графита:
- мягкое кристаллическое вещество серого цвета слоистой структуры;
- обладает металлическим блеском;
- хорошо проводит электричество.
В графите атомы углерода образуют правильные шестиугольники, лежащие в одной плоскости, организованные в бесконечные слои.
В графите химические связи между соседними атомами углерода образованы за счет трех валентных электронов каждого атома (изображены синим цветом на рисунке ниже), при этом четвертый электрон (изображен красным цветом) каждого атома углерода, расположенный на p-орбитали, лежащей перпендикулярно плоскости слоя графита, не участвует в образовании ковалентных связей в плоскости слоя. Его «предназначение» заключается в другом — взаимодействуя со своим «собратом», лежащим в соседнем слое, он обеспечивает связь между слоями графита, а высокая подвижность p-электронов обусловливает хорошую электропроводность графита.
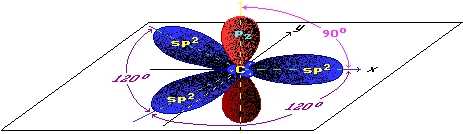 Рис. Распределение орбиталей атома углерода в графите.
Рис. Распределение орбиталей атома углерода в графите.
Фуллерен
Рис. Кристаллическая решетка фуллерена.
Свойства фуллерена:
- молекула фуллерена представляет собой совокупность атомов углерода, замкнутых в полые сферы типа футбольного мяча;
- это мелкокристаллическое вещество желто-оранжевого цвета;
- температура плавления = 500-600°C;
- полупроводник;
- входит в состав минерала шунгита.
Карбин
Свойства карбина:
- инертное вещество черного цвета;
- состоит из полимерных линейных молекул, в которых атомы связаны чередующимися одинарными и тройными связями;
- полупроводник.
Характеристики и физические свойства, плотность
Угарный газ имеет следующие физические параметры: плотность — , плохо растворим в воде (при 20оС в 100 г воды растворяется 2,32 мл). Хорошо растворяется в спирте, бензоле. При температуре -192оС угарный газ закипает, а при -205оС — плавится.
Углекислый газ в 1,5 раза тяжелее воздуха, мало растворим в воде, но вступает с ней во взаимодействие с образованием слабой угольной кислоты. При атмосферном давлении при снижении температуры до -78оС превращается в белую снегообразную массу, минуя жидкую фазу. Твердый углекислый газ называют «сухим льдом», он используется для перевозки замороженных продуктов, а также в медицине.
Образование в природе происходит при горении, гниении органических соединений. Большое его количество содержится в водах минеральных источников. При дыхании живые организмы вдыхают кислород, а выдыхают углекислый газ. Для зеленых растений свойственен процесс фотосинтеза — образования из и воды с участием зеленого пигмента растений хлорофилла глюкозы и кислорода.
Таким образом к основным физическим свойствам можно отнести:
- отсутствие цвета и запаха;
- растворимость в воде;
- тяжелее воздуха в 1,5 раза;
- при снижении температуры превращается в «сухой» лед;
- плотность при обычных условиях —
- не способен существовать в жидком состоянии при атмосферном давлении. Переходит непосредственно из твердого в газообразное. Такой процесс называется возгонкой;
- удельная теплота плавления 205 кДж/кг;
- удельная теплота испарения 379,5кДж/кг.
Благодаря своим физическим свойствам, нашел широкое применение в промышленности, включая пищевую, а именно:
- приготовление газированных напитков;
- замораживание и охлаждение, а также упаковка;
- нейтрализация химических веществ (щелочей);
- приготовление метаболических смесей в медицине;
- вспенивание пластиковых масс;
- шлифовка и изготовление металлических конструкций и т.п.
Лабораторные способы получения неорганических веществ
Основные способы получения (в лаборатории) конкретных веществ, относящихся к изученным классам неорганических соединений.
Лабораторные способы получения веществ отличаются от промышленных:
| Лабораторные способы получения веществ | Промышленные способы получения веществ |
| Реагенты могут быть редкими и дорогими | Реагенты распространенные в природе и дешевые |
| Условия реакции мягкие, без высоких давлений и сильного нагревания | Условия реакции могут быть довольно жесткими, допустимы высокие давления и температуры |
| Как правило, реагенты — жидкости или твердые вещества | Реагенты — газы или жидкости, реже твердые вещества |
СО 2 как сварочный газ
Начиная с 1960 года широкое распространение получила сварка легированных и углеродистых сталей в среде углекислого газа (СО 2 ), отвечающего требованиям ГОСТ 8050. В последнее время все большее распространение в сварочных технологиях машиностроительных предприятий находит применение сварочных газовых смесей аргона и гелия, при этом многие наиболее востребованные газовые смеси включают в себя небольшое количество активных газов (СО 2 или О 2 ), необходимых для стабилизации сварочной дуги. Однако при сварке углеродистых и низколегированных сталей основных структурных классов на российских предприятиях основным защитным газом по-прежнему продолжает оставаться углекислый газ СО 2 , что объясняется физическими свойствами этого защитного газа и его доступностью.
Чтобы уточнить стоимость или получить дополнительную консультацию, вы можете позвонить по тел.: +7 (495) 545-44-62 или отправить запрос .
Источник
Получение
Извне углекислоту получить нельзя по причине того, что в атмосфере ее почти не содержится. Животные и человек получают её при полном расщеплении пищи, поскольку белки, жиры, углеводы, построенные на углеродной основе, при сжигании с помощью кислорода в тканях образуют углекислый газ (СО 2 ).
В промышленности углекислый газ получают из печных газов, из продуктов разложения природных карбонатов (известняк, доломит). В пищевых целях используется газ, образующийся при спиртовом брожении. Также углекислый газ получают на установках разделения воздуха, как побочный продукт получения чистого кислорода, азота и аргона. В лабораторных условиях небольшие количества СО 2 получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например, мрамора, мела или соды с соляной кислотой. Побочные источники производства СО 2 — продукты горения; брожение; производство жидкого аммиака; установки риформинга; производство этанола; природные источники.
При получении углекислого газа в промышленных масштабах используют три основные группы сырья.
Группа 1 — источники сырья, из которых можно производить чистый СО 2 без специального оборудования для повышения его концентрации:
- газы химических и нефтехимических производств с содержанием 98-99% СО 2 ;
- газы спиртового брожения на пивоваренных, спиртовых и гидролизных заводах с 98-99% СО 2 ;
- газы из естественных источников с 92-99% СО 2 .
Группа 2 — источники сырья, использование которых обеспечивает получение чистого СО 2 :
газы малораспространенных химических производств с содержанием 80-95% СО 2 .
Группа 3 — источники сырья, использование которых дает возможность производить чистый СО 2 только с помощью специального оборудования:
- газовые смеси, состоящие в основном из азота и углекислого газа (продукты сгорания углеродсодержащих веществ с содержанием 8-20% СО 2 ;
- отходящие газы известковых и цементных заводов с 30-40% СО 2 ;
- колошниковые газы доменных печей с 21-23% СО 2 ;
- состоящие в основном из метана и углекислого газа и содержащие значительные примеси других газов (биогаз и свалочный газ из биореакторов с 30-45% СО 2 ;
- попутные газы при добыче природного газа и нефти с содержанием 20-40% СО 2 .
Получение углекислого газа из газов при брожении
Отходящий газ при брожении представляет собой почти чистый углекислый газ и является дешевым побочным продуктом производства.
На гидролизных заводах при брожении дрожжей с опилками выделяются газы, содержащие 99% CO2.
1 — бродильный чан; 2 — газгольдер; 3 — промывочная башня; 4 — предварительный компрессор; 5 — трубчатый холодильник; 6 — маслоотделитель; 7 — башня; 8 — башня; 9 — двухступенчатый компрессор; 10 — холодильник; 11 — маслоотделитель; 12 — цистерна.
Схема получения углекислого газа на гидролизных заводах
Газ из бродильного чана 1 подается насосами, а при наличии достаточного давления поступает самостоятельно в газгольдер 2, где происходит отделение от него твердых частиц. Затем газ поступает в промывочную башню 3, заполненную коксом или керамическими кольцами, где он омывается встречным потоком воды и окончательно освобождается от твердых частиц и растворимых в воде примесей. После промывки газ поступает в предварительный компрессор 4, где он сжимается до давления 400-550 кПа.
Так как при сжатии температура углекислого газа повышается до 90-100°С, то после компрессора газ поступает в трубчатый холодильник 5, где охлаждается до 15°С. Затем углекислота направляется в маслоотделитель 6, где отделяется масло, попавшее в газ при сжатии. После этого углекислый газ подвергается очистке водными растворами окислителей (KMnO4, K2Cr2P7, гипохромитом) в башне 7, а затем осушке активированным углем или силикагелем в башне 8.
После очистки и осушки углекислота поступает в двухступенчатый компрессор 9. На ступени I происходит сжатие его до 1-1,2 МПа. Затем углекислый газ поступает в холодильник 10, где охлаждается со 100 до 15°C, проходит маслоотделитель 11 и поступает на II ступень компрессора, где сжимается до 6-7 МПа, превращается в жидкую двуокись углерода и собирается в цистерну 12, из которой производится заправка стандартных баллонов или других емкостей (танков).
Принципиально процесс производства углекислого газа другими методами ничем не отличается от вышеуказанного: сначала газ очищается, потом производят осушку, а на последнем этапе охлаждение и сжатие для превращения в жидкость, поскольку в данном виде его удобно хранить и транспортировать.
Оксиды углерода (II) и (IV)
Оксид углерода (II) – СО
(угарный газ, окись углерода, монооксид углерода)
Физические свойства: бесцветный ядовитый газ без вкуса и запаха, горит голубоватым пламенем, легче воздуха, плохо растворим в воде. Концентрация угарного газа в воздухе 12,5—74 % взрывоопасна.
Строение молекулы:
Формальная степень окисления углерода +2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода:
В связи с этим молекула СО очень прочна и способна вступать в реакции окисления-восстановления только при высоких температурах. При обычных условиях СО не взаимодействует с водой, щелочами или кислотами .
Получение:
Основным антропогенным источником угарного газа CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Угарный газ образуется при сгорании топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления угарного газа CO в углекислый газ CO 2). В естественных условиях, на поверхности Земли, угарный газ CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров.
1) Получение в промышленности (в газогенераторах):
C + O 2 = CO 2 + 402 кДж
CO 2 + C = 2CO – 175 кДж
В газогенераторах иногда через раскалённый уголь продувают водяной пар:
С + Н 2О = СО + Н 2 – Q,
смесь СО + Н 2 – называется синтез – газом.
2) Получение СО в лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H 2SO 4(конц.):
Химические свойства:
При обычных условиях CO инертен; при нагревании – восстановитель ;
CO — несолеобразующий оксид .
1) Взаимодействие с кислородом:
2) Взаимодействие с оксидами металлов: CO + Me x O y = CO 2 + Me
3) Взаимодействие с хлором (на свету)
CO + Cl 2 свет → COCl 2 (фосген – ядовитый газ)
4) Взаимодействие с расплавами щелочей (под давлением)
CO + NaOH Pасплав→ HCOONa (формиат натрия)
Влияние угарного газа на живые организмы:
Угарный газ опасен, потому что он лишает возможности кровь нести кислород к жизненно важным органам, таким как сердце и мозг. Угарный газ объединяется с гемоглобином, который переносит кислород к клеткам организма, в следствии чего тот становится непригодным для транспортировки кислорода. В зависимости от вдыхаемого количества, угарный газ ухудшает координацию, обостряет сердечно-сосудистые заболевания и вызывает усталость, головную боль, слабость, Влияние угарного газа на здоровье человека зависит от его концентрации и времени воздействия на организм. Концентрация угарного газа в воздухе более 0,1% приводит к смерти в течение одного часа, а концентрация более 1,2% в течении трех минут.
Применение оксида углерода:
Главным образом угарный газ применяют, как горючий газ в смеси с азотом, так называемый генераторный или воздушный газ, или же в смеси с водородом водяной газ. В металлургии для восстановления металлов из их руд. Для получения металлов высокой чистоты при разложении карбонилов.
Оксид углерода (IV) СO 2 – углекислый газ
Физические свойства: Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H 2O растворяется 0,9V CO 2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO 2 называется «сухой лёд»); не поддерживает горение.
Строение молекулы: Углекислый газ имеет следующие электронную и структурную формулы —
Все четыре связи ковалентые полярные.
Получение углекислого газа:
1. В промышленности: Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка.
CaCO 3 t=1200˚C → CaO + CO 2
2. В лаборатории . Действием сильных кислот на карбонаты и гидрокарбонаты –
NaHCO 3 + HCl → NaCl + H 2O + CO 2
3. Сгорание углеродсодержащих веществ:
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
Применение
По ряду оценок, потребление СО2 на мировом рынке превышает 20 млн. метрических тонн в год. Столь высокий уровень потребления формируется под влиянием требований пищевой промышленности и нефтепромысловых предприятий, технологий газирования напитков и других промышленных нужд, например, снижения показателя Ph установок водоочистки, проблем металлургии (в том числе использования сварочного газа) и т.д.
Потребление углекислого газа неуклонно растет, поскольку расширяются сферы его применения, которые охватывают задачи от промышленного назначения до пищевого производства – консервация продуктов, в машиностроении от сварочного производства и приготовления защитных сварочных смесей до очистки поверхностей деталей гранулами «сухого льда», в сельском хозяйстве для подкормки растений, в газовой и нефтяной промышленности при пожаротушении.
Химические свойства углерода
При нормальных условиях углерод является инертным веществом, но при нагревании может реагировать с разнообразными простыми и сложными веществами.
Выше уже было сказано, что на внешнем энергетическом уровне углерода находится 4 электрона (ни туда, ни сюда), поэтому углерод может, как отдавать электроны, так и принимать их, проявляя в одних соединениях восстановительные свойства, а в других — окислительные.
Углерод является восстановителем в реакциях с кислородом и другими элементами, имеющими более высокую электроотрицательность (см. таблицу электроотрицательности элементов):
- при нагревании на воздухе горит (при избытке кислорода с образованием углекислого газа; при его недостатке — оксида углерода(II)):
C + O2 = CO2; 2C + O2 = 2CO. - реагирует при высоких температурах с парами серы, легко взаимодействует с хлором, фтором:
C + 2S = CS2
C + 2Cl2 = CCl4
2F2 + C = CF4 - при нагревании восстанавливает из оксидов многие металлы и неметаллы:
C + Cu+2O = Cu + C+2O;
C+C+4O2 = 2C+2O - при температуре 1000°C реагирует с водой (процесс газификации), с образованием водяного газа:C + H2O = CO + H2;
Углерод проявляет окислительные свойства в реакциях с металлами и водородом:
- реагирует с металлами с образованием карбидов:
Ca + 2C = CaC2 - взаимодействуя с водородом, углерод образует метан:C + 2H2 = CH4
Углерод получают термическим разложением его соединений или пиролизом метана (при высокой температуре): CH4 = C + 2H2.
Применение углерода
Соединения углерода нашли самое широкое применение в народном хозяйстве, перечислить все их не представляется возможным, укажем только некоторые:
- графит применяется для изготовления грифелей карандашей, электродов, плавильных тиглей, как замедлитель нейтронов в ядерных реакторах, как смазочный материал;
- алмазы применяются в ювелирном деле, в качестве режущего инструмента, в буровом оборудовании, как абразивный материал;
- в качестве восстановителя углерод используют для получения некоторых металлов и неметаллов (железа, кремния);
- углерод составляет основную массу активированного угля, который нашел широчайшее применение, как в быту (например, в качестве адсорбента для очистки воздуха и растворов), так и в медицине (таблетки активированного угля) и в промышленности (в качестве носителя для каталитических добавок, катализатора полимеризации и проч.).
Найден способ превращения углекислого газа в уголь

Одни специалисты трудятся над вопросом снижения выбросов в атмосферу, другие учатся извлекать уже попавший туда углерод, а третьи решают задачу: что с ним потом можно сделать? Интернациональная команда исследователей разработала метод превращения газообразного углерода в твердый при комнатных условиях. В его основе лежит работа с жидкометаллическими катализаторами.
Газообразный углерод смешивают с жидким электролитом и помещают в колбу. Далее туда вливается смесь галлия и церия – катализатор. Если теперь подать на жидкость в колбе электрический ток, катализатор запустит химическую реакцию, которая превратит углекислый газ в тонкие пластинки или хлопья на поверхности раствора. Это и есть твердый углерод, который остается только собрать.

Обычно конверсия углерода требует высоких температур, но здесь все происходит в комнатных условиях, хотя и медленно. Все дело в катализаторе, который очень эффективно проводит электричество и при этом не смешивается с хлопьями углерода, оставаясь в жидком виде. Остается решить вопросы с источником электричества и как фильтровать хлопья углерода из жидкости – вот и готова простая, масштабируемая технология превращения углекислого газа в уголь.
«Углем» твердую форму углерода авторы исследования называют по привычке, хотя эти вещества и не совсем идентичны. В частности, хлопья можно спрессовать и сделать из них электроды, а способность самого материала накапливать и хранить заряд открывает новые возможности для создания батарей. Также, он пригоден для использования в качестве синтетического топлива. Наконец, твердый углерод можно засыпать обратно в старые угольные шахты, таким образом, вернув планете использованный ресурс. А в будущем ему наверняка найдется новое применение.






























