Классификация кислот в химии
Кислоты подразделяются на группы по ряду признаков:
Состав кислотного остатка:
-
- бескислородные (HBr, HI, H2S);
- кислородсодержащие (HNO3, HClO4, H2SiO3).
- Основность – количество замещаемых водородных атомов (величина n в общей формуле HnA). Различают одно-, двух-, трех- и многоосновные кислоты.
- Сила (способность к отдаче протонов H+):
-
- Сильные – имеют высокую степень диссоциации (HI, HNO3, H2SO4). Самая сильная кислота в химии, поддающаяся хранению – органическая фторированная карборановая кислота H(CHB11F11). Большинство неорганических кислот характеризуются большей силой, чем органические.
- Слабые – диссоциируют в малой степени (H2S, H2CO3, HClO). Чем прочнее связь водорода с кислотным остатком, тем слабее кислота. Свинцовистая кислота H2PbO2 – самая слабая кислота в химии неорганических соединений.
Силу кислородсодержащих кислот с формулой определяют по разности m – n:
| m – n | Сила | Примеры |
| очень слабая | HClO, H3AsO3 | |
| 1 | слабая | H2CO3, H2SiO3, H3PO4 |
| 2 | сильная | HNO3, HClO3, H2SO4 |
| 3 | очень сильная | HClO4, HMnO4 |
Кислоты классифицируют также по растворимости, летучести и устойчивости.
Свойства кислот
В стандартных условиях кислоты представляют собой жидкости или твердые вещества. Водные растворы кислот изменяют цвет индикаторов:
- лакмус: фиолетовый → красный;
- метилоранж: оранжевый → красный;
- универсальный: оранжевый → красный;
Фенолфталеин на кислую среду не реагирует.
Химические свойства
Реакции замещения с металлами, расположенными в электрохимическом ряду активности до водорода:

Водород не выделяется в реакциях с концентрированной серной и азотной кислотами, так как металлы в этом случае окисляются серой S6+ и азотом N5+:
![]()
- Реакции обмена с различными классами соединений:
- С основными и амфотерными оксидами:
Продукты реакции – соль и вода.
С основаниями в реакциях нейтрализации с образованием соли и воды:
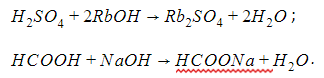
С солями, если происходит выпадение осадка или выделение газа:
![]()
Сильная кислота вытесняет из соли более слабую. Сила кислот убывает слева направо в ряду:
![]()
Так, в карбонате кальция CaCO3 плавиковой кислотой HF вытесняется угольная H2CO3:
![]()
Разложение
При нагревании молекулы нерастворимых кислот разлагаются на кислотный оксид и воду:
Неустойчивые молекулы угольной и сернистой кислот разлагаются в момент образования на газ и воду:
Водородный показатель
При проведении диссоциирующих реакций важно правильно определить уровень кислотности воды. Для его количественного выражения применяется величина pH, называющаяся силой, весом или потенциалом водорода
Она позволяет измерить активность ионов водорода. Если уровень pH превышает 7, то у вещества присутствуют кислотные свойства, если же этот показатель меньше 7, то свойства являются основными.
Способы определения
Результаты химических реакций, в которых участвует любое вещество, напрямую зависят от уровня его кислотности. А потому химики всегда измеряют этот показатель.
Существует несколько методов определения pH:
- Инструментальный способ. В этом случае применяется pH-метр. Этот прибор трансформирует концентрацию протонов в какой-либо жидкости в электрический сигнал.
- Индикаторы. Это вещества, изменяющие оттенок цвет в зависимости от показателя pH. Использование различных индикаторов позволяет получить довольно точные данные об уровне кислотности.
- Соль. Соль представляет собой соединение ионов, которое полностью диссоциирует в слабом водном растворе. Для определения кислотно-щелочных свойств соляного раствора, прежде всего, нужно установить и изучить свойства ионов, находящиеся в растворе.
Буферный раствор
Буферным раствором называется вещество, отличающееся наличием постоянной концентрации ионов водорода.
При добавлении сильной кислоты или такого же основания в небольших дозах эти растворы сохраняют изначальный уровень кислотности.
Для приготовления такой смеси нужно смешать слабое кислое вещество или основание с соответствующей солью.
При изготовлении буферного раствора необходимо учитывать следующие факторы:
- Интервал уровня кислотности, в котором вещество станет эффективным.
- Ёмкость раствора, то есть какой объём сильного кислотного соединения или основания можно добавить в смесь, не изменив её pH.
- При соединении веществ не должно быть реакций, способных повлиять на состав раствора.
Кислоты в природе
Кислоты довольно широко распространены в природе. До сих пор вы наиболее часто сталкивались с ними, употребляя в пищу продукты кислого вкуса — фрукты, кефир, квашеную капусту и маринованные овощи, в которых содержатся различные кислоты. Многим из вас, конечно же, кислый вкус не очень нравится, но кислые продукты необходимы организму так же, как и сладкие. Поэтому давайте узнаем, где в природе содержатся эти полезные кислоты. Наиболее часто они образуются в растениях и содержатся в их плодах или листьях, которые мы употребляем в пищу. В разных растениях образуются разные кислоты: в лимонах — лимонная, в яблоках — яблочная, а в щавеле — щавелевая. Известны также природные кислоты, которые содержатся в организмах некоторых насекомых, например муравьев (муравьиная кислота).
Молочная кислота, придающая кислый вкус кефиру, образуется при скисании молока или капусты, а уксусная кислота — при скисании вина. Все эти кислоты относятся к органическим кислотам, с которыми вы познакомитесь позже.
Неорганические кислоты, которые вы изучаете сейчас, также встречаются в природе. На пример, сероводородная (Н2S) и угольная (H2CO3) кислоты содержатся в водах некоторых минеральных источников. Соляная кислота (HCl) входит в состав желудочного сока человека. Азотная и серная кислоты в небольших количествах встречаются в дождевой воде («кислотные дожди»).
Краткие выводы урока:
- Кислоты классифицируются по числу атомов водорода в молекулах (по основности) и по наличию в них атомов кислорода.
- Кислоты широко распространены в природе.
Надеюсь урок 34 «Кислоты» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Где содержатся бескислородные кислоты?
Бескислородные кислоты – это кислоты, которые содержат атомы углерода, связанные с атомами водорода, аминогруппами, карбоксильными группами и другими функциональными группами, но не содержат атомов кислорода.
Они могут быть синтезированы организмами с помощью специальных ферментов или поступать с пищей. Некоторые бескислородные кислоты синтезируются микроорганизмами, например, в кишечнике, и участвуют в обмене веществ с микроорганизмами, которые живут в организме.
Они содержатся в растительных и животных продуктах: молоко, мясо, рыба, яйца, орехи, фрукты, овощи и злаки. Например, жирные кислоты, такие как омега-3 и омега-6, содержатся в рыбе, орехах и растительных маслах.
Бескислородные кислоты имеют важное значение для организма, они участвуют в процессах, связанных с обменом веществ, регулированием гормонов, иммунитетом и другими жизненно важными процессами
Хлористоводородная кислота
Наиболее часто используемой бескислородной кислотой является хлористоводородная кислота с общей формулой HCl, также известная как соляная кислота. Кислотным остатком в этом случае является ион хлора. Соляная кислота представляет собой бесцветную жидкость с плотностью, превышающей плотность воды. Это очень едкое вещество. Концентрированный раствор соляной кислоты (имеется в продаже с максимальной концентрацией 38%) выделяет характерный белый дым. Это крошечные капельки соляной кислоты — газообразный хлористый водород из сосуда соединяется с водяным паром, содержащимся в воздухе, и виден как «белый дым». Соляная кислота при контакте с тканями, кожей или бумагой разрушает их. Все работы, связанные с использованием этого соединения, должны выполняться в защитных очках, защитной одежде и перчатках
Кроме того, следует проявлять особую осторожность, так как ожог соляной кислотой опасен
В лабораторных условиях, а также в промышленных масштабах соляную кислоту можно получить путем растворения газообразного хлористого водорода в воде. Промышленное производство этого соединения часто сочетается с другими химико-технологическими процессами, например, когда в качестве побочного продукта образуется хлористый водород. Значительные количества хлористоводородной кислоты образуются при электролизе водного раствора хлорида натрия. Хлор и водород, образующиеся в качестве побочных продуктов, реагируют друг с другом и в виде газообразного HCl затем могут поглощаться водой.
Разбавленный раствор соляной кислоты содержится в желудочном соке человека и других млекопитающих. Он выполняет ряд важных функций в пищеварительных процессах. Соляная кислота является важным компонентом многих промышленных процессов. Она используется в процессах металлообработки, текстильной и сахарной промышленностях. Фармацевтическая промышленность также использует это соединение, например, для производства антацидных препаратов. Красители, изготовленные с использованием хлористоводородной кислоты, встречаются в некоторых декоративных косметических средствах.

Кислоты, их соли и ангидриды
Названия и состав некоторых кислот, их солей (наименования кислотных остатков) и ангидридов (кислотных оксидов) представлены в таблице:
| Неорганические | ||||
| Кислота | Формула | Кислотный остаток и его валентность | Кислотный оксид | |
| Бескислородные | ||||
| одноосновная | фтороводородная (плавиковая) | HF | F- (I), фторид | — |
| хлороводородная (соляная) | HCl | Cl- (I), хлорид | — | |
| бромоводородная | HBr | Br- (I), бромид | — | |
| йодоводородная | HI | I- (I), йодид | — | |
| двухосновная | сероводородная | H2S | S2- (II), сульфид | — |
| селеноводородная | H2Se | Se2- (II), селенид | — | |
| Кислородсодержащие | ||||
| одноосновная | азотистая | HNO2 | NO2- (I), нитрит | оксид азота (III) |
| азотная | HNO3 | NO3- (I), нитрат | оксид азота (V) | |
| хлорноватистая | HClO | ClO- (I), гипохлорит | оксид хлора (I) | |
| хлористая | HClO2 | ClO2- (I), хлорит | оксид хлора (III) | |
| хлорноватая | HClO3 | ClO3- (I), хлорат | оксид хлора (V) | |
| хлорная | HClO4 | ClO4- (I), перхлорат | оксид хлора (VII) | |
| марганцовая | HMnO4 | MnO4- (I), перманганат | оксид марганца (VII) | |
| двухосновная | сернистая | H2SO3 | SO32- (II), сульфит | оксид серы (IV) |
| серная | H2SO4 | SO42- (II), сульфат | оксид серы (VI) | |
| угольная | H2CO3 | CO32- (II), карбонат | оксид углерода (IV) | |
| кремниевая | H2SiO3 | SiO32- (II), силикат | оксид кремния (IV) | |
| хромовая | H2CrO4 | CrO42- (II), хромат | оксид хрома (VI) | |
| трехосновная | ортофосфорная | H3PO4 | PO43- (III), (орто)фосфат | оксид фосфора (V) |
| (орто)борная | H3BO3 | BO33- (III), (орто)борат | оксид бора (III) | |
| мышьяковая | H3AsO4 | AsO43- (III), арсенат | оксид мышьяка (V) | |
| Органические | ||||
| Кислота | Формула | Кислотный остаток и его валентность | ||
| одноосновная | муравьиная | HCOOH | HCOO- , формиат | |
| уксусная | CH3COOH | CH3COO- , ацетат | ||
| двухосновная | щавелевая | HOOC-COOH | -OOC-COO- , оксолат ((C2O42-) |
Классификация неорганических веществ с примерами соединений
Как мы видим, прежде всего все неорганические вещества делятся на простые и сложные:
Простыми веществами называют такие вещества, которые образованы атомами только одного химического элемента. Например, простыми веществами являются водород H2, кислород O2, железо Fe, углерод С и т.д.
Среди простых веществ различают металлы, неметаллы и благородные газы:
Металлы образованы химическими элементами, расположенными ниже диагонали бор-астат, а также всеми элементами, находящимися в побочных группах.
Благородные газы образованы химическими элементами VIIIA группы.
Неметаллы образованы соответственно химическими элементами, расположенными выше диагонали бор-астат, за исключением всех элементов побочных подгрупп и благородных газов, расположенных в VIIIA группе:
Названия простых веществ чаще всего совпадают с названиями химических элементов, атомами которых они образованы. Однако для многих химических элементов широко распространено такое явление, как аллотропия. Аллотропией называют явление, когда один химический элемент способен образовывать несколько простых веществ. Например, в случае химического элемента кислорода возможно существование молекулярных соединений с формулами O2 и O3. Первое вещество принято называть кислородом так же, как и химический элемент, атомами которого оно образовано, а второе вещество (O3) принято называть озоном. Под простым веществом углеродом может подразумеваться любая из его аллотропных модификаций, например, алмаз, графит или фуллерены. Под простым веществом фосфором могут пониматься такие его аллотропные модификации, как белый фосфор, красный фосфор, черный фосфор.
Что такое бескислородные кислоты?
Бескислородные кислоты — это химические соединения, которые не содержат кислорода в своей структуре. Такие кислоты могут быть органическими или неорганическими и могут обладать различными свойствами.
Примеры бескислородных кислот включают серную кислоту, фосфорную кислоту, муравьиную кислоту, уксусную кислоту и другие.
Бескислородные кислоты играют важную роль в биохимических процессах организмов, например, в желудочно-кишечном тракте человека, где муравьиная и уксусная кислоты участвуют в обработке пищи.
Однако, некоторые бескислородные кислоты, такие как серная и фосфорная кислоты, могут быть ядовитыми и вредными для организма при неправильном использовании в промышленности.
Бескислородные кислоты также используются в напитках, пищевых добавках и косметических продуктах в качестве регулятора кислотности, ароматизатора и консерванта.
Самые опасные кислотные соединения
На сегодняшний день самой сильной кислотой в мире считается пентафторид сурьмы фтористоводородной кислоты. Её химическая формула — HFSbF5. Не существует точных данных об активности этого соединения, но установлено, что его 55-процентный раствор почти в миллион раз сильнее концентрированной серной кислоты.
Следующим по силе является карборановое кислотное соединение. Это вещество разрешается хранить только в специальной ёмкости. Она также во много раз опаснее серной и растворяет даже стекло.
Ещё одной суперкислотой является плавиковая. Она не имеет цвета и, подобно предыдущему веществу, способна разъедать стекло. Для перевозки этого едкого соединения применяют полиэтилен. Вещество прекрасно вступает в реакцию с большинством металлов, но не взаимодействует с парафином. Соединение токсично, даже его пары опасны для здоровья. Кислота обладает эффектом наркотика.

Самое известное сильное вещество — серная кислота. Из-за больших производственных объёмов некоторые химики считают именно её самой опасной в мире. По мере того как увеличивается концентрация реагента, растёт и его опасность для здоровья человека, хотя даже растворы серного кислотного соединения могут нанести серьёзный вред. Это вещество окисляет металлы и является крайне едким, даже пары реагента очень опасны. При контакте происходит поражение кожи и слизистых оболочек, органов дыхания, а также внутренних органов человека.
Часто используемая в быту муравьиная кислота тоже относится к ядовитым химикатам. Эта ситуация объясняется тем, что опасность возникает только при высокой концентрации вещества. В обычных условиях оно бесцветно, легко образует водные растворы, а также успешно растворяется в ацетоне.
При концентрации меньше 10% реагент вызывает только раздражение. Если же этот показатель повышен, то соединение может разъесть ткани и множество других веществ. Его пары повреждают глаза, слизистые оболочки и дыхательные пути. При попадании внутрь организма наступает серьёзное отравление. Но в минимальных концентрациях реагент успешно перерабатывается и выводится из организма. В небольших дозах оно присутствует во фруктах, выделениях насекомых, крапиве.
Мощным ядом является азотная кислота. В разных пропорциях она прекрасно смешивается с водой. Реагент крайне опасен для человека. Его пары наносят серьёзный вред органам дыхания и слизистым оболочкам. Кожный покров при попадании кислоты становится жёлтым, на нём остаются язвы. Пострадавшие места требуют длительного восстановительного процесса.
При воздействии высокой температуры или света азотная кислота распадается, превращаясь в довольно токсичный газ. У вещества не возникает химической реакции со стеклом, а потому этот материал применяют для хранения реагента. Создателем ядовитого соединения является алхимик Джабир.
Бескислородная кислота
Бескислородные кислоты обычно получаются непосредственным соединением водорода с неметаллом с последующим растворением полученного при этом газообразного продукта в воде.
Бескислородные кислоты образуются растворением соответствующих газообразных соединений в воде. Бромистоводородная кислота образуется при растворении в воде газообразного бромистого водорода НВг, сероводородная — при растворении сероводорода HaS. Так как все перечисленные выше кислоты бесцветны, то и их растворы также лишены какой-либо окраски. Для того чтобы обнаружить в растворе наличие кислоты ( безразлично какой) применяют упомянутые выше индикаторы, которые меняют свою окраску в иной определенный цвет только при наличии в растворе кислоты.
Бескислородные кислоты получают путем соединения водорода с неметаллом с последующим растворением водородного соединения в воде.
Бескислородные кислоты получают путем синтеза их из простых веществ и последующим растворением полученного продукта в воде.
Бескислородные кислоты получают путем соединения водорода с неметаллом с последующим растворением водородного соединения в воде.
Бескислородные кислоты получают путем синтеза их из простых веществ и последующим растворением полученного продукта в воде.
Бескислородные кислоты получают путем синтеза водорода с неметаллом с последующим растворением водородного соединения в воде.
Важнейшие бескислородные кислоты приведены в табл. 4.8. Большинство из них в виде свободных кислот нестабильны.
Бескислородные кислоты ангидридов не имеют.
Важнейшие бескислородные кислоты приведены в табл. 4.8. Большинство из них в виде свободных кислот нестабильны.
Получая бескислородные кислоты, сначала синтезируют соответствующее водородное соединение ( например, хлористый водород или сероводород), а затем растворяют его в воде.
Различают кислородные и бескислородные кислоты.
Название бескислородной кислоты составляют из названия элемента, образующего ее, с прибавлением окончания водородная.
|
Названия кислот и соответствующих их средним солям. |
Названия бескислородных кислот составляют из названия элемента с добавлением — водородная, например HI — иодо-водородная кислота. Названия кислородных кислот производят от названия элемента, причем, если он образует больше одной кислородной кислоты, проявляя при этом разные степени окисления, то в названиях этих кислот используют разные суффиксы, а также приставки. Так, суффикс — ист употребляют в названиях кислот, соответствующих более низкой степени окисления элемента, образующего кислоту.
Свойства
Большинство кислот – жидкости с кислым вкусом. Вольфрамовая, хромовая, борная и несколько других кислот находятся в твёрдом состоянии при нормальных условиях. Некоторые кислоты (Н2СО3, H2SO3, HClO) существуют только в виде водного раствора и относятся к слабым кислотам.
 Рис. 2. Хромовая кислота.
Рис. 2. Хромовая кислота.
Кислоты – активные вещества, реагирующие:
- с металлами:
Ca + 2HCl = CaCl2 + H2; - с оксидами:
CaO + 2HCl = CaCl2 + H2O; - с основанием:
H2SO4 + 2KOH = K2SO4 + 2H2O; - с солями:
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O.
Все реакции сопровождаются образованием солей.
Возможна качественная реакция с изменением цвета индикатора:
- лакмус окрашивается в красный;
- метил оранж – в розовый;
- фенолфталеин не меняется.
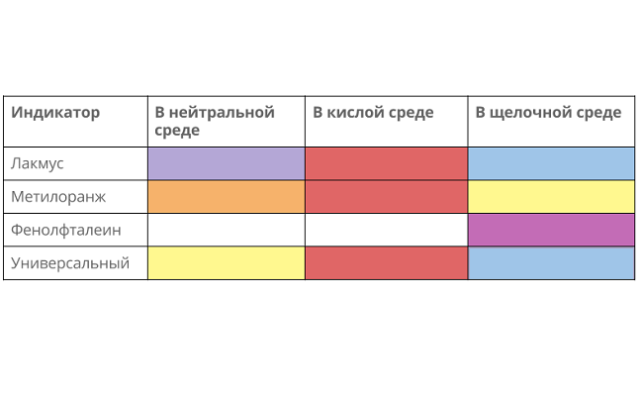 Рис. 3. Цвета индикаторов при взаимодействии кислоты.
Рис. 3. Цвета индикаторов при взаимодействии кислоты.
Химические свойства минеральных кислот определяются способностью диссоциироваться в воде с образованием катионов водорода и анионов водородных остатков. Кислоты, реагирующие с водой необратимо (диссоциируются полностью) называются сильными. К ним относятся хлорная, азотная, серная и хлороводородная.
Что мы узнали?
Неорганические кислоты образованы водородом и кислотным остатком, которым являются атомы неметалла или оксид. В зависимости от природы кислотного остатка кислоты классифицируются на бескислородные и кислородсодержащие. Все кислоты имеют кислый вкус и способны диссоциироваться в водной среде (распадаться на катионы и анионы). Кислоты получают из простых веществ, оксидов, солей. При взаимодействии с металлами, оксидами, основаниями, солями кислоты образуют соли.
-
/5
Вопрос 1 из 5
Определение и формулы
Кислота – соединение, молекулы которого способны к обмену или замещению водородного катиона (протона) катионом металла с присоединением его к кислотному остатку. В химических реакциях кислотный остаток, состоящий из одного (простой) или нескольких (сложный) атомов, сохраняет свой состав.

Химические формулы
В неорганической химии общая формула кислот имеет вид где H – водород, n – количество атомов, A – кислотный остаток.
Значение n соответствует валентности кислотного остатка. Формула кислоты позволяет установить состав соединений, образуемых с ее участием, и составить уравнение реакции.
Органические карбоновые кислоты имеют общую формулу RCOOH, где R – углеводородный радикал, COOH – карбоксильная группа, атом водорода в составе которой может замещаться.
Ионные формулы
При растворении в воде происходит диссоциация – разложение – молекул кислоты на катионы H+ и анионы кислотных остатков. Поэтому кислоту можно представить в ионной записи . Так, – ионный состав соляной кислоты – серной кислоты H2SO4; – ортофосфорной кислоты H3PO4.
Диссоциация молекул карбоновых кислот происходит по схеме . Например, ионная формула пропионовой кислоты CH3CH2COOH имеет вид .
Структурные формулы
Взаимное расположение атомов и кратность связей в молекуле отражают графические, или структурные, формулы:
| Кислота | Структурная формула | Трехмерная модель молекулы |
| плавиковая HF | ||
| угольная H2CO3 | ||
| уксусная CH3COOH |
Общая характеристика
Кислоты классифицируются на бескислородные и кислородосодержащие, а также на органические и неорганические.
Рис. 1. Классификация кислот – бескислородные и кислородосодержащие.
Бескислородные кислоты – это растворы в воде таких бинарных соединений, как галогеноводороды или сероводород. В растворе полярная ковалентная связь между водородом и электроотрицательным элементом поляризуется под действием дипольных молекул воды, и молекулы распадаются на ионы. присутствие ионов водорода в веществе и позволяет называть водные растворы этих бинарных соединений кислотами.
Кислоты называют от названия бинарного соединения прибавлением окончания -ная. например, HF – фтороводородная кислота. Анион кислоты называют по названию элемента прибавлением окончания -ид, например, Cl – хлорид.
Кислородосодержащие кислоты (оксокислоты) – это кислотные гидроксиды, диссоциирующие по кислотному типу, то есть как протолиты. Общая формула их – Э(ОН)mOn, где Э – неметалл или металл с переменной валентностью в высшей степени окисления. при условии, когда n равно 0, то кислота слабая (H2BO3 – борная), если n=1, то кислота либо слабая, либо средней силы (H3PO4 -ортофосфорная), если n больше или равно 2, то кислота считается сильной (H2SO4 ).
 Рис. 2. Серная кислота.
Рис. 2. Серная кислота.
Кислотным гидроксидам соответствуют кислотные оксиды или ангидриды кислот, например, серной кислоте соответствует серный ангидрид SO3 .
Классификация
Основная формула минеральных кислот – HnAc, где Ac – кислотный остаток. В зависимости от состава кислотного остатка выделяют два типа кислот:
- кислородные, содержащие кислород;
- бескислородные, состоящие только из водорода и неметалла.
Основной список неорганических кислот в соответствии с типом представлен в таблице.
|
Тип |
Название |
Формула |
|
Кислородные |
Азотная |
HNO3 |
|
Азотистая |
HNO2 |
|
|
Борная |
H3BO3 |
|
|
Дихромовая |
H2Cr2O7 |
|
|
Йодная |
H5IO6 |
|
|
Йодноватая |
HIO3 |
|
|
Кремниевые – метакремниевая и ортокремниевая |
H2SiO3 и H4SiO4 |
|
|
Марганцовая |
HMnO4 |
|
|
Марганцовистая |
H2MnO4 |
|
|
Метафосфорная |
HPO3 |
|
|
Мышьяковая |
H3AsO4 |
|
|
Ортофосфорная |
H3PO4 |
|
|
Серная |
H2SO4 |
|
|
Сернистая |
H2SO3 |
|
|
Тиосерная |
H2S2O3 |
|
|
Тетратионовая |
H2S4O6 |
|
|
Угольная |
H2CO3 |
|
|
Фосфористая |
H3PO3 |
|
|
Фосфорноватистая |
H3PO2 |
|
|
Хлорная |
HClO4 |
|
|
Хлорноватая |
HClO3 |
|
|
Хлористая |
HClO2 |
|
|
Хлорноватистая |
HClO |
|
|
Хромовая |
H2CrO4 |
|
|
Циановая |
HOCN |
|
|
Бескислородные |
Фтороводородная (плавиковая) |
HF |
|
Хлороводородная (соляная) |
HCl |
|
|
Бромоводородная |
HBr |
|
|
Йодоводородная |
HI |
|
|
Сероводородная |
H2S |
|
|
Циановодородная |
HCN |
Кроме того, в соответствии со свойствами кислоты классифицируются по следующим признакам:
- растворимость: растворимые (HNO3, HCl) и нерастворимые (H2SiO3);
- летучесть: летучие (H2S, HCl) и нелетучие (H2SO4, H3PO4);
- степень диссоциации: сильные (HNO3) и слабые (H2CO3).
Рис. 1. Схема классификации кислот.
Для обозначения минеральных кислот используются традиционные и тривиальные названия. Традиционные названия соответствуют наименованию элемента, который образует кислоту с добавлением морфем -ная, -овая, а также -истая, -новатая, -новатистая для обозначения степени окисления.
Задания
1. Назовите валентность кислотного остатка:
-
- H3SbO4;
- H4SnO4;
- H2Te;
- HBrO4.
2. Установите степени окисления элементов в кислотах и наименования кислот в соответствии с номенклатурой:
-
- H3AsO4 и HAsO3;
- HIO2 и HIO3.
3. Какое соединение в ряду CO2, BaSO4, HCl, HCOOH, Na2CO3, H2SiO3, MgO, H3AsO4 является:
-
- двухосновной кислотой;
- трехосновной кислотой;
- сильной кислотой;
- карбоновой кислотой?
4. Определите тип реакции Mg+HCl=? Каковы ее продукты? Составьте ее молекулярное и ионное уравнения.
5. H2WO4 – малорастворимая вольфрамовая кислота. На какие вещества она разлагается при нагревании? Составьте уравнение реакции разложения.
Тривиальные названия неорганических веществ
Под тривиальными названиями понимают названия веществ не связанные, либо слабо связанные с их составом и строением. Тривиальные названия обусловлены, как правило, либо историческими причинами либо физическими или химическими свойствами данных соединений.
Список тривиальных названий неорганических веществ, которые необходимо знать:
| Na3[AlF6] | криолит |
| SiO2 | кварц, кремнезем |
| FeS2 | пирит, железный колчедан |
| CaSO4∙2H2O | гипс |
| CaC2 | карбид кальция |
| Al4C3 | карбид алюминия |
| KOH | едкое кали |
| NaOH | едкий натр, каустическая сода |
| H2O2 | перекись водорода |
| CuSO4∙5H2O | медный купорос |
| NH4Cl | нашатырь |
| CaCO3 | мел, мрамор, известняк |
| N2O | веселящий газ |
| NO2 | бурый газ |
| NaHCO3 | пищевая (питьевая) сода |
| Fe3O4 | железная окалина |
| NH3∙H2O (NH4OH) | нашатырный спирт |
| CO | угарный газ |
| CO2 | углекислый газ |
| SiC | карборунд (карбид кремния) |
| PH3 | фосфин |
| NH3 | аммиак |
| KClO3 | бертолетова соль (хлорат калия) |
| (CuOH)2CO3 | малахит |
| CaO | негашеная известь |
| Ca(OH)2 | гашеная известь |
| прозрачный водный раствор Ca(OH)2 | известковая вода |
| взвесь твердого Ca(OH)2 в его водном растворе | известковое молоко |
| K2CO3 | поташ |
| Na2CO3 | кальцинированная сода |
| Na2CO3∙10H2O | кристаллическая сода |
| MgO | жженая магнезия |
Номенклатура
Систематические наименования бескислородных кислот строятся по следующему правилу: название элемента + суффикс «-о-» + «-водородная» (бромоводородная HBr ).
Наименование кислородсодержащей кислоты определяют особенности состава:
Степень окисления кислотообразующего элемента:
| высшая | название элемента + суффикс «-н-», «-ов-», «-ев-» | |
| промежуточная +5 | название элемента + суффикс «-оват-» | |
| промежуточная +3, +4 | название элемента + суффикс «-ист-», «-овист-» | |
| +1 | название элемента + суффикс «-оватист-» |
Содержание кислорода:
| выше | приставка «орто-» + название кислоты | |
| ниже | приставка «мета-» + название кислоты |
Химические свойства кислот
Для кислот характерен ряд свойств, которые отличают их от солей и других химических элементов:
Действие на индикаторы. Как протолиты кислоты диссоциируют с образованием ионов H+, которые изменяют окраску индикаторов: фиолетовый раствор лакмуса становится красным, а оранжевый раствор метилоранжа становится розовым. Многоосновные кислоты диссоциируют ступенчато, причем каждая последующая стадия идет труднее предыдущей, так как на второй и третьей ступенях диссоциируют все более слабые электролиты:
H2SO4 =H+ +HSO4 –
В зависимости от того, является ли кислота концентрированной или разбавленной зависит цвет индикатора. Так, например, при опускании лакмуса в концентрированную серную кислоту, индикатор становится красным, в разбавленной же серной кислоте цвет не изменится.
Реакция нейтрализации, то есть взаимодействие кислот с основаниями, в результате чего происходит образование соли и воды, идет всегда, если хотя бы один из реагентов сильный (основание или кислота). Реакция не идет, если кислота слабая, основание нерастворимо. Например, не идет реакция:
H2SiO3 (слабая, нерастворимая в воде кислота)+ Cu(OH)2 – реакция не идет
Но в других случаях реакция нейтрализации с этими реагентами идет:
H2SiO3 +2KOH (щелочь)=K2SiO3 +2H2O
Взаимодействие с основными и амфотерными оксидами:
Fe2O3 +3H2SO4 =Fe2 (SO4)3 +3H2O
Взаимодействие кислот с металлами, стоящими в ряду напряжений левее водорода, приводит к процессу, в результате которого образуется соль, и выделяется водород. Эта реакция идет легко, если кислота достаточно сильная.
Азотная кислота и концентрированная серная кислоты реагируют с металлами за счет восстановления не водорода, а центрального атома:
Mg+H2 SO4 +MgSO4 +H2
Взаимодействие кислот с солями происходит, если в результате образуется слабая кислота. Если соль, реагирующая с кислотой, растворима в воде, то реакция пойдет также в том случае, если образуется нерастворимая соль:
Na2SiO3 (растворимая соль слабой кислоты)+2HCl (сильная кислота)=H2SiO3 (слабая нерастворимая кислота)+2NaCl (растворимая соль)
Многие кислоты находят применение в промышленности, например, уксусная кислота необходима для консервирования мясных и рыбных продуктов
 Рис. 3. Таблица химические свойства кислот.
Рис. 3. Таблица химические свойства кислот.
Что мы узнали?
В 8 классе по химии дается общая информация по теме «Кислоты». Кислоты – это сложные вещества, в состав которых входят атомы водорода, которые способны замещаться на атомы металлов и кислотных остатков. Изучаемые химические элементы обладают рядом химических свойств, например, они могут взаимодействовать с солями, оксидами, металлами.
-
/10
Вопрос 1 из 10
Сильные и слабые реагенты
Если реагент в водном растворе полностью распадается на ионы, то есть диссоциирует, то оно является сильным, поскольку слабые химические соединения никогда не растворяются до конца.

Кроме того, отличить слабую кислоту можно посредством измерения её проводимости. Сильные соединения являются хорошими электролитами. Сильные основания при попадании в воду также распадаются. Следует отметить, что основания также называют гидроксидами или гидроокисями.
Существует специальные перечни слабых и сильных кислот и оснований. Таблица, приведённая ниже, также может использоваться для классификации реагентов.
| Сильная кислота | Слабая кислота | Сильное основание | Слабое основание |
|---|---|---|---|
| HCI соляная или хлороводородная | HF фтороводородная | NaOH гидроокись натрия | Mg(OH)2 гидроокись магния |
| HBr бромоводородная | CH3COOH уксусная | KOH гидроокись калия | Fe(OH)2 гидроокись железа (II) |
| HI йодоводородная | H2SO3 сернистая | Ca(OH)2 гидроокись кальция | Zn(OH)2 гидроокись цинка |
| HNO3 азотная | H2S сероводородная | Ba(OH)2 гидроокись бария | NH4OH гидроокись аммония |
| HClO4 хлорная | HNO2 азотистая | LiOH гидроокись лития | Fe(OH)3 гидроокись железа (III) |
| H2SO4 серная | H2SiO3 кремниевая |
А также следует отметить, что кислородсодержащая угольная (H2CO3) и ортофосфорная (H3PO4) или фосфорная кислоты — слабые. К сильным же необходимо добавить хромовую, которая является средней по силе.
Основная классификация
Чаще всего кислые вещества разделяют на кислородосодержащие и бескислородные. Состав последних соединений отличается тем, что в них нет кислорода, но есть водород. В связи с этим их названия всегда дополнены словом «водородная». Например, хлороводородная, сероводородная.
Кроме того, кислоты имеют классификацию по количеству атомов водорода.
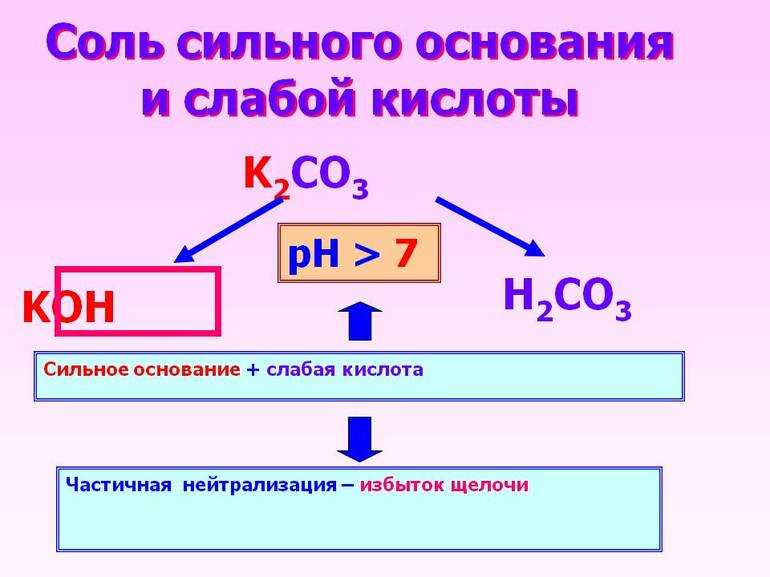
Так, они подразделяются на следующие типы:
- одноосновные;
- двухосновные;
- трехосновные.
Но также существуют органические кислоты, то есть органические вещества, которые проявляют свойства, присущие кислотным соединениям. Из них наиболее известны уксусная, щавелевая, муравьиная, лимонная, молочная и яблочная.
Все кислые вещества и основания подразделяются на сильные и слабые. Но необходимо понять, что эти понятия никак не связаны с концентрацией соединений. Сила кислоты определяется её способностью вступать в химическую реакцию, отдавая водородные ионы.
Так, вещество считается сильным, если этот процесс проходит легко.
Концентрация вещества
Зачастую химикам приходится решать задачи на определение количества чистой кислоты, находящейся в растворе, в процентах. В таких случаях искомым значением является концентрация.
Это величина, позволяющая определять количественный состав жидкого химического вещества. К примеру, для того, чтобы узнать, сколько чистой серной кислоты находится в разбавленном растворе, необходимо небольшое количество смеси налить в мерный стакан, взвесить и определить искомое значение по таблице плотности. Указанная таблица используется при вычислениях, так как плотность неразрывно связана с концентрацией.






























