Биологические функции белков
Строительная, или пластическая
Белки являются основой структурного материала всех клеточных мембран, так как образуют основу протоплазмы любой живой клетки. Наверняка вам известны такие белки, как коллаген, кератин и эластин. Именно они составляют основу соединительной ткани организма и обеспечивают ее прочность.
Транспортная
Эта функция заключается в присоединении химических элементов или биологически активных веществ, то есть гормонов, и в перемещении их к различным тканям и органам тела. Например, гемоглобин является переносчиком кислорода в крови, а также принимает участие в транспорте углекислого газа. Перенос насыщенных жирных кислот в крови по организму происходит при участии альбумина. Трансферрин переносит ионы железа, а особые белки участвуют в переносе ионов натрия и калия через мембрану клетки.
Регуляторная
Белки играют роль в регуляции и согласовании обмена веществ в различных клетках организма. Например, инсулин регулирует уровень глюкозы в крови, а также увеличивает образование жиров из углеводов.
Защитная
При попадании в организм чужеродного белка или микроорганизма образуются особые белки — антитела. Защитой организма от чрезмерной кровопотери является превращение белка фибриногена. Конечно, в этом процессе участвуют и другие белки, например тромбин, а также множество других факторов свертывания. Защиту нашего желудка от воздействия сильнокислой среды обеспечивает белок муцин, основу кожи составляет коллаген, а кератин является белком защитного волосяного покрова.
Двигательная
Двигательную функцию обеспечивают специальные сократительные белки, например актин и миозин, которые участвуют в сокращении скелетных мышц.
Сигнальная
В поверхность мембраны клетки встроены рецепторы (молекулы белков), которые в ответ на воздействие внешней среды способны изменять свою структуру, передавая команды в клетку.
Запасающая
Белки способны образовывать запасные отложения — правда, в организме животных белки, как правило, не запасаются. Но на каждое правило всегда найдется исключение — это альбумин, который содержится в яйцах, и казеин молока. Благодаря белкам в организме могут откладываться, например, ионы железа, которые впоследствии образуют комплекс с белком ферритином.
Энергетическая
Белки могут распадаться в клетке до составляющих, то есть до аминокислот. Часть этих аминокислот подвергается расщеплению, в ходе которого высвобождается энергия. При расщеплении 1 грамма белка выделяется 17,6 кДж, или 4,2 ккал, энергии. Но в этой роли белки используются крайне редко.
Каталитическая
Белки, которые называются ферментами, способны ускорять биохимические реакции, происходящие в клетке, — в этом заключается каталитическая функция белков.
Питательная, или резервная
Эту функцию выполняют резервные белки, которые являются источником питания для плода. Такими белками могут быть казеин — белок молока, овальбумины — белки яйца, проламины и глютелины — белки растений.
Функция антифриза
Антифризные белки способны понижать температуру замерзания раствора в клетках, чтобы предупредить замерзание в условиях низких температур.
Выберите идеального репетитора по химии
15 000+ проверенных преподавателей со средним рейтингом 4,8. Учтём ваш график и цель обучения
Выбрать!

Химические свойства белков
По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
Как и аминокислоты, белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце группу -NH2, а на другом конце – группу -СООН.
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
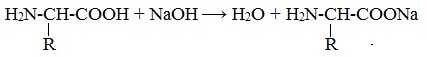
При действии же кислот он выступает в форме катиона:
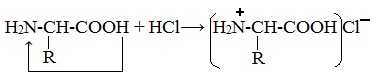
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
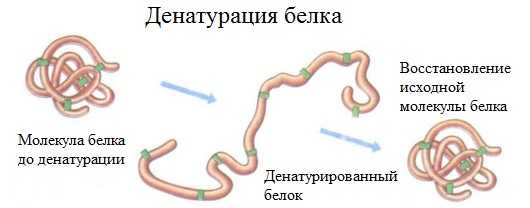
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Необратимая денатурация может быть вызвана при действии таких реагентов, как концентрированные кислоты и щелочи, спирты, в результате воздействия высокой температуры, радиации, при отравлении организма солями тяжелых металлов (Hg2+, Pb2+, Си2+).
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-70С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
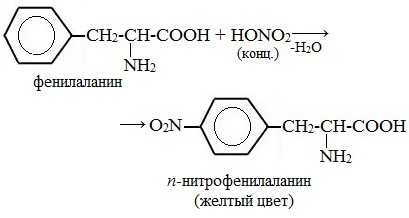
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.
![]()
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина:
Видеоопыт «Ксантопротеиновая реакция на белки»
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.
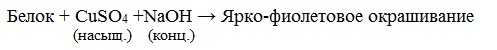
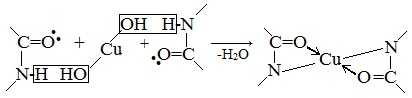
Причина появления окраски – образование комплексных соединений с координационным узлом:
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)
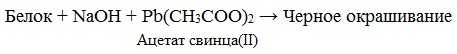
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Рубрики: Белки
Лабораторная работа №1
Лабораторная работа №1
ХИМИЯ ПРОСТЫХ БЕЛКОВ.
ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ И АМИНОКИСЛОТЫ
Белки представляют собой высокомолекулярные полимерные органические соединения, построенные из остатков различных α-аминокислот, соединенных ковалентной пептидной связью.
Присутствие белка в растворах можно обнаружить с помощью цветных реакций, обусловленных наличием в белке аминокислот, их специфических групп и пептидных связей. Существуют универсальные цветные реакции, т. е. на все белки (биуретовая и нингидриновая), и специфические, т. е. на определенные аминокислоты (ксантопротеиновая, Миллона, Фоля и др.).
На основании некоторых цветных реакций разработаны методы количественного определения белков и аминокислот, которые широко используются в биохимических лабораториях.
Цель: Ознакомиться с универсальными цветными реакциями на белки и специфическими реакциями на отдельные аминокислоты, содержащиеся в белковых растворах.
Работа 1. Биуретовая реакция на пептидную связь (Пиотровского)
Биуретовая реакция обусловлена наличием в белке пептидных связей, которые в щелочной среде образуют с сернокислой медью комплексы фиолетового цвета с красным или синим оттенком. Группа, образующая пептидную связь, в щелочной среде присутствует в своей таутомерной енольной форме:
При избытке щелочи происходит диссоциация ОН-группы, появляется отрицательный заряд, с помощью которого кислород взаимодействует с медью. Возникает солеобразная связь. Кроме того, медь образует дополнительные координационные связи с атомами азота, участвующими в пептидной связи, путем использования их электронных пар. Возникающий таким образом комплекс очень стабилен. Интенсивность окраски комплекса зависит от концентрации белка и количества медной соли в растворе.
Биуретовой реакцией обнаруживаются все без исключения белки, а также продукты их неполного гидролиза – пептоны и полипептиды. Для ди — и трипептидов биуретовая реакция ненадежна. Оттенок зависит от длины полипептидной цепочки. Пептоны при этой реакции дают розовое или красное окрашивание. Биуретовая реакция положительна и с веществами небелкового характера, имеющими в составе не менее двух – CO – NH2-групп, к ним относятся, например, оксамид – NH2 – CO – CO – NH2, биурет – N2H – CO – NH – CO – NH2.
Исследуемый материал: раствор яичного белка, раствор растительного белка, 1% раствор желатина.
Реактивы: 10% раствор NaOH, 1% раствор CuSO4.
Оборудование: пробирки, капельницы.
Ход работы. К 5 каплям водного раствора белка добавляют 5 капель 10% раствора NaOH и 2 капли 1% раствора CuSO4. Содержимое перемешивают. Оно приобретает сине-фиолетовый цвет. Нельзя добавлять избыток CuSO4, так как синий осадок маскирует характерное фиолетовое окрашивание биуретового комплекса.
Работа 2. Нингидриновая реакция на α-аминокислоты
Белки, полипептиды и свободные α-аминокислоты дают синее или фиолетовое окрашивание с нингидрином. При нагревании белка с водным раствором нингидрина аминокислоты окисляются и распадаются, образуя СО2, NH3 и соответствующий альдегид. Нингидрин, являясь сильным окислителем, вызывает окислительное дезаминирование α-аминокислоты, приводящее к образованию аммиака, двуокиси углерода, соответствующего альдегида и восстановленной формы нингидрина. Нингидрин восстанавливается и связывается со второй молекулой нингидрина посредством молекулы аммиака, образуя продукты конденсации, окрашенные в синий, фиолетовый, красный, а в случае пролина – в желтый цвет.
§ 3. Органические вещества. Аминокислоты. Олигопептиды

Задание рекомендуется выполнять в школе.
С помощью биуретовой реакции определим, в каких пищевых продуктах содержатся белки.
Для проведения реакции понадобятся раствор какой-либо щелочи (например, NaOH) и раствор медного купороса — сульфата меди (II). Вместо чистой щелочи можно использовать средство для удаления жировых загрязнений или прочистки канализационных труб (щелочи — основной компонент таких средств, но предварительно прочитайте состав) либо кальцинированную соду. Вместо медного купороса можно использовать бордосскую смесь. Это распространенное средство защиты растений от болезней, в упаковке содержатся два пакета: с медным купоросом и гашеной известью — Са(OH)2. На основе бордосской смеси можно получить оба раствора для проведения биуретовой реакции.
- Приготовьте небольшое количество растворов щелочи и медного купороса. Будьте осторожны при работе с реактивами, соблюдайте правила техники безопасности!
- Подготовьте образцы пищевых продуктов — раствор яичного белка или желатина, молоко, кефир, мясной или рыбный бульон (желательно процеженный), отвар каких-либо овощей или грибов, светлый сок (березовый, яблочный, лимонный), минеральную воду и т. п.
- К небольшому количеству исследуемого продукта добавьте немного раствора щелочи, а затем 1—2 мл раствора медного купороса. Если в испытуемом продукте есть белок, окраска раствора станет фиолетовой.
● Вспомните, какие пищевые продукты являются основными источниками белков для человека.
● В каких исследованных вами продуктах были обнаружены белки?
Белки как класс органических соединений
А теперь рассмотрим белки с точки зрения химии. В состав белков живых организмов входит только 20 типов аминокислот. Все они являются альфа-аминокислотами, а состав белка и порядок соединения аминокислот друг с другом определяется индивидуальным генетическим кодом.
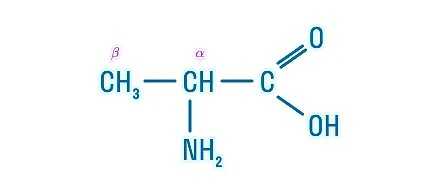
Перед нами пример альфа-аминокислоты, которая называется альфа-аминопропановой. В строении аминокислоты можно выделить две функциональные группы: карбоксильную (—СООН), которая отвечает за кислотные свойства, и аминогруппу (—NH2), которая, в свою очередь, отвечает за основные свойства.
Отсюда можно сделать вывод, что все аминокислоты являются амфотерными соединениями и способны реагировать друг с другом по разным функциональным группам с образованием пептидной связи:
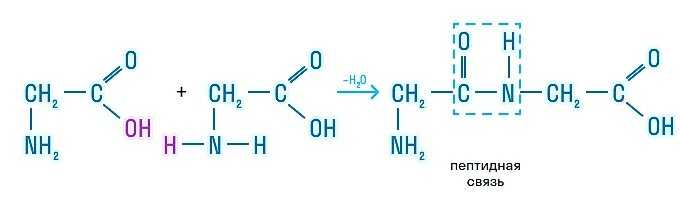
Химические свойства белков очень ограниченны. Давайте их рассмотрим.
Гидролиз
Все белки способны вступать в реакцию гидролиза. В общем виде данная реакция выглядит следующим образом:
Белок + nH2O = смесь из α-аминокислот.
Денатурация
Денатурация — это разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры.
Напомним виды структур белка:
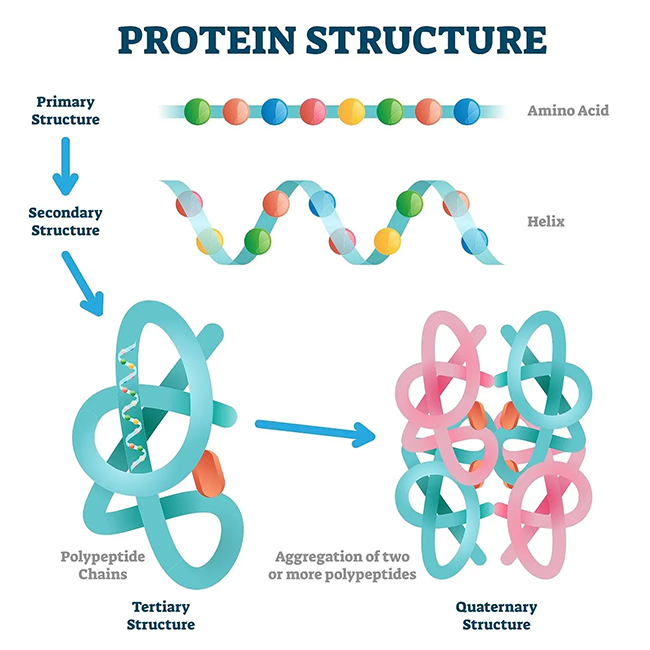
The image is a derivative of «Protein structure vector illustration» by VectorMine on Shutterstock.
Денатурация может быть обратимой, а может быть необратимой:
-
обратимая денатурация:
-
необратимая денатурация:
Как видно из условий, обратимость зависит от условий протекания реакций. Чем они жестче, тем меньше вероятность обратимости реакции.
Ксантопротеиновая реакция (качественная реакция на белок)
Растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
Раствор белка + HNO3 (конц) = желтое окрашивание.
Реакция Фоля (цистеиновая проба)
Эта реакция является качественной для аминокислот, содержащих серу:
Белок + (CH3COO)2Pb + NaOH = PbS + черное окрашивание.






























