Классификация
Самые распространенные виды — гальванические элементы и аккумуляторы. С ними знаком практически каждый. Но классификация таких приспособлений более широкая и предполагает еще и существование топливных элементов.
Гальванические элементы
Гальванический элемент получил свое название в честь ученого Гальвано, который и открыл чудесную возможность получения электрического тока посредством создания простой конструкции из электролита и электродов. Они считаются первыми прототипами современных устройств для получения электроэнергии благодаря химическим реакциям.
Обратите внимание! В настоящее время это приспособление имеет более компактный и безопасный для использования вид, это обычная батарейка. Особенность работы такого устройства заключается в том, что использование его одноразовое
После окончательного разложения электролита на вещества, повторно зарядить их для следующих реакций невозможно.
Электрические аккумуляторы
Электрический аккумулятор — это более универсальный вариант устройства, который можно заряжать несколько раз после потери заряда электролита. Такая особенность объясняется регенерацией веществ, которые образуют электролит.
Устройство аккумулятора
В данном случае зарядка производится от постороннего (внешнего) источника тока. Часто с такой потребностью в восстановлении реагента в аккумуляторах сталкиваются автомобилисты, производя зарядку аккумулятора.
Топливные элементы
Электрохимический топливный элемент является перспективным источником, который достаточно важен для создания комфортных и в некоторых ситуациях жизненно необходимых условий существования.
Тепловой химический источник
Особенность работы такого элемента заключается в следующем. К электродам каждый раз поступает определенная порция электролита, которая после разрядки выводится из конструкции. Например, резервный генератор тока благодаря такому принципу работы может производить электроэнергию в течение 10-15 лет.
Обратите внимание! После истечения срока эксплуатацию можно продлить, если восстановить питание
Советы по эксплуатации аккумуляторов
А теперь самые простые советы, которые помогут прослужить вашим аккумуляторам максимально долго.
- Берегите элементы питания от огня и воды – оба фактора чреваты выходом из строя.
- Чрезмерное охлаждение и нагревание, а также резкая смена температур тоже губительны.
- Применяйте соответствующий вашему аккумулятору тип зарядки, коих есть аж 4 штуки.
- Первый – это медленный заряд низким постоянным током. Происходит он в течение довольно длительного времени – до 18 часов. Такой метод подходит почти для всех аккумуляторов и является самым безопасным.
- Второй – быстрый заряд. Происходит в течение 3-5 часов при постоянном токе в 1/3С.
- Третий – дельта V заряд (ускоренный) — начальные ток равен номинальной емкости элемента, напряжение постоянно меняется. Заряд происходит за 1-1,5 часа. При этом возможен перегрев и разрушение устройства.
- Четвертый тип называется реверсивным. При нем длинные импульсы заряда сменяются короткими импульсами разряда. Такой метод наиболее полезен для аккумуляторов с «эффектом памяти».
На этом закончим наш обзор. Мы разобрали электрохимические источники тока и получили простейшее представление об их работе. Если вы хотите изучить тему глубже, то уже не обойтись без учебных пособий и видео, которые можно легко отыскать в сети.
«Постоянный электрический ток. Действие электрического тока»
Электрический ток — это упорядоченное движение заряженных частиц. Для того чтобы в проводнике существовал электрический ток, необходимы два условия: 1) наличие свободных заряженных частиц, 2) электрическое поле, которое создаёт их направленное движение. Проходя по цепи, происходит действие электрического тока (тепловое, магнитное, химическое).
При существовании тока в разных средах: в металлах, жидкостях, газах — электрический заряд переносится разными частицами. В металлах этими частицами являются электроны, в жидкостях заряд переносится ионами, в газах — электронами, положительными и отрицательными ионами.
Дистиллированная вода не проводит электрический ток, поскольку она не содержит свободных зарядов. Если в воду добавить поваренную соль или медный купорос, то в ней появятся свободные заряды, и она станет проводником электрического тока.
Газы в обычных условиях тоже не проводят электрический ток, так как в них нет свободных зарядов. Однако если в воздушный промежуток между двумя металлическими пластинами, соединёнными с источником тока, внести зажжённую спичку или спиртовку, то газ станет проводником и гальванометр зафиксирует протекание тока по цепи.
Постоянный электрический ток
Постоянный электрический ток — это электрический ток, который с течением времени не изменяется по величине и направлению. Постоянный ток является разновидностью однонаправленного тока (англ. direct current), т.е. тока, не изменяющий своего направления. Часто можно встретить сокращения DC от первых букв англ. слов, или символом по ГОСТ 2.721-74.
На рисунке красным цветом изображён график постоянного тока. По горизонтальной оси отложен масштаб времени t, а по вертикальной — масштаб тока I или электрического напряжения U. Как видно, график постоянного тока представляет собой прямую линию, параллельную горизонтальной оси (оси времени).
При постоянном токе через каждое поперечное сечение проводника в единицу времени протекает одинаковое количество электричества (электрических зарядов). Постоянный электрический ток — это постоянное направленное движение заряженных частиц в электрическом поле.
Источник тока
Направленное движение зарядов обеспечивается электрическим полем. Электрическое поле в проводниках создаётся и поддерживается источником тока. В источнике тока совершается работа по разделению положительно и отрицательно заряженных частиц. Эти частицы накапливаются на полюсах источника тока. Один полюс источника заряжается положительно, другой — отрицательно. Между полюсами источника образуется электрическое поле, под действием которого заряженные частицы начинают двигаться упорядоченно.
В источнике тока совершается работа при разделении заряженных частиц. При этом различные виды энергии превращаются в электрическую энергию. В электрофорной машине в электрическую энергию превращается механическая энергия, в гальваническом элементе — химическая.
Действие электрического тока
Электрический ток, проходя по цепи, производит различные действия. Тепловое действие электрического тока заключается в том, что при его прохождении по проводнику в нём выделяется некоторое количество теплоты. Пример применения теплового действия тока — электронагревательные элементы чайников, электроплит, утюгов и пр. В ряде случаев температура проводника нагревается настолько сильно, что можно наблюдать его свечение. Это происходит в электрических лампочках накаливания.
Магнитное действие электрического тока проявляется в том, что вокруг проводника с током возникает магнитное поле, которое, действуя на магнитную стрелку, расположенную рядом с проводником, заставляет её поворачиваться. Благодаря магнитному действию тока можно превратить железный гвоздь в электромагнит, намотав на него провод, соединённый с источником тока. При пропускании по проводу электрического тока гвоздь будет притягивать железные предметы.
Химическое действие электрического тока проявляется в том, что при его прохождении в жидкости на электроде выделяется вещество. Если в стакан с раствором медного купороса поместить угольные электроды и присоединить их к источнику тока, то, вынув через некоторое время эти электроды из раствора, можно обнаружить на электроде, присоединённом к отрицательному полюсу источника (на катоде), слой чистой меди.
Некоторые источники утверждают, что существует также механическое действие (например, рамка, по которой течет ток, поворачивается, если её поместить между полюсами магнитов) и световое (светодиоды).
Конспект по по физике в 8 классе: «Постоянный электрический ток. Действие электрического тока».
Следующая тема: «Сила тока. Напряжение»
История химических источников тока[править | править код]
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в году. Это был элемент Вольта — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, соединенных проволкой. Затем учёный собрал батарею из этих элементов, которая в последствии была названа Вольтовым столбом. Это изобретение в последствии использовали другие учёные в своих исследованиях. Так, например, в году русский академик В. В. Петров сконструировал Вольтов столб из 2100 элементов для получения электрической дуги. В году английский химик Джон Дэниель усовершенствовал элемент Вольта, поместив цинковый и медный в раствор серной кислоты. Эта конструкция стала называтся «элементом Даниэля». В году французкий физик Гастон Плантэ изобрёл свинцово-кислотный аккумулятор. Этот тип элемента и по сей день используется в автомобильных аккумуляторах. В году французский химик Ж. Лекланше предложил свой гальванический элемент (элемент Лекланше), состоявший из цинкового стаканчика, заполненного водным раствором хлористого аммония или другой хлористой соли, в который был помещён агломерат из оксида марганца(IV) MnO2 с угольным токоотводом. Модификация этой конструкции используется до сих пор в солевых батарейках для различных бытовых устройств. В году в Нью-Йорке Конрад Губерт, иммигрант из России, создаёт первый карманный электрический фонарик. А уже в году компания National Carbon приступает к массовому производству первых в мире сухих элементов Лекланше «Columbia».
Вторичный химический источник — ток
Вторичные химические источники тока допускают многократное их использование — аккумуляторы. Анод аккумулятора при разрядке служит катодом при зарядке. Наиболее распространены свинцовый ( кислотный) и железо-никелевый ( щелочной) аккумуляторы.
Вторичные химические источники тока, действие которых основано на использовании обратимых электрохимических систем. Под обратимыми электрохимическими системами понимают такие, в которых вещества, образовавшиеся в процессе разряда, могут быть превращены в первоначальные активные вещества.
Вторичные химические источники тока допускают многократное их использование — это аккумуляторы. Анод аккумулятора при разрядке служит катодом при зарядке.
Распространяется на первичные и вторичные химические источники тока. Устанавливает требования безопасности к конструкции источников тока.
Противоэлемент — это вторичный химический источник тока, практически не имеющий полезной емкости и используемый для встречного включения в цепь аккумуляторной батареи с целью регулирования ее напряжения.
Настоящий стандарт распространяется на первичные и вторичные химические источники тока.
Стартерные свинцовые аккумуляторные батареи являются вторичными химическими источниками тока. Заложенные в них активные вещества используются многократно.
Свинцовые аккумуляторы пользуются наибольшим спросом среди вторичных химических источников тока. Многообразие их электрических и эксплуатационных параметров в зависимости от назначения обеспечивается прежде всего различием технологии и конструкции электродных пластин. Наибольшее распространение получили стартерные аккумуляторы с пастиро-ванными пластинами, которые изучаются в предлагаемой лабораторной работе.
Группу щелочных аккумуляторов с окисно-никелевым электродом составляют вторичные химические источники тока трех систем: никель-железный ( сокращенно HJK), никель-кадмиевый ( сокращенно НК) и никель-цинковый. Последний обладает рядом существенных недостатков и прежде всего — малым сроком службы ( меньше 200 циклов) и большим саморазрядом ( до 90 % за месяц), поэтому в настоящее время его не применяют. Однако высокая удельная энергия никель-цинкового аккумулятора, достигающая 60 Вт — ч / кг, дает основания считать его перспективным в будущем.
Кислотные свинцовые аккумуляторы являются наиболее распространенными среди вторичных химических источников тока. Разнообразие их электрических и эксплуатационных параметров в зависимости от назначения обеспечивается прежде всего различием технологии и конструкции электродных пластин.
Из сказанного следует, что один и тот же электрод вторичного химического источника тока может являться и анодом и катодом в зависимости от того, подвергается ли источник заряду или разряду. Поэтому, чтобы правильно применять при рассмотрении вторичных ХИТ термины анод и катод, необходимо знать природу процессов, протекающих на данном электроде при заряде и разряде источника тока, учитывая при этом, что процессу окисления отвечает термин анод, а процессу восстановления — термин катод.
В отличие от простых ( первичных) гальванических элементов ( см. 8.4) аккумуляторы являются вторичными химическими источниками тока.
Пропускание электрического тока через электролитическую ячейку вызывает в ней определенные изменения. Если протекающие электрохимические поцессы обратимы, то можно вновь получить электрическую работу за счет накопленной химической энергии. Такие обратимые элементы называются аккумуляторами, или вторичными химическими источниками тока.
Пропускание электрического тока через электролитическую ячейку вызывает в ней определенные изменения. Если протекающие электрохимические процессы обратимы, то можно вновь получить электрическую работу за счет накопленной химической энергии. Такие обратимые элементы называются аккумуляторами, или вторичными химическими источниками тока.
Отечественной промышленностью выпускается обширный ассортимент малогабаритных источников питания, которые могут использоваться в переносной аппаратуре. Герметические дисковые кадмиево-никелевые аккумуляторы и батареи типа Д-006; Д-01; Д-02; 7Д — 0.1, применяющиеся в приборах широкого потребления, имеют небольшие габариты и вес, однако ограниченный температурный диапазон ( от 5 до 35 С), при котором техническими условиями гарантируется их работоспособность, недостаточен для полевой аппаратуры. Серебряно-цинковые аккумуляторы по своим характеристикам превосходят все вторичные химические источники тока.
Химические источники
Получение положительных и отрицательно заряженных частиц в химических источниках постоянного тока осуществляется за счет химических реакций. По классификации химических источников они делятся на 3 группы:
- гальванические элементы, являющиеся первичными источниками ;
- электрические аккумуляторные батареи (АКБ), или вторичные ХИТ;
*ХИТ – химические источники тока.
Гальванические элементы используют принцип действия, основанный на взаимодействии двух металлов через среду электролита. Вид и характеристики ХИТ зависят от выбранной пары металлов и состава электролита. Два металлических электрода источника тока по аналогии с прибором односторонней проводимости получили название анода (“+”) и катода (“-“).
Материалом для изготовления анода могут служить свинец, цинк, кадмий и другие. Катод изготавливают из оксида свинца, графита, оксида марганца, гидрооксида никеля. По составу электролита гальванические элементы разделяются на 3 вида:
- солевые или “сухие”;
- щелочные;
- литиевые.
В элементах первых двух видов графито-марганцевый стержень (катод) помещен по оси цинкового цилиндрического стаканчика (анода). Свободное пространство между ними заполнено пастой на основе хлорида аммония (солевые) или гидрооксида калия (щелочные).

В литиевых элементах цинковый анод заменен щелочным литием, что привело к значительному увеличению продолжительности работы. Материал катода в них определяет выходное напряжение батарейки (1,5-3,7) В. Первичные ХИТ являются источниками одноразового действия. Его реагенты, расходующиеся в процессе работы, не подлежат восстановлению.
Аккумуляторы представляют собой устройства, в которых производится преобразование электрической энергии внешнего источника тока в химическую энергию при заряде и ее накопление. В процессе работы (разряд) происходит обратное преобразование – химическая энергия служит источником постоянного электрического тока.
К основным видам аккумуляторов относятся:
- свинцово-кислотные;
- никель-кадмиевые щелочные;
- литий-ионные.
Для создания химических процессов набор пластин помещен в раствор электролита. В АКБ, созданных по современным технологиям, раствор представляет собой не жидкость, а гелиевый состав (GEL) или сотовые сепараторы, пропитанные электролитом и помещенные между свинцовыми пластинами (AGM).

Свинцово-кислотные и никель-кадмиевые щелочные аккумуляторы для работы в качестве источников постоянного тока для запуска двигателей автомобилей собирают из набора отдельных аккумуляторных элементов (“банок”). Каждая “банка” обеспечивает на своих клеммах напряжение 2,1 В. Соединенные последовательно 6 элементов и помещенные в ударопрочный корпус, имеют на выходных клеммах аккумулятора необходимые для запуска двигателя 12 В.
В литий-ионных аккумуляторах носителями электрического тока служат ионы лития. Они образуются на катоде, изготовленному из соли лития. Анод может быть изготовлен из графита или оксидов кобальта. Напряжение постоянного тока на выходе аккумулятора может варьироваться в пределах (3,0-4,2) В в зависимости от используемых материалов. Эти аккумуляторы имеют низкое значение тока саморазряда и допускают большое количество циклов заряд/разряд. Благодаря этому все современные гаджеты используют аккумуляторы этого вида.
Где применяются
Кажется, что вырабатываемый ток в результате химической энергии имеет минимальные показатели и может применяться только для изготовления обычных батареек в плеер или часы. Но это не так. Электроэнергия, полученная таким образом, используется в таких сферах:
Благодаря своей конструкции и принципу работы подобные устройства являются универсальными и могут применяться во многих сферах и отраслях.
Обратите внимание! Самой популярной в настоящее время является химическая батарея, которая используется в быту и производствах, подпитывая разнообразные приборы и устройства. Также в повседневной жизни используются аккумуляторы для электроники и автомобилей
Электроэнергия — это жизненно необходимый ресурс для современного человечества. Получить электричество можно благодаря определенным источникам тока, но самыми популярными и удобными являются именно химические. Дополнительно они считаются весьма безопасными в экологическом плане для использования, если правильно их утилизировать.
-
Оскар уайльд творчество кратко
-
Формальное исполнение алгоритма кратко
-
Состав атомных ядер изотопы кратко
-
Новая структура власти в 1993 году кратко
- Расскажите о структуре объектового звена рсчс общеобразовательного учебного заведения кратко
Принцип действия химического источника тока
Определение 1
Химический источник тока — это источник электродвижущей силы, в котором энергия химических реакций, протекающих в нем, превращается в электроэнергию.
Основу любого химического источника тока составляют два электрода (отрицательно заряженный анод, который содержит восстановитель, и положительно заряженный катод, который содержит окислитель), которые контактируют с электролитом. Между анодом и катодом устанавливается разность потенциалов, которая соответствует свободной энергии окислительно-восстановительной реакции. Действие химического источника тока основано на протекании пространственно-разделенных процессов: на отрицательно заряженном аноде восстановитель подвергается окислению, в результате чего образованные свободные электроны переходят по внешней замкнутой цепи к положительно заряженному катоду, тем самым создавая разрядный электрический ток. В качестве восстановителя в химических источниках тока используется кадмий, цинк, свинец и т.п. Функцию электролита в химическом источнике тока могут выполнять растворы солей, кислот и щелочей. В качестве окислителя применяются оксиды марганца и свинца, гидроксид никеля и т.п. Химические источники тока делятся на:
- Электрические аккумуляторы, представляющие собой перезаряжаемые гальванические элементы.
- Гальванические элементы, представляющие собой химические источники тока, которые невозможно перезарядить.
- Тепловые элементы, представляющие собой устройства, в которые вещества для осуществления электрохимической реакции подаются извне, а ее продукты удаляются, что способствует непрерывной их работе (при условии подачи реагентов).
Литиевая батарейка
Литий-марганцевая диоксид батарейка -это относительно недавняя разработка, использующая преимущества высокого электродного потенциала и плотности энергии металлического лития. Она предлагает значительно большую плотность энергии и емкость, чем “щелочная” и угольная, при относительно небольшом увеличении стоимости.
Литий находится в форме очень тонкой фольги и запрессован внутри банки из нержавеющей стали, чтобы сформировать отрицательный электрод.
Положительный электрод — диоксид марганца, смешанный с углеродом для улучшения его проводимости, а электролит-перхлорат лития растворен в пропиленкарбонате.
Номинальное напряжение на клеммах литиевого элемента составляет 3,0 в, что в два раза больше, чем у “щелочных” и других гальванических элементов. Он также имеет очень низкую скорость саморазряда, что дает ему очень длительный срок хранения. Внутреннее сопротивление также довольно низкое и остается таким в течение всего срока службы.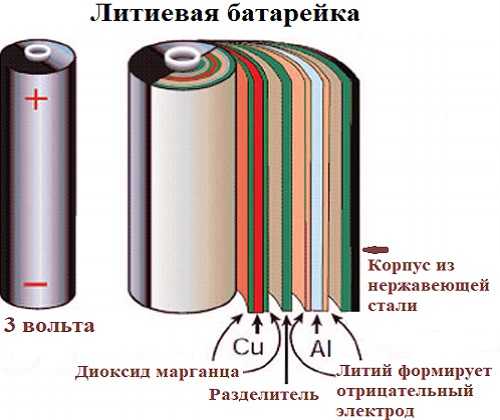
Литиевая батарея хорошо работает при низких температурах, даже ниже -60 °C, и передовые разработки используют их в спутниках связи, космических аппаратах, военных и медицинских приложениях. Медицинские приложения, требующие длительного срока службы критически важных устройств, таких как искусственные кардиостимуляторы и другие имплантируемые электронные медицинские устройства, используют специализированные литий-ионные батареи, которые могут работать в течение многих лет.
Литиевые гальванические элементы батарейки подходят для менее важных применений для работы с игрушками, часами и камерами. Хотя литиевые батареи стоят дороже, они обеспечивают более длительный срок службы, чем «щелочные» батареи, и сводят к минимуму их замену.
На практике, однако, напряжение на клеммах уменьшается по мере уменьшения заряда. Именно по этой причине, в отличие от вторичных батарей, первичные, как правило, не получают спецификации емкости ни в ампер-часах, ни в миллиампер-часах от большинства производителей вместо этого обычно задается только максимальный ток разряда.
Литиевые гальванические элементы обладают значительно большей плотностью энергии и емкостью, чем “щелочные” и другие первичные батареи; они обеспечивают более высокое (примерно в два раза) напряжение на клеммах по сравнению с другими первичными элементами, и напряжение на клеммах остается почти постоянным в течение всего срока службы.
Аккумуляторы[править | править код]
- Смотри также Категория:Аккумуляторы.
| Тип | Анод | Электролит | Катод | Э.Д.С, В |
|---|---|---|---|---|
| Лантан-фторидный аккумулятор | La | |||
| Литий-ионный аккумулятор | Li | |||
| Литий-полимерный аккумулятор | Li | |||
| Марганцево-оловянный элемент | Sn | |||
| Никель-цинковый аккумулятор | Zn | |||
| Никель-кадмиевый аккумулятор | Cd | |||
| Никель-металл-гидридный аккумулятор | ||||
| Свинцово-кислотный аккумулятор | PbО2 |
H2SO4 | Pb | |
| Свинцово-оловянный аккумулятор | PbО2 |
H2SO4 | Sn | |
| Серебряно-цинковый аккумулятор | AgO | KOH | Zn | |
| Серебряно-кадмиевый аккумулятор | AgO | KOH | Cd | |
| железо-никелевый аккумулятор | NaOH | Fe | ||
| железо-воздушный аккумулятор | KOH | Fe | ||
| цинк-воздушный аккумулятор | KOH | Zn | ||
| цинк-хлорный аккумулятор | Cl2 | Zn | ||
| натрий-серный аккумулятор | S | Na | ||
| литий-хлорный аккумулятор | Cl2 |
Li | ||
| свинцово-водородный аккумулятор | PbО2 |
H2SO4 | H2 | |
| Цинк-бромный аккумулятор | Br2 | Zn | ||
| Натрий-Никель-Хлоридный аккумулятор | Na | |||
| Литий-железо-сульфидный аккумулятор | Li | |||
| Литий-фторный аккумулятор | F2 | Li |
Гальванические элементы[править | править код]
- Смотри также Категория:Гальванические элементы.
| Тип | Анод | Электролит | Катод | Э.Д.С,В | Траб °С |
|---|---|---|---|---|---|
| Марганцево-цинковый элемент | MnO2 | KOH | Zn | 1.51 | |
| Марганцево-оловянный элемент | MnO2 | KOH | Sn | 1.65 | |
| Марганцево-магниевый элемент | MnO2 | MgBr | Mg | 2.00 | |
| Свинцово-цинковый элемент | PbO2 | H2SO4 | Zn | 2.55 | |
| Свинцово-кадмиевый элемент | PbO2 | H2SO4 | Cd | 2.42 | |
| Свинцово-хлорный элемент | PbO2 | HClO4 | Pb | 1.92 | |
| Ртутно-цинковый элемент | HgO | KOH | Zn | 1.36 | |
| Ртутно-кадмиевый элемент | HgO | KOH | Cd | 1.92 | |
| Окисно-ртутно-оловянный элемент | HgO | KOH | Sn | 1.30 | |
| Хром-цинковый элемент | C•K2Cr2O7 | H2SO4 | Zn | 1.8—1.9 | |
| Свинцово-плавиковый элемент | PbO2 | Pb | |||
| Медно-окисный гальванический элемент | CuO | NaOH | Zn | 0.9 | |
| Висмутисто-магниевый элемент | Bi2O3 | Mg | |||
| Ртутно-висмутисто-индиевый элемент | HgO | In•Bi | |||
| Литий-марганцевый элемент | MnO2 | LiClO4 | Li | 3,5 | |
| Литий-хромсеребряный элемент | AgCrO4 | Li | |||
| Литий-висмутатный элемент | PbBiO3 | Li | |||
| Литий-окисномедный элемент | CuO | Li | |||
| Литий-йодсвинцовый элемент | PbJ | Li | |||
| Литий-йодный элемент | J | Li | |||
| Литий-тионилхлоридный элемент | SOCl2 | Li | |||
| Литий-оксидванадиевый элемент | VO | Li | |||
| Литий-фторомедный элемент | CuF2 | Li | |||
| Литий-двуокисносерный элемент | SO2 | Li | |||
| Диоксисульфатно-ртутный элемент | Zn | ||||
| Серно-магниевый элемент | S•C | Mg | |||
| Хлористосвинцово-магниевый элемент | PbCl2 | Mg | |||
| Хлорсеребряно-магниевый элемент | AgCl | Mg | |||
| Хлористомедно-магниевый элемент | CuCl | Mg | |||
| Йодатно-цинковый элемент | Zn | ||||
| Магний-перхлоратный элемент | MgClO4 | Mg | |||
| Магний-м-ДНБ элемент | Mg | ||||
| Цинк-хлоросеребряный элемент | AgCl | Zn | |||
| Хлор-серебряный элемент | AgCl | Ag | |||
| Бром-серебряный элемент | AgBr | Ag | |||
| Йод-серебряный элемент | AgJ | Ag | |||
| Магний-ванадиевый элемент | V2O5 | Mg | |||
| Кальций-хроматный элемент | CaCrO4 | Ca |
Классификация гальванических элементов и их подбор
Основные понятия о релейной защите
Генераторы электрического тока получающегося во время химической реакции разделяются по:
- Размерам;
- Конструктивным особенностям;
- Способу и реагенту, за счёт которого, и получается электроэнергия.
Все элементы вырабатывающее ток во время химической реакции делятся на:
- Заряжаемые, которые в процессе эксплуатации могут неоднократно заряжаться от источника постоянного тока, они называются аккумуляторами;
- Не заряжаемые, то есть источники одноразового использования которые после завершения химической реакции просто приходят в негодность и должны быть утилизированы. Попросту это гальванический элемент или батарейка.
Для того чтобы подобрать источник электроэнергии, основанный на химической реакции, нужно понимать его характеристики, к которым относятся:
- Напряжение между анодом и катодом при разомкнутой цепи. Этот показатель чаще всего зависит от выбранной электрохимической системы, а также концентрации и вылечены всех составляющих;
- Мощность источника;
- Показатель силы тока;
- Емкость;
- Электротехнические показатели, то есть количество циклов заряда и разряда;
- Диапазон рабочих температур;
- Срок хранения между тем временем как элемент был создан и до начала его эксплуатации;
- Полный срок службы;
- Прочность, то есть защита корпуса от различных механических повреждений и влияний, а также вибраций;
- Положение работы, некоторые из них работают только в горизонтальных положениях;
- Надёжность;
- Простота в эксплуатации и обслуживании. В идеале отсутствие необходимости малейшего вмешательства в работу в течение всего срока эксплуатации.
При выборе нужной батареи или аккумулятора обязательно нужно учесть его электрические номиналы такие как напряжение и ток, а также ёмкость. Именно она является ключевой для сохранения работоспособности, подключаемого к источнику прибора.
Химические источники тока
вырабатывают электрич. ток за счёт энергии окислительно-восстановит. реакций. В соответствии с эксплуатац. схемой и способностью отдавать энергию в электрич. сеть химич. И. т. подразделяются на первичные, вторичные и топливные элементы; отд. группу составляют резервные источники тока. Первичные И. т. (гальванич. элементы и батареи) предполагают, как правило, однократное использование энергии химич. реагентов, после израсходования которых (после разряда) становятся неработоспособными. В таких И. т. положительные и отрицательные электроды, разделённые электролитом, электрически связаны (гальванич. связь) в течение всего срока службы И. т. Вторичные И. т. (электрические аккумуляторы и аккумуляторные батареи) допускают многократное использование энергии составляющих химич. реагентов; после разряда их можно вновь зарядить, создавая ток от внешнего источника в обратном направлении. Электроды и электролит весь срок службы аккумуляторов находятся в электрич. контакте друг с другом. Для увеличения ресурса аккумуляторов разработаны способы сухозаряженного хранения аккумуляторов; такие аккумуляторы перед включением предварительно заливают электролитом. Топливные элементы (электрохимич. генераторы) способны длительное время непрерывно генерировать электрич. ток благодаря постоянному подводу к электродам новых порций реагентов извне и отводу продуктов реакции. Наиболее перспективны генераторы, непосредственно преобразующие энергию природного топлива в электрическую.
Резервные И. т. допускают только однократное использование энергии химич. реагентов, но, в отличие от гальванич. элементов, реагенты и электролит в них приводятся в соприкосновение (активируются) непосредственно перед началом разряда. Электролит в таких И. т. хранится в отд. сосуде и заливается непосредственно перед включением нагрузки или находится в твёрдом состоянии, а перед включением нагрузки расплавляется. Резервные И. т. применяются гл. обр. для питания электрич. аппаратуры, которая длительное время находится в резервном (неработающем) состоянии; срок хранения составляет до 15 лет и более. См. также Химические источники тока.
Принцип действия химических источников тока[править | править код]
Основу химических источников тока составляют два электрода (анод, содержащий окислитель и катод, содержащий восстановитель), контактирующих с электролитом. Между электродами устанавливается разность потенциалов — электродвижущая сила, соответствующая свободной энергии окислительно-восстановительной реакции. Действие химических источников тока основано на протекании при замкнутой внешней цепи пространственно разделённых процессов: на катоде восстановитель окисляется, образующиеся свободные электроны переходят, создавая разрядный ток, по внешней цепи к аноду, где они участвуют в реакции восстановления окислителя.
В современных химических источниках тока используются:
- в качестве восстановителя (на катоде) — свинец Pb, кадмий Cd, цинк Zn и другие металлы;
- в качестве окислителя (на аноде) — оксид свинца(IV) PbO2, гидрооксид никеля NiOOH, оксид марганца(IV) MnO2 и другие;
- в качестве электролита — растворы щелочей, кислот или солей.






























