Содержание
В ключевое отличие между методом Мора Фольхарда и Фаянса заключается в том, что Метод Мора относится к реакции между ионом серебра и галогенид-ионом в присутствии хроматного индикатора, но метод Фольгарда относится к реакции между избыточными ионами серебра и галогенид-ионами. Между тем, метод Фаянса относится к реакции адсорбции между галогенидом серебра и флуоресцеином..
Метод Мора, метод Фольхарда и метод Фаянса являются важными аналитическими методами, которые можно использовать в качестве реакций осаждения для определения концентрации галогенида в данном образце. Эти методы названы в честь ученых, разработавших метод.
1. Обзор и основные отличия 2. Что такое метод Мора 3. Что такое метод Фольгарда 4. Что такое метод фаянса 5. Сравнение бок о бок — метод Мора Фольхарда и Фаянса в табличной форме 6. Резюме
Количественное определение. Содержание хлоридов и бромидов определяют методом Мора
Содержание хлоридов и бромидов определяют методом Мора. Раствор, приготовленный из точной навески препарата, титруют в нейтральной или слабощелочной среде 0,1 моль/л раствором AgNO3 (индикатор — K2СrO4). В точке эквивалентности образуется осадок хромата серебра Ag2Q-O4 оранжево-красного цвета:
Для проведения количественного определения хлоридов и бромидов используют обратное титрование раствором серебра нитрата в азотной кислоте. Избыток титранта определяют по реакции с раствором аммония тиоцианата. Индикатор — железоаммонийные квасцы.
Йодиды нельзя определять методом Мора, так как при титровании образуются коллоидные растворы. Частицы дисперсной фазы (AgI) адсорбируют йодид-ионы I — . Это затрудняет установление эквивалентной точки.
В этом случае применяют адсорбционные индикаторы — динатриевые соли флуоресцеина или эозина. По мере титрования йодида раствором AgNO3 образуется коллоидный осадок AgI, коллоидные частицы которого обладают большой адсорбционной способностью. В точке эвивалентности их заряд меняется на положительный, и они адсорбируют на своей поверхности отрицательно заряженные анионы индикаторов. При этом в эквивалентной точке происходит изменение цвета поверхности осадка (AgI) с желтого на розовый.
Йодиды количественно определяют прямым титрованием раствором калия йодата в присутствии хлороводородной кислоты с добавлением нескольких капель хлороформа. Сначала раствор темнеет вследствие образования йода:
Затем по мере добавления титранта окраска раствора становится бледно-желтой:
Выделяющийся йод экстрагируется в хлороформ, поэтому титрование проводят при энергичном встряхивании до обесцвечивания хлороформного слоя.
Для количественного определения натрия фторида применяют метод потенциометрического титрования раствором нитрата лантана:
В качестве рабочего электрода используют фторселективный электрод, потенциал которого зависит от содержания фторидионов в растворе.
1 мл 0,1 моль/л La(NO3)3 эквивалентен 12,60 мг NaF.
Контрольные вопросы и задания
• Какова биологическая роль галогенов? Назовите пути их поступления в организм человека.
• Перечислите препараты йода и укажите их применение в медицине. В чем заключается особенность приготовления и хранения спиртовых растворов йода?
• Какие требования предъявляют к качеству препаратов йода? Назовите источники примесей в йодсодержащих ЛВ.
• Приведите примеры реакций подлинности кислоты хлороводородной.
• Объясните происхождение примесей в препаратах HCl в зависимости от способа получения.
• Приведите примеры реакций количественного определения HCl. Рассчитайте титр соответствия.
• Перечислите ЛВ-галогениды щелочных металлов. Каков способ применения этих ЛС?
• Напишите качественные реакции на катионы металлов препаратов галогенидов.
• Напишите качественные реакции на анионы-галогениды.
• Перечислите основные методы количественного определения ЛВ-галогенидов щелочных металлов.
• В чем отличие количественного определения йодидов от других галогенидов?
ЛЕКАРСТВЕННЫЕ СРЕДСТВА ЭЛЕМЕНТОВ VIA ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
К р-элементам VI группы — халькогенам — относят кислород, серу, селен, теллур и полоний. Соединения теллура и полония в фармации не применяются.
Свойства ЛС-производных элементов VIA группы периодической системы описаны в табл. 8.3.
При полном восстановлении молекула кислорода превращается в воду:
Содержание:
В Метод Мора Это вариант аргентометрии, которая, в свою очередь, является одной из многих областей волюметрии, используемых для определения содержания хлорид-ионов в пробах воды. Концентрация Cl – указывает на качество воды, влияющее на ее органолептические свойства, такие как вкус и запах.
Этот метод, изобретенный в 1856 году немецким химиком Карлом Фридрихом Мором (106-1879), продолжает действовать благодаря своей простоте и практичности. Однако одним из его основных недостатков является то, что он основан на использовании хромата калия, K2CrO4, соль, вредная для здоровья, когда загрязняет воду.
Концентрация ионов Cl определяется объемным методом. – через степени или оценки. В них конечная точка, указывающая на то, что точка эквивалентности была достигнута. Это не изменение цвета, как мы видим в кислотно-щелочном индикаторе; но образование красноватого осадка Ag2CrO4 (верхнее изображение).
Когда появляется этот красноватый или кирпичный цвет, титрование завершается и после серии вычислений определяется концентрация хлоридов, присутствующих в пробе воды.
Ссылки
- Дэй Р. и Андервуд А. (1965). Количественная аналитическая химия. (пятое изд.). ПИРСОН Прентис Холл, стр. 277.
- Анхелес Мендес. (22 февраля 2012 г.). Метод Мора. Получено с: quimica.laguia2000.com
- ChemBuddy. (2009). Метод Мора. Получено с: titrations.info
- Даниэле Навильо. (н.д.). Метод Мора. Federica Web Learning. Получено с: federica.unina.it
- Хонг, Т. К., Ким, М. Х., и Чаэ, М. З. (2010). Определение хлористости воды без использования индикатора хромата. Международный журнал аналитической химии, 2010, 602939. doi: 10.1155 / 2010/602939
Какая средняя толщина полового члена? Наука отвечает
Этические дилеммы: что это такое, виды и 4 примера, которые заставят задуматься
Получение формулы интеграла Мора
Рассмотрим балку, изображенную на рис. 15.6, а. Обозначим и , соответственно, изгибающий момент и поперечную силу, возникающие в заданной балке от действующей на нее группы нагрузок P. Пусть требуется определить прогиб балки () в точке K.
Введем в рассмотрение вспомогательную балку (та же балка, но нагруженная только единичной силой либо единичным изгибающим моментом). Нагрузим ее только одной силой (рис. 15.6, б). Единичную силу приложим в точке K, где нужно определить прогиб.
Внутренние усилия, возникающие во вспомогательной балке, обозначим и .
Воспользуемся теперь теоремой о взаимности работ, согласно которой работа внешних сил, приложенных к вспомогательной балке на соответствующих перемещениях заданной балки равна взятой с обратным знаком работе внутренних сил заданной балки на соответствующих перемещениях вспомогательной балки. Тогда 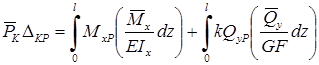 .
.
При определении перемещений в балке, как правило, можно пренебрегать влиянием поперечной силы, ( не учитывать второе слагаемое).
Тогда, учитывая, что , окончательно получим формулу интеграла Мора: .
Определение перемещений по формуле интеграла Мора часто называют определением перемещений методом Мора, а саму формулу – интегралом Мора.
Входящие в интеграл Мора изгибающие моменты берутся в произвольном поперечном сечении и поэтому представляют собой аналитические функции от текущей координаты z.
Заметим, что если мы хотим в этой же точке K определить угол поворота поперечного сечения (), то нам необходимо к вспомогательной балке приложить не единичную силу, а единичный момент (рис. 15.6, в).
Определение перемещений от осадки опор в балках и рамах
Работа единичной силы (сил второго состояния) на перемещениях,
вызванных осадкой опор (силами первого состояния), равна работе сил второго
состояния (реакции связи) на перемещениях (осадка опор) первого состояния, т.
е. перемещение в i-ом направлении
вычисляется как сумма произведений реакций j
связи (Rj(1)) от единичного i-го загружения на величину перемещения j-ой связи (осадки опоры).
Пример 17.
Рассмотрим раму (рис.13.25,а). Опора 4 просела на величину . Определим горизонтальное перемещение узла
2.
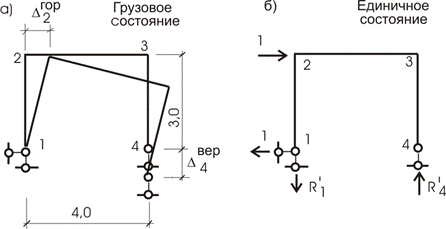
Рис.13.25
Решение.
На основании теоремы о взаимности работ
запишем:
К узлу 2 приложим горизонтальную силу Р=1 (рис.13.25,б) и определим от этого загруженияреакцию
четвертой опоры:
откуда
Отсюда на основании формулы , определим:
Знак минус в скобках взят потому, что
направления реакции и
перемещения опоры различные.
Фармацевтическая химия
SHAPE \* MERGEFORMAT
Только для Cl – , Br – ; (не исп для I – ).
Титрант – AgNO 3 , индикатор – K 2 CrO 4 , среда: pH =6–8.
NaBr + AgNO 3 → AgBr ↓ + NaNO 3 ,
f экв ( NaBr )=1, .
рН >8: 2 Ag + + 2 OH – → Ag 2 O + H 2 O .
Присутствие ионов : SO4 2– , S 2– , PO4 3– , AsO3 3– , BO3 3– , CO3 2– ; Bi 3+ , Ba 2+ , Pb 2+ .
Титрант – AgNO 3 , индикаторы – эозинат натрия ( Br – , I – ), бромтимоловый синий ( Cl – ), среда – CH 3 COOH (30%).
SHAPE \* MERGEFORMAT
NaI + AgNO 3 → AgI ↓ + NaNO 3 .
Йодид серебра адсорбирует на себе одноименные ионы; появляется ярко-розовая окраска:
В точке эквивалентности коллоидная частица становится электронейтральной , в КТТ начинает адсорбировать Ag + ; идет перезарядка мицеллы, осадок коагулирует, раствор просветляется:
( AgI )∙ n I – ( n – x ) K + > x – ∙ x Ag + + Ind 2– → ( x /2) Ag 2 Ind + ( AgI )∙ n I – ( n – x ) K + > x – .
f экв ( NaI )=1, .
Титранты – 1) AgNO 3 , 2) NH 4 SCN ;
Среда – HNO 3 ( pH =3).
К раствору навески препарата прибавляют HNO 3 , точный избыточный объем AgNO 3 и индикатор:
KBr + AgNO 3 → AgBr ↓ + KNO 3 ,
В КТТ индикатор взаимодействует с титрантом :
f экв ( KI )=1, .
Преимущества пред другими методами:
1. Сильнокислая среда,
2. Не мешают друг ие ио ны;
1. Меньшая точность (обратный метод),
Особенности титрования хлоридов:
1. Низкая скорость титрования [ Ks ( AgCl )> Ks ( AgCNS )],
2. Очень слабое перемешивание,
3. Добавление толуола или бензола для экстракции AgCl .
Особенности титрования йодидов:
После добавления нитрата серебра ждут полного осаждения AgI , второй индикатор добавляют перед самым титрованием:
Метод Кальтгофа – Стенглера . /Только для Br – /
Титранты – 1) AgNO 3 , 2) NH 4 SCN , индикатор – NH 4 Fe ( SO 4 )2, среда – HNO 3 ( pH =3).
К раствору навески препарата прибавляют HNO 3 , индикатор и точный избыточный объем NH 4 SCN (0,1 мл):
Титруют нитратом серебра до исчезновения красного окрашивания:
KBr + AgNO 3 → AgBr ↓ + KNO 3,
f экв ( KBr )=1, .
Метод Кальтгофа (Йодкрахмальный). / Для I – в присутствии Cl – и Br – /
Титрант – AgNO 3 , индикатор – крахмал, среда – H 2 SO 4 .
К ратсвору навески препарата прибавляют 1 каплю KIO 3 (0,1 моль/л), раствор крахмала и H 2 SO 4 (1:5) до появления синего окрашивания:
Титруют AgNO 3 (0,1 моль/л) до исчезновения синего окрашивания (после удаления йодида):
f экв ( KI )=1, .
Титрант – AgNO 3 , индикатор – нитриткрахмальная бумага, среда – H 2 SO 4 .
К раствору навески препарата добавляют H 2 SO 4 (1:5), титруют AgNO 3 . Вблизи точки эквивалентности после каждого раза прибавления титранта наносят каплю раствора на нитриткрахмальную бумагу. Титрование заканчивают, когда синего окрашивания на бумаге от прибавления раствора не будет:
f экв ( NaI )=1, .
Что такое метод Фольхарда?
Метод Фольгарда — это аналитический метод, с помощью которого мы можем определить концентрацию галогенидов путем обратного титрования. В этом методе мы можем сначала титровать раствор хлорида ионами серебра, добавив избыточное количество серебра, а затем определить избыточное содержание ионов серебра в образце. В этом эксперименте индикатор представляет собой раствор, содержащий ион трехвалентного железа, который может давать красный цвет с ионами тиоцианата. Избыточное количество ионов серебра титруют раствором тиоцианат-иона. Здесь тиоцианат имеет тенденцию реагировать с ионами серебра, а не с ионами трехвалентного железа. Однако после использования всех ионов серебра тиоцианат вступит в реакцию с ионами трехвалентного железа.
В этом эксперименте индикаторная система очень чувствительна и обычно дает лучшие результаты. Однако мы должны поддерживать кислотность раствора, потому что ионы трехвалентного железа имеют тенденцию образовывать гидроксид трехвалентного железа в присутствии основной среды.
2.4 Метод Фольгарда
Метод Фольгарда – это метод обратного титрования применяют для количественного определения хлоридов, бромидов, йодидов в азотнокислой среде.
Рабочими растворами являются раствор AgNO3 0,1М и раствор NH4CNS 0,1М. Индикатор –FeNH4(SО4)2 – железоаммониевые квасцы. К раствору точной навески галогенида прибавляют полуторный или двойной избыток титрованного раствора нитрата серебра, разведенной азотной кислоты, 10-20 капель индикатора (железоаммониевые квасцы) и титруют избыток нитрата серебра раствором роданида аммония до буровато-оранжевого окрашивания раствора над осадком, устойчивого при непродолжительном вращательном движении.
В данном методе часть AgNO3 реагирует с ионами галогена, образуя осадок галогенидов серебра. А остальная часть оттитровывается NH4CNS с образованием роданида серебра AgCNS. После связывания ионов серебра лишняя капля NH4CNS будет реагировать с железоаммониевыми квасцами с образованием буровато-оранжевого окрашивания раствора Fe(CNS)3, что указывает на достижение точки эквивалентности.
KJ + AgNO3¯AgJ+KNO3
AgNO3 + NH4CNS¯AgCNS +NH4NO3
3NH4CNS + FeNH4(SO4)2 Fe(CNS)3 +2(NH4)SO4
Количество AgNO3, которое пошло на взаимодействие с галогенидом определяют как разность между взятым количеством AgNO3 и оставшимся в избытке.
Примечание.
1. При титровании хлоридов по методу Фольгарда нельзя вблизи точки эквивалентности сильно встряхивать реакционную смесь, так как вследствие меньшей величины произведения растворимости Ag4CNS, чем AgCl,можетпроизойти частичное превращение AgCl в AgCNS,врезультате будут получены заниженные результаты. Поэтому в данном случае прибавляют 5-10 мл органического растворителя, которые обволакивают поверхность осадка AgCl.
2. В щелочной среде можно вести определение после нейтрализации избытка ионов OH — азотной кислотой.
3. При наличии в лекарственной смеси нескольких галогенидов методом Фольгарда определяется сумма всех галогенидов.
Метод Фольгарда имеет преимущество перед методом Мора в том, что он применим не только в нейтральной, но и в кислой среде. А наличие свободных кислот способствует получению более точных результатов. Поэтому этот метод применяется чаще, чем метод Мора.
Определение температурных перемещений в балках и рамах
Перемещение в балках могут вызываться не
только силами, но и изменениями температуры. Предположим, что элемент
конструкции нагрет неравномерно.
Рассмотрим элементарный участок dx (рис. 13.26).
Рис.13.26
С одной стороны его мысленно закрепим глухой
заделкой. От воздействия температуры волокна удлиняются (укорачиваются),
вызывая деформацию стержня.
—
коэффициент линейного расширения.
Тогда
![]()
Следует заметить, что оба слагаемых
равноправны.
![]()
Замечание.
Правило знаков:
а) для М.
Изгибающие моменты откладываем на растянутых волокнах. Если воздействие
температуры и единичная сила растягивают волокна стержня с одной стороны
относительно оси — знак вычисления положительный.
б) для N. Если единичное усилие
и температурное воздействие растягивают (сжимают) стержень — знак произведения
положительный.
Пример 18.
На конструкцию рамы (рис. 13.27,а) воздействует температура. Определим
перемещение узла 3 по горизонтали.
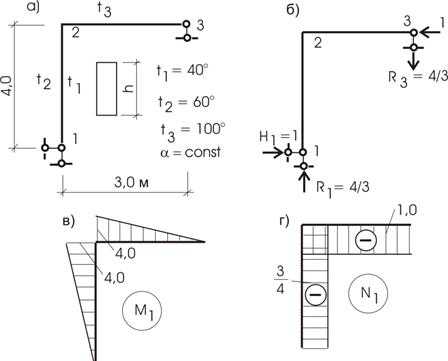
Рис.13.27
Решение.
Приложим к узлу 3 единичную силу (рис. 13.27,б). Построим эпюры моментов и продольных
усилий (рис. 13.27,в,г).
Перед вычислением искомого перемещения отметим правила знаков:
— для изгибающего момента: если воздействие
температуры и единичная сила растягивают волокна стержня с одной стороны
относительно оси, то знак вычисления положительный;
— для продольного усилия: если температура и
единичная сила вызывают деформацию стержня одного направления, то знак
вычисления положительный.
Вычислим искомое перемещение перемножением
эпюр:
![]()
Вычисление интеграла Мора пример
Пусть для шарнирно опертой балки постоянной изгибной жесткости , длиной l, нагруженной равномерно распределенной нагрузкой интенсивностью q (рис. 15.7, а), требуется определить прогиб посредине пролета () и угол поворота на левой опоре ().
определение прогиба с помощью интеграла Мора
В том месте, где нам нужно определить прогиб, к вспомогательной балке прикладываем единичную силу (рис. 15.7, б).
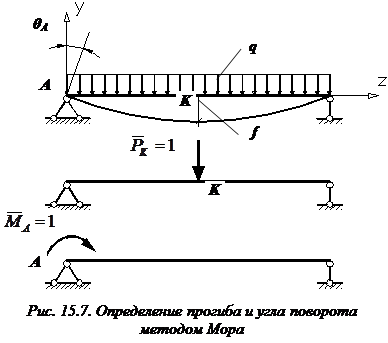 Записываем выражения для изгибающих моментов для каждого из двух участков () заданной и вспомогательной балок:
Записываем выражения для изгибающих моментов для каждого из двух участков () заданной и вспомогательной балок:
.
.
Вычисляем интеграл Мора. Учитывая симметрию балки, получим:
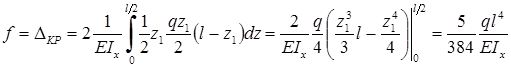 .
.
Определение угла поворота методом Мора
Записываем выражения для изгибающих моментов в заданной и вспомогательной балках только для одного участка ():
;
.
Тогда интеграл Мора будет иметь вид:
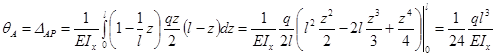 .
.
Положительный знак в выражении для угла поворота поперечного сечения балки указывает на то, что поворот сечения происходит по направлению единичного момента .
Реакции
Какие реакции происходят в методе Мора? Начнем с того, что у нас есть ионы Cl– растворяется в воде, где при добавлении ионов Ag+ Сильно смещенное равновесие растворимости начинается с образования осадка AgCl:
Ag+(ас) + Cl–(ас) ⇋ AgCl (т)
С другой стороны, в середине также должны быть ионы хромата CrO42-, так как без них красноватый осадок Ag2CrO4:
2Ag+(ас) + CrO42-(ac) ⇋ Ag2CrO4(s)
Итак, теоретически должен быть конфликт между обоими осадками, AgCl и Ag.2CrO4 (белый против красного соответственно). Однако в воде при 25 ºC AgCl менее растворим, чем Ag.2CrO4, поэтому первое всегда выпадет в осадок раньше второго.
Фактически, Ag2CrO4 он не будет выпадать в осадок, пока не исчезнут хлориды, с которыми серебро будет образовывать соли; то есть минимальный избыток ионов Ag+ больше не осаждается с Cl– но с CrO42-. Таким образом, мы увидим появление красноватого осадка, что будет последней точкой оценки.
Что такое метод Мора?
Метод Мора — это аналитический метод, с помощью которого мы можем определить концентрацию галогенидов путем прямого титрования. В методе используются нитрат серебра и образец, содержащий галогенид-ионы. Обычно этим методом определяется количество хлорид-ионов. Здесь мы используем индикатор для определения конечной точки титрования; Хромат калия является индикатором.

В методе Мора мы должны добавить в образец нитрат серебра из бюретки. Индикатор также добавляется в образец перед началом титрования. Затем ионы хлорида в образце реагируют с добавленными катионами серебра, образуя осадок хлорида серебра. Когда все ионы хлорида осаждаются, добавление еще одной капли нитрата серебра изменит цвет индикатора хромата калия, указывая на конечную точку титрования. Изменение цвета связано с образованием красного осадка хромата серебра. Но этот красный осадок не образуется вначале, потому что растворимость хлорида серебра очень мала по сравнению с растворимостью хромата серебра.

Кроме того, для этого метода требуется нейтральная среда; если мы используем щелочной раствор, то ионы серебра вступают в реакцию с ионами гидроксида до образования осадка хлорида серебра. Кроме того, мы не можем использовать кислые среды, потому что здесь ионы хромата имеют тенденцию превращаться в ионы дихромата. Следовательно, мы должны поддерживать pH раствора около 7. Кроме того, поскольку это метод прямого титрования, также будет ошибка при определении конечной точки. Например, чтобы получить насыщенный цвет, нам нужно использовать больше индикаторов. Тогда количество ионов серебра, необходимое для осаждения этих хромат-ионов, велико. Таким образом, это дает немного большее значение, чем фактическое значение.
2.7 Аргентометрическое титрование йодидов с внешним индикатором – нитрозо-крахмальной бумажкой.
К раствору йодида прибавляют 20-30 мл воды, 5 мл разведенной серной кислоты и тируют раствором нитрата серебра до тех пор, пока капля титруемого раствора, нанесенная на нитрозо-крахмальную бумажку не будет больше вызывать ее посинения. Если в тируемом растворе еще содержится йодид, то индикаторная бумага синеет, вследствие выделения йода:
2NaNO2+2NaJ+2H2SO4 J2 + 2NO +2Na2SO4+2H2O
Эквивалент йодидов равен молекулярной массе.
Для получения более точных результатов при титровании с внешним индикатором, необходимо предварительно рассчитать количество титрованного раствора нитрата серебра, которое должно пойти на титрование взятой навески йодида или провести вначале ориентировочное титрование, а затем при повторном титровании уточнить результаты.
Примечание.
Определению йодидов с внешним индикатором не мешают хлориды и бромиды.
В своей работе я применяла все методы аргентометрического титрования, но чаще всего пользуюсь методом Фаянса.
Эти методы дают хорошие результаты, укладывающиеся в нормы отклонений не только в простых лекарственных формах, но и в сложных сочетаниях лекарственных веществ. Методы аргентометрического титрования весьма разнообразны, что дает возможность выбрать тот метод, который подходит для данного сочетания лекарственных веществ.
Из изложенного материала видно, что
1. Аргентометрические методы анализа технологически просты в исполнении;
2. Они не требуют больших затрат времени;
3. Конец титрования определяется ярко выраженными осадками или окрашиваниями;
4. Эти методы дают возможность количественного определения большого количества лекарственных веществ.
Поэтому аргентометрические методы анализа нашли широкое применение в аптечной практике
4. Ф.Е. Каган. Анализ многокомпонентных лекарственных смесей с галогенидами и другими препаратами. Минск.
-
Психическое развитие причины факторы кратко
-
Голицынский сборник упражнений для средней школы
-
Революционный процесс в россии в 1917 кратко
-
Методика преподавания биологии в школе по фгос
- Охарактеризуйте отличие современных папоротников от вымерших кратко
Перемножение эпюр произведем по правилу Верещагина и правилу Симпсона.
(по Верещагину)
(по
Симпсону)
Точка
2 перемещается вниз на 504 единицы.
Задача 2. Определить угол поворота
сечения 4.
Прикладываем сосредоточенный изгибающий
момент М = 1 к сечению 4 (рис. 13.20,г) и строим от него эпюру М1.
Перемножаем полученную эпюру М1 на Мр (она остается прежней – рис. 13.20,б).
Задача
3. Определить взаимное смещение узлов 1 и 2.
Прикладываем к точкам 1 и 2 две единичные
противоположно направленные силы, линия действия которых проходит по линии 1–2
(рис. 13.20,д). Строим от обобщенной
единичной нагрузки эпюру М1 (рис. 13.20,е).
Перемножение
эпюр М1и Мрдает:
![]()
Пример 14.
Дана рама (рис. 13.21,а), загруженная единичной силой Р= 1 кН. Необходимо определить величину
перемещения точки приложения этой силы по ее направлению.
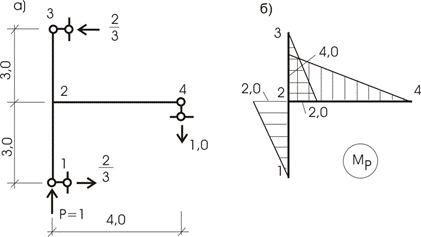
Рис.13.21
Решение.
Эпюра Мpот внешнего загружения показана на рисунке 13.21,б.
Загружаем раму единичной нагрузкой Р= 1, приложенной к точке 1 (к точке
приложения внешней нагрузки) по направлению силы Р = 1 (кн) – рис. 13.22,а,и строим эпюру М1
(рис.13.22,б). Сравнивая этидве эпюры, видим, что они равны во всех
отношениях, а это означает, что формулу Мора можем записать:
В этом случае мы говорим, что эпюруперемножаем саму на себя.
Читатель, отметьте это для себя — этим мы в
дальнейшем будем пользоваться неоднократно.
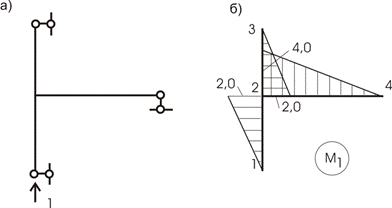
Рис.13.22
Пример 15.
Ферма (рис. 13.23,а) загружена системой сил. Требуется определить вертикальное
перемещение узла 3 —
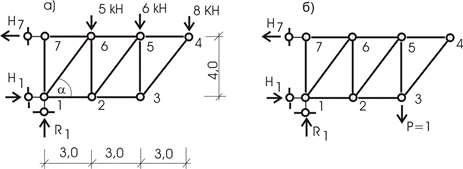
Рис.13.23
Решение.
Определяем усилия в стержнях фермы
от внешнего и единичного (рис. 13.23,а,б) загружений. Результаты
сведем в таблицу 13.2.
Таблица13.2
|
№ стержня |
1-2
2-3
3-4
5-3
5-2
2-6
6-1
1-7
7-6
6-5
5-4
Длина
3.0
3.0
5.0
4.0
5.0
4.0
5.0
4.0
3.0
3.0
3.0
Усилие Р
-16.5
-6.0
-10.0
8.0
-17.5
14.0
-23.75
30.75
16.5
6.0
Усилие 1
-0.75
1.0
-1.25
1
-1.25
1.5
0.75
![]()
![]()
Результат есть сумма произведений усилий Npна N1 и на длину
стержня, соответственно.
Пример 16.
Найдём вертикальное перемещение точки
пространственной рамы (рис. 13.24, а).
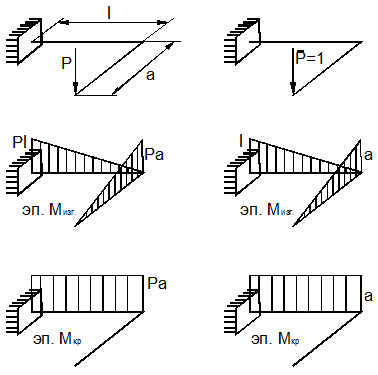
а)б)
Рис.
13.24
Решение.
По формуле Мора (3):
которая учитывает
кручение и изгиб стержней рамы. На рис. 13.24 приведены эпюры
изгибающих моментов от заданной и единичной нагрузок.
Вычисление даёт:
![]()






























