Составление формулы мицеллы коллоидного раствора
Методические рекомендации
По решению задач
«Коллоидные растворы»
для специальностей 19.02.03 «Технология хлеба, кондитерских и макаронных изделий»; 19.02.05 «Технология бродильных производств и виноделие»; 19.02.10 «Технология продукции общественного питания»
Коллоидные растворы
Составление формулы мицеллы коллоидного раствора
Теоретические положения
Мицелла – это структурная коллоидная частица дисперсной фазы.
Правила построения мицеллы:
1.Агрегатом является получающийся в ходе реакции осадок.
2.Потенциалобразующими ионами являются ионы, удовлетворяющие двум условиям:
а) данные ионы должны быть в строении вещества, которое находится в реакции в избытке или является стабилизатором;
б) данные ионы должны быть подобны ионам, находящимся в агрегате (правило Панета-Фаянса: на кристаллической поверхности агрегата адсорбируются те ионы, которые могут достроить её кристаллическую структуру).
3.Противоионами и ионами, образующими диффузионный слой, являются оставшиеся ионы вещества, которое находится в реакции в избытке или является стабилизатором.
4.Коэффициенты m, n, (n-x), x являются постоянными для любой мицеллы и численно не определены.
При смешивании разбавленных растворов нитрата серебра и хлорида натрия взятого в избытке, хлорид серебра не выпадает в осадок, а образуется коллоидный раствор.
Сначала составляем уравнение реакции в молекулярном и ионном виде:
AgNO3 + NaCl → NaNO3 + AgCl↓
Ag + + NO3 — + Na + + Cl — → Na + + NO3 — + AgCl↓
Основу коллоидных частиц золя AgCl составляют микрокристаллы малорастворимого хлорида серебра, которые называются агрегатами, обозначаются m (AgCl).
Эта реакция происходит при наличии избытка хлорида натрия, вследствие избирательной адсорбции Сl — , на поверхности агрегата возникает отрицательно заряженный слой из хлорид-ионов.
Cl — называются потенциалопределяющими ионами.
Агрегат вместе с потенциалопределяющими ионами, которые адсорбировались и вошли в кристаллическую решётку агрегата, являются частицами твердой фазы – ядра.
Обратите внимание на то, что потенциалопределяющими ионами могут быть ионы, которые достраивают кристаллическую решетку агрегата или содержатся в составе агрегата. Под действием электростатических сил к поверхности ядра притягиваются ионы противоположного знака – противоионы
В данном случае – это ионы Na +
Под действием электростатических сил к поверхности ядра притягиваются ионы противоположного знака – противоионы. В данном случае – это ионы Na + .
Адсорбционный слой
Агрегат, ядро, адсорбционный слой образуют гранулу. Заряд гранулы поределяется знаком заряда потенциалопределяющих ионов (Сl — ), обозначается в правом верхнем углу.
Гранула имеет вид:
Так как концентрация противоионов около поверхности больше, чем в растворе, то остальная часть противоионов Na + слабее связана с ядром и под влиянием теплового движения диффундирует в сторону с меньшей концентрацией, образуя диффузионный слой проивоионов.
x) Na + > х- x Na +
Гранула вместе с диффузионным слоем образует мицеллу. Мицеллы золей электронейтральны.
Формула мицеллы:
x) Na + > х- x Na +
агрегат адсорбционный слой диффузионный слой
гранула
m ‑ количество молекул, входящих в состав агрегата;
n – количество потенциалопределяющих ионов;
(n – х) – количество противоионов, входящих в адсорбционный слой;
х – количество противоионов, входящих в диффузионный слой.
Мицелла: строение, схема, описание и химическая формула
Коллоидные системы чрезвычайно важны в жизни любого человека. Это связано не только с тем, что практически все биологические жидкости в живом организме образуют коллоиды. Но и многие природные явления (туман, смог), почва, минералы, продукты питания, лекарственные средства тоже являются коллоидными системами.

Единицей таких образований, отражающих их состав и специфические свойства, принято считать макромолекулу, или мицеллу. Строение последней зависит от ряда факторов, но это всегда многослойная частица. Современной молекулярно-кинетической теорией коллоидные растворы рассматриваются в качестве частного случая истинных растворов, с более крупными частицами растворенного вещества.
Гидрозоль BaSO4
В качестве примера удобно рассмотреть строение мицеллы сульфата бария в коллоидном растворе, приготовленном в избытке хлорида бария. Этому процессу соответствует уравнение реакции:
BaCl2(p) + Na2SO4(p) = BaSO4(т) + 2NaCl(p).
Малорастворимый в воде сульфат бария образует микрокристаллический агрегат, построенный из m-ного числа молекул BaSO. Поверхностью этого агрегата адсорбируется n-ное количество ионов Ва2+. Со слоем потенциалопределяющих ионов связано 2(n — x) ионов Cl-. А остальная же часть противоионов (2x) расположена в диффузном слое. То есть гранула данной мицеллы будет положительно заряженной.
Если же в избытке взят сульфат натрия, то потенциалопределяющими ионами будут ионы SO2-, а противоионами – Na+. В этом случае заряд гранулы будет отрицательным.
Этот пример наглядно демонстрирует, что знак заряда гранулы мицеллы напрямую зависит от условий ее получения.
КЛАССИФИКАЦИЯ ПАВ
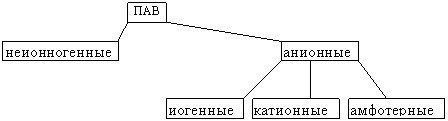
Анионные ПАВ — диссоцииируют в водес образованием поверхностно-активногоаниона.
К ПАВ этого типа, составляющего большую часть мирового производства всех ПАВ
относятся:
а) карбоновые
кислоты и их соли;
б) алкилсульфаты;
в) фосфаты,
тиосульфаты.
В качестве ПАВ
широкое практическое применение находят соли синтетических жирных кислот.
В кислых
средахсоли карбоновых кислот переходят
в слабодиссоциированные и малорастворимые кислоты, что резко снижаетэффективность их действия, ухудшает их моющие
свойства.
Катионные ПАВ диссоцииируют в воде с образованием
поверхностно-активного катиона. К катионным ПАВ относятся соли первичных,
вторичных и третичных алифатических и ароматических аминов.
Катионные ПАВ
наиболее токсичные и наименее биологически разлагаемые из всех ПАВ, их часто
используют в качестве бактерицидных, фунгицидных дезинфицирующих веществ,
ингибиторов коррозии.
Амфолитные ПАВ содержат две функциональные
группы. В зависимости от рН среды проявляют анионноактивные или
катионноактивные свойства.
Неионногенные ПАВ не диссоциируют в растворах
на ионы. Методы их получения основаны на реакции присоединения этиленоксида к
спиртам, карбоновым кислотам, аминам и другим соединениям.
Как правило,
неионногенные ПАВ являются смесью гомологов с различной длиной
полиоксиэтиленовой цепи.
Полиоксиэтиленовая
цепь определяет гидрофильные свойства неионногенных ПАВ. Изменяя длину
полиоксиэтиленовой цепи, легко регулировать их коллоидно-химические свойства.
Эти ПАВ применяются в любых средах, а также в присутствии растворимых солей.
Полиоксиэтиленовые эфиры алкилфенолов марки ОП обладают хорошими моющими
свойствами.
К недостаткам
неионногенных ПАВ относится медленное разложение из-за наличия в их составе
ароматического радикала и, как следствие, накопление их в объектах окружающей
среды. Неионногенные ПАВ с алкильными радикалами способны биологически
разлагаться довольно быстро и полно.
Поведение ПАВ
в растворах зависит от природы растворителя.
Обычно свойства ПАВ характеризуют по отношению к воде. Все ПАВ по отношению к
воде делятся на истинно растворимые и
коллоидные.
К первой
группе относится большой класс растворимых в воде дифильных органических
соединений с небольшим углеводородным радикалом, например, низшие спирты,
фенолы, кислоты и их соли — амины. Вещества этого типа находятся в растворе в
молекулярно- дисперсном состоянии, применяют их в качестве смачивателей,
вспенивателей, диспергаторов.
Особый интерес
представляют коллоидные ПАВ. Главная отличительная особенность этих веществ —
способность образовывать термодинамически устойчивые (лиофильные) гетерогенные
дисперсные системы. Основные свойства коллоидных ПАВ: высокая поверхностная
активность, способность к самопроизвольному мицеллообразованию, способность к солюбилизации — (резкому увеличению
растворимости веществ в растворах коллоидных ПАВ вследствии их внедрения вглубь
мицеллы), высокая способность стабилизировать дисперсные системы.
Высокая
поверхностная активностьзависит от длины
углеводородного радикала. Увеличениедлины на одну группу СН2 приводит к возрастанию поверхностной
активности в 3,2 раза (правило
Дюкло-Траубе). Это правило соблюдается в основном для истинно растворимых
ПАВ. Для органических сред это правило обращается, то естьс увеличением длины у/в радикала
поверхностная активность уменьшается.
ТЕРМОДИНАМИКА И МЕХАНИЗМ МИЦЕЛЛООБРАЗОВАНИЯ
Истинная
растворимость ПАВ определяется увеличением энтропии при растворении.
Для
ионногенных ПАВ характерна диссоциация в водных растворах, поэтому их
растворимость значительна.
Неионногенные ПАВ
не диссоциируют, поэтому их растворимость меньше. Чаще растворение ПАВ
происходит с поглощением теплоты, поэтомурастворимость увеличивается с увеличением температуры.
Малая
растворимость ПАВ проявляется в положительной поверхностной активности, а с ростом
концентрации — в значительной ассоциации молекул ПАВ, переходящей в
мицеллообразование.
Рис.10.1.Изотерма
коллоидных ПАВ. ККМ — критическая концентрация мицеллообразования.
При
концентрациях выше ККМ молекулы ПАВ собираются в мицеллы и раствор переходит в
мицеллярную систему.
Мицелла ПАВ — ассоциат дифильных молекул, лиофильные группы
которых обращены к соответствующему растворителю, а лиофобные — соединяются
друг с другом, образуя ядро мицеллы.
Число молекул
в мицелле — число ассоциации. Общая
сумма молекулярных масс в мицелле — мицеллярная
масса.
Мицелярные
системы обратимы — при разбавлении растворов мицеллы распадаются на молекулы
или ионы, образуя истинные растворы.
Температура, при которой резко увеличивается растворимость ПАВ из-за образования
мицелл, называется точкой Крафта..
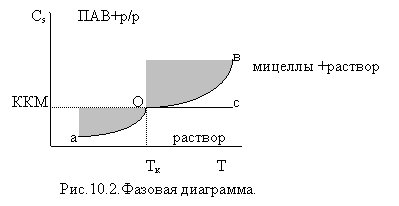
Точка
КрафтаТк соответствует ККМ
на фазовой диаграмме коллоидных ПАВ.
Сs
— растворимость ПАВ в воде,
ККМ — характеризует нижний концентрационный предел существования
мицелл, Тк-характеризует нижний температурный предел существования
мицелл., аО — равновесие между чистым ПАВ и истинным раствором ПАВ
(температурная зависимость истинной растворимости ПАВ), Ов — равновесие между
чистым ПАВ и его мицеллярным раствором (температурная зависимость мицеллярной
растворимости),Ос — равновесие между
мицеллами и мономерами ПАВ (изменение ККМ от температуры).
Точка Крафта — тройная точка на диаграмме — равновесие между чистым
ПАВ, мицеллярным раствором, и истинным раствором ПАВ. Тк
уменьшается с уменьшением длины углеводородного радикала, его разветвления,
при наличии кратных связей, с внедрением полярных групп, с увеличением
растворимости ПАВ.
Процесс мицеллообразования можно выразить с помощью уравнения:
m(ПАВ) (ПАВ)m(неионногенные ПАВ)
nК+ + mR- М(m — n)-
К+ -противоионы,
R- — поверхностно-активный
анион,
m — число R
в молекуле,
М — мицелла.
Константа
равновесия:
(10.1)
(10.2)
(10.3)
Подставим
вместо К ее выражение из (10.1), принимая g = 1 (так как раствор
разбавленный, учитывая , чтоС=ККМ:
(10.4)
То есть
рассмотрение мицеллообразования с использованием закона действующих масс
позволяет определить термодинамические функции этого процесса по значению ККМ и
активности мицеллы.
С увеличением
сродства молекул ПАВ к растворителю (их лиофильность) устойчивость мицелл
уменьшается и увеличивается ККМ: молекулам ПАВ труднее собраться в мицеллу.
На процесс
мицеллообразования в водных растворах влияет структура воды, которая
способствует выталкиванию углеводородных радикалов из раствора. Благодаря
дифильному строению молекул ПАВ, углеводороды, взаимодействующие между собой в
мицеллах, экранируются гидрофильными группами. Поэтому происходит
самопроизвольное мицеллообразование с минимальным поверхностным натяжением на
границе мицелла — вода, при этом DG<
Эффектом
экранирования объясняется уменьшение площади поверхности раздела в процессе
мицеллообразования.
Строение мицеллы
Основной частью мицеллы является ядро. Оно образовано большим числом атомов, ионов и молекул нерастворимого соединения. Обычно ядро характеризуется кристаллическим строением. Поверхность ядра имеет запас свободной энергии, позволяющей избирательно адсорбировать ионы из окружающей среды. Процесс этот подчиняется правилу Пескова, которое гласит: на поверхности твердого вещества преимущественно адсорбируются те ионы, которые способны достраивать его же кристаллическую решетку. Это возможно в том случае, если эти ионы родственные или сходные по природе и форме (размерам).
В ходе адсорбции на ядре мицеллы образуется слой положительно или отрицательно заряженных ионов, называемых потенциалопределяющими. Благодаря электростатическим силам полученный заряженный агрегат притягивает из раствора противоионы (ионы с противоположным зарядом). Таким образом, коллоидная частица имеет многослойное строение. Мицелла приобретает диэлектрический слой, построенный из двух типов противоположно заряженных ионов.
Конденсационные методы
Вторая группа методов, основанная на укрупнении частиц, называется конденсационными. Этот процесс может основываться на физических или химических явлениях. К методам физической конденсации относят следующие.
Замена растворителя. Сводится она к переводу вещества из одного растворителя, в котором оно растворяется очень хорошо, в другой, растворимость в котором значительно ниже. В результате этого мелкие частицы объединятся в более крупные агрегаты и возникнет коллоидный раствор.
Конденсация из паров. В качестве примера можно назвать туманы, частицы которых способны оседать на холодных поверхностях и постепенно укрупняться.
К методам химической конденсации относят некоторые химические реакции, сопровождающиеся выпадением осадков комплексной структуры:
- Ионный обмен: NaCl + AgNO3 = AgCl↓ + NaNO3.
- Окислительно-восстановительные процессы: 2H2S + O2 = 2S↓ + 2H2O.
- Гидролиз: Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S.
Способы получения коллоидных растворов
Строение мицеллы, образующейся при возникновении коллоидной системы, отчасти зависит и от механизма этого процесса. Методы получения коллоидов делят на две принципиально разные группы.
Диспергационные методы связаны с измельчением довольно крупных частиц. В зависимости от механизма этого процесса различают следующие способы.
Размол. Может осуществляться сухим или мокрым способом. В первом случае твердое вещество сначала измельчают, а уже затем прибавляют жидкость. Во втором случае вещество смешивают с жидкостью, и только после этого превращают в однородную смесь. Размол проводят в специальных мельницах.
Набухание. Измельчение достигается благодаря тому, что частицы растворителя проникают внутрь дисперсной фазы, что сопровождается раздвиганием ее частиц вплоть до отрыва.
Диспергирование ультразвуком. Материал, подверженный измельчению, помещают в жидкость и действуют на него ультразвуком.
Диспергирование электрическим током. Востребовано при получении золей металлов. Проводится путем помещения в жидкость электродов из диспергируемого металла с последующей подачей на них высокого напряжения. В результате образуется вольтова дуга, в которой металл распыляется, а затем конденсируется в раствор.
Эти способы подходят для получения как лиофильных, так и лиофобных коллоидных частиц. Строение мицеллы осуществляется одновременно с разрушением исходной структуры твердого вещества.
Виды мицелл
По особенностям организации внутренней структуры выделяют три типа коллоидных систем: суспензоиды, мицеллярные коллоиды, молекулярные коллоиды.
Суспензоидами могут быть необратимые коллоиды, а также лиофобные коллоиды. Эта структура характерна для растворов металлов, а также их соединений (различных оксидов и солей). Строение дисперсной фазы, образованной суспензоидами, не отличается от структуры компактного вещества. Она имеет молекулярную или ионную кристаллическую решетку. Отличие от суспензий заключается в более высокой дисперсности. Необратимость проявляется в способности их растворов после выпаривания образовывать сухой осадок, который невозможно превратить в золь простым растворением. Лиофобными их называют из-за слабого взаимодействия между дисперсной фазой и дисперсионной средой.
Мицеллярными коллоидами являются растворы, коллоидные частицы которых возникают при слипании дифильных молекул, содержащих полярные группы атомов и неполярные радикалы. Примером являются мыла и ПАВ. Молекулы в таких мицеллах удерживаются дисперсионными силами. Форма этих коллоидов может быть не только сферической, но и пластинчатой.
Молекулярные коллоиды вполне устойчивы без стабилизаторов. Их структурными единицами являются отдельные макромолекулы. Форма частицы коллоида может варьироваться в зависимости от свойств молекулы и внутримолекулярных взаимодействий. Так линейная молекула может образовывать стержень или клубок.
Мицеллы поверхностно-активных веществ
В том случае если концентрация поверхностно-активных веществ (ПАВ) в воде слишком высока, могут начать формироваться агрегаты из их молекул (или ионов). Эти укрупненные частицы имеют форму сферы и называются мицеллами Гартли — Ребиндера. Стоит отметить, что такой способностью обладают далеко не все ПАВ, а только те, у которых соотношение гидрофобной и гидрофильной частей оптимально. Это соотношение называется гидрофильно-липофильным балансом. Также немалую роль играет способность их полярных групп защищать углеводородное ядро от воды.
Агрегаты молекул ПАВ образуются по определенным законам:
- в отличие от низкомолекулярных веществ, агрегаты которых могут включать различное число молекул m, существование мицелл ПАВ возможно со строго определенным числом молекул;
- если для неорганических веществ старт мицеллообразования обусловлен пределом растворимости, то для органических поверхностно-активных веществ он определяется достижением критических концентраций мицеллообразования;
- сначала в растворе увеличивается число мицелл, а затем происходит увеличение их размеров.
Структурные части коллоидной частицы
В квадратных скобках записывают формулу труднорастворимого соединения, являющегося основой всей частицы. Ее принято называть агрегатом. Обычно число молекул, составляющих агрегат, записывают латинской буквой m.
Потенциалопределяющие ионы содержатся в избыточном количестве в растворе. Они располагаются на поверхности агрегата, а в формуле их записывают сразу за квадратными скобками. Число этих ионов обозначают символом n. Название этих ионов говорит о том, что их заряд определяет заряд гранулы мицеллы.
Гранула образована ядром и частью противоионов, находящихся в адсорбционном слое. Величина заряда гранулы равняется сумме зарядов потенциалопределяющих и адсорбированных противоионов: +(2n – x). Оставшаяся часть противоионов находится в диффузном слое и компенсирует заряд гранулы.
Если бы в избытке взяли Na2S, то для образовавшейся коллоидной мицеллы схема строения имела бы вид:
{∙nS2–∙xNa+}–(2n – x) ∙(2n – x)Na+.
СТРОЕНИЕ МИЦЕЛЛ ПАВ. СОЛЮБИЛИЗАЦИЯ
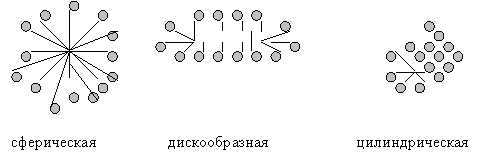
При
концентрациях ПАВ в водном растворе, несколько превышающем ККМ, согласно
представлениям Гартли образуются сферические мицеллы, их еще называют мицеллы
Гартли. Внутренняя часть их состоит из переплетающихся углеводородных
радикалов, полярные молекулы ПАВ обращены в водную среду, такие мицеллы могут
содержать по 20 — 100 молекул.
При увеличении
концентрации ПАВ мицеллярная система проходит ряд равновесных состояний,
которые различаются по числу ассоциаций, размерам и форме мицелл. При
достижении определенной концентрации сферические мицеллы начинают взаимодействовать
между собой и стремятся принять цилиндрическую, дискообразную формы. Последней
стадией агрегации является образование гелеобразной структуры и твердого
кристаллического ПАВ.
Мицеллы ионногенных
ПАВ заряжены, что проявляется в их электрофоретической подвижности.
Мицеллообразование
в неводных средах — результат действия сил притяжения между полярными группами
ПАВ и взаимодействия радикалов с молекулами растворителя.
Образующиеся
мицеллы обращенного вида содержат внутри полярные группы, окруженные слоем
радикалов.
Мицеллообразованию
в неводных средах может способствовать наличие воды, связывающей полярные
группы. Она при этом оказывается внутри мицелл.
Избыточное
количество воды может привести к обращению структуры мицеллы.
Явление
растворения веществ в мицеллах ПАВ называют солюбилизацией. Вещество, солюбилизированное раствором ПАВ —
солюбилизат, ПАВ — солюбилизатор.
Мольная
солюбилизация Sm
— количество молей солюбилизата, отнесенного к 1 молю мицеллярного ПАВ.
Способ
включения молекул солюбилизата в мицеллы зависит от природы вещества:
неполярные углеводороды располагаются в углеводородных ядрах мицелл, полярные —
встраиваются в мицеллу между молекул ПАВ так, чтобы их полярные группы были обращены
к воде.
Солюбилизация
— самопроизвольный процесс. В результате образуются устойчивые дисперсные
системы. Солюбилизация — важнейший фактор моющего действия ПАВ, играет большую
роль в жизнедеятельности живых организмов, являясь одним из звеньевпроцесса обмена веществ.





























