Белок из чего состоит. Полноценные и неполноценные белки – в чем разница?
Белки (или протеины) являются важнейшими компонентами пищи (наряду с жирами, углеводами, витаминами, минералами и водой).
По мнению специалистов, их доля в суточном рационе должна составлять 10 – 15%. Сегодня мы поговорим о строении, а также различных видах белков.
Простые и сложные, животные и растительные, полноценные и неполноценные белки– в чем их отличие.

Белки – это высокомолекулярные вещества, имеющие сложное строение . Мы не способны усваивать их в том виде, в каком они поступают вместе с пищей, так как для нас они являются чужими.
Поэтому, попадая в организм, пищевые белки распадаются на небольшие структурные единицы — аминокислоты. Именно из аминокислот наш организм создает собственные, свойственные только ему белки, которые впоследствии использует на свои нужды.
Как известно из белков состоит наша кожа, волосы, ногти, мышцы и т.д. Кроме того белки (протеины) являются неотъемлемой частью спортивного питания.
Всего насчитывается 20 аминокислот. В их состав входит кислород, водород, углерод, азот, иногда сера и фосфор.
Часть аминокислот образуются в самом организме благодаря кишечным бактериям. Такие аминокислоты называются заменимыми.

Но существуют также 8 незаменимых аминокислот:
- триптофан;
- лизин;
- валин;
- лейцин;
- изолейцин;
- фенилаланин;
- метионин;
- треонин;
- а также гистидин (для детей).
Незаменимые аминокислоты отсутствуют в организме, поэтому обязательно должны поступать вместе с пищевыми продуктами.
Стоит отметить, что в организме человека существует около 5 миллионов различных белков, каждый из которых выполняет свою конкретную функцию.
Своим многообразием протеины обязаны именно аминокислотам. Последние, соединяясь друг с другом, образуют самые разнообразные комбинации.
Рассмотрим более подробно виды белков:
1. Простые и сложные. Первые состоят только из аминокислот (белковой части), в состав же последних входит еще простетическая группа (небелковая часть).
2. Животные (мясо, рыба, птица, молочные продукты) и растительные (орехи, соя, горох, фасоль). При этом на животные белки должно приходится около 60%.
3. Полноценные и неполноценные белки . Полноценные белки включают все незаменимые аминокислоты, которые самостоятельно в организме не образуются.
Полноценные белки содержатся в продуктах животного происхождения, а также некоторой растительной пище (горох, фасоль, соя).
Стоит отметить, что самым ценным является белок куриного яйца, который содержит полный набор аминокислот в нужных пропорциях.
Кроме того 200 г говядины или 200 г трески или 1,5 л молока способны обеспечить организм человека массой 70 кг всеми незаменимыми аминокислотами.

В неполноценных белках те или иные незаменимые аминокислоты содержатся в незначительных количествах либо же полностью отсутствуют.
Многие растительные белки являются неполноценными, например, некоторые злаки (пшеница, ячмень и другие). Они бедны лизином, триптофаном, треонином и метионином.
Для повышения биологической ценности хлеба в него добавляют лизин.
4. Глобулярные (имеют сферическую форму) и фибриллярные (имеют вытянутую нитевидную форму).
Одни глобулярные белки такие, как альбумины и глобулины, содержатся в яичном белке, молоке, а также сыворотке крови.
Источниками других, например, глютелинов и проламинов, служат растительные белки (пшеница, ячмень, кукуруза и другие).
Фибриллярные белки в основном являются животными белками и выполняют структурную функцию в организме.
К ним относятся коллаген (белок хрящевой, костной и соединительной ткани), эластин (белок соединительной ткани мышц, связок и сосудов), кератины (белки кожи, волос и ногтей).
5. Высококачественные (мясо, рыба, птица, соя, яйца, сыр, молоко) и низкокачественные (картофель, макароны, рис, хлеб, орехи, бобы).

Итак, мы узнали, из чего состоят протеины, чем отличаются полноценные белки от неполноценных, а также познакомились с другими видами белков.
В следующей статье мы поговорим о том, чем полезен белок для организма, каковы его функции.
Состав белков
Белки содержат: углерод, кислород, водород, азот и серу. Помимо упомянутых элементов, некоторые белки могут также содержать: фосфор, железо, цинк, медь, марганец и йод.
Некоторые белки растворяются в воде, некоторые – в водных растворах кислот, оснований и солей, и ни один из них не растворяется в органических растворителях (кроме спирта).
При более высоких температурах белок сворачивается, т.е. происходит денатурация. В нормальных условиях этот необратимый процесс изменения структуры белковой молекулы можно наблюдать, например, путем варки яйца. Денатурация также может быть вызвана сильными кислотами и основаниями, солями тяжелых металлов или спиртом.
Основные строительные блоки белков – аминокислоты, объединяющиеся друг с другом с образованием многомолекулярных химических соединений со сложной структурой и высокой молекулярной массой. Поэтому белки различаются по структуре и свойствам в зависимости от количества аминокислот и их взаимного положения в молекуле. Комбинации двух или более молекул аминокислот называются пептидами (две молекулы аминокислот образуют дипептиды, три – трипептиды и т. д.).
Состав белков
Мы знаем 20 аминокислот, 8 из которых считаются незаменимыми для человеческого организма. Это так называемые экзогенные аминокислоты, которые должны поступать в организм с пищей. Их называют незаменимыми, потому что их нельзя заменить другими. К незаменимым аминокислотам относятся: лизин, метионин, треонин, лейцин, изолейцин, валин, триптофан и фенилаланин, а также гистидин, который вырабатывается организмом, но в недостаточных количествах.
Вторая группа аминокислот – полуэкзогенные аминокислоты, которые могут образовываться в организме из экзогенных аминокислот. Например тирозин синтезируется в печени из фенилаланина, а цистеин образуется из метионина.
Третья группа включает эндогенные аминокислоты (они не являются незаменимыми),их организм может синтезировать сам. Это: глицин, аланин, аргинин, аспарагиновая кислота, глутаминовая кислота, пролин, гидроксипролин и серин.
Какие продукты содержат «неполные» белки?
Вопреки распространенному мнению, большинство продуктов — как животного, так и растительного происхождения — содержат все девять незаменимых аминокислот. Разница заключается в их количестве.
Например, мясо, рыба, яйца и молочные продукты содержат высокий уровень всех девяти незаменимых аминокислот. С другой стороны, растения, как правило, содержат небольшое количество как минимум одной или двух незаменимых аминокислот, в зависимости от категории, к которой они принадлежат.
Например, бобовые и овощи, как правило, содержат мало метионина и цистеина, тогда как зерна, орехи и семена, как правило, содержат мало лизина ().
На практике это означает, что соблюдение диеты, в которой содержится слишком мало какой-либо группы продуктов, может привести к получению недостаточного количества незаменимых аминокислот.
Вот почему продукты животного происхождения обычно считаются «полноценными» источниками белка, в то время как большинство продуктов растительного происхождения считаются «неполными».
Этими исключениями являются соя, лебеда, амарант, гречиха, и пищевые дрожжи, а также конопля и семена чиа. Эти растительные продукты содержат большое количество всех девяти незаменимых аминокислот и считаются «полноценными» источниками растительного белка.
Вывод: за некоторыми исключениями, большинство продуктов растительного происхождения обычно рассматриваются как «неполные» источники белка. Напротив, продукты животного происхождения считаются насыщенными «полноценными» белками.
Избыток белка
Избыток белка также не рекомендуется, потому что азот, неиспользованный для создания белков организма, должен выводиться из организма. Аммиак образуется в печени из иона амина (содержащего азот) и диоксида углерода, который, в свою очередь, превращается в мочевину и выводится почками.
Таким образом, избыток потребленного белка по отношению к потребностям организма увеличивает количество выделяемых азотных соединений и, таким образом, создает дополнительную нагрузку на почки и печень. Избыток белка у младенцев может вызвать диарею, симптомы ацидоза, обезвоживание, гипераммонемию и лихорадку.
Кроме того, чрезмерное потребление белка обычно связано с увеличением потребления мяса, мясного ассорти и сыра с высоким содержанием жира. Такая диета с высоким содержанием белка может превратиться в диету с высоким содержанием жиров, что может привести к развитию ожирения и дислипидемии (липидных нарушений), за которыми следует атеросклероз и гипертония.
Дислипидемия
Более того, при большом количестве белка в пище может нарушиться метаболизм одной из аминокислот – метионина, особенно при недостаточном поступлении витаминов группы В (особенно витамина В 6). Это приводит к увеличению выработки гомоцистеина, одного из основных факторов риска атеросклероза.
Продолжительное употребление высокобелковой диеты приводит к увеличению выведения кальция с мочой. Если к тому же высокобелковая диета не сопровождается увеличением поступления кальция и витамина D с продуктами, увеличивается риск остеопороза.
Чрезмерное потребление белка может привести к развитию камней в почках и подагре, поэтому рекомендуется употреблять нужное количество белка и использовать диету с высоким содержанием белка только при заболеваниях (например, кахексии, хронических заболеваниях печени).
Классификация белков
Белки классифицируются по:
- химической структуре;
- биологической функции;
- месту возникновения.
По своему химическому строению белки делятся на простые и сложные. Простые белки состоят только из аминокислот, в то время как сложные белки, помимо аминокислот, также содержат небелковые соединения, так называемые простетические группы (остаток фосфорной кислоты, нуклеиновые кислоты, гем, атом тяжелых металлов, углеводы, липиды). К ним относятся фосфопротеины, нуклеопротеины, хромопротеины, металлопротеины, гликопротеины и липопротеины.
Классификация белков
Из-за различных функций отдельных белков их можно разделить на:
- структурные белки – коллаген, эластин, кератин, гликопротеины;
- ферментные белки – ферменты;
- защитные белки – иммуноглобулины, фибриноген, интерферон;
- транспортные белки – гемоглобин, альбумин плазмы, липопротеин, трансферрин;
- белки, участвующие в сокращении – актин, миозин;
- гормоны – инсулин, глюкагон, паратиреоидный гормон, кальцитонин;
- белки клеточной мембраны.
По месту нахождения в пище белки можно разделить на:
- животные белки, полученные из мяса, мясного ассорти, птицы, рыбы, молока, сыра, яиц;
- растительные белки, полученные из зерновых продуктов, семян бобовых, картофеля, овощей и фруктов.
Содержание белка в мясе может колебаться в пределах 11-23% (например, свинина – 15-21%, говядина – 16-21%, субпродукты – 11-17%, птица – 18-23%, рыба – 16-19%. ). Растительные продукты содержат в среднем 1-2% белка (исключение составляют: зеленый горошек – 6% белка, брюссельская капуста – 5% белка, а горох, фасоль, чечевица и соевые бобы – 21-25% белка), а зерновые продукты – 7-14. % белков.
Источники белков в продуктах
Свойства белков. Физико-химические свойства белков
Белки имеют высокий
молекулярный вес.
Заряд белковой молекулы.
Все белки имеют хоть одну свободную
-NH и — СООН группы.
Белковые
растворы —
коллоидные растворы с разными свойствами.
Белки бывают кислыми и основными. Кислые
белки содержат много глу и асп, у которых
есть дополнительные карбоксильные и
меньше аминогрупп. В щелочных белках
много лиз и арг. Каждая молекула белка
в водном растворе окружена гидратной
оболочкой, так как у белков за счет
аминокислот есть много гидрофильных
группировок (-СООН, -ОН, -NH2,
-SH). В водных растворах белковая молекула
имеет заряд. Заряд белка в воде может
меняться в зависимости от РН.
Осаждение
белков. У
белков есть гидратная оболочка, заряд,
препятствующий склеиванию. Для осаждения
необходимо снять гидратную оболочку и
заряд.
1.Гидратация.
Процесс
гидратации означает связывание белками
воды, при этом они проявляют гидрофильные
свойства: набухают, их масса и объем
увеличивается. Набухание белка
сопровождается его частичным растворением.
Гидрофильность отдельных белков зависит
от их строения. Имеющиеся в составе и
расположенные на поверхности белковой
макромолекулы гидрофильные амидные
(–CO–NH–, пептидная связь), аминные (NH2)
и карбоксильные (COOH) группы притягивают
к себе молекулы воды, строго ориентируя
их на поверхность молекулы. Окружая
белковые глобулы гидратная (водная)
оболочка препятствует устойчивости
растворов белка. В изоэлектрической
точке белки обладают наименьшей
способностью связывать воду, происходит
разрушение гидратной оболочки вокруг
белковых молекул, поэтому они соединяются,
образуя крупные агрегаты. Агрегация
белковых молекул происходит и при их
обезвоживании с помощью некоторых
органических растворителей, например
этило- вого спирта. Это приводит к
выпадению белков в осадок. При изменении
pH среды макромолекула белка становится
заряженной, и его гидратационная
способность меняется.
Пептиды
Вернемся к продукту синтеза двух аминокислот — пептиду — и дадим ему определение.
Пептид — это продукт конденсации двух аминокислот или более, соединенных пептидной связью.
Пептид и белок — это одно и то же? Между ними действительно есть сходство, но есть и различия:
-
Основные различия — это структура и размер. Белки значительно больше пептидов. Пептиды состоят из 2–50 аминокислот, а белки — из более чем 50 аминокислот.
-
Пептиды менее строго определены в структуре, в то время как белки могут принимать сложные конформации.
-
Пептиды делятся на олигопептиды и полипептиды, а белок состоит из нескольких полипептидов.
Виды белков. Аминокислотный состав белков
Белки — непериодические полимеры, мономерами которых являются α-аминокислоты . Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот; неполноценными — какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми . Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными . Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Все аминокислоты содержат : 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты , имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты , имеющие более одной аминогруппы; кислые аминокислоты , имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями , так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
Структура белков
После того как мы рассмотрели все производные белков, пора переходить к структуре белков.

Как видно из рисунка, белки имеют 4 структуры: первичную, вторичную, третичную и четвертичную. Рассмотрим каждую чуть более подробно.
-
Первичная структура белка — это простейший вид белковой структуры. Представляет собой последовательность аминокислот в полипептидной цепи. Последовательность аминокислот в белке определяется ДНК, а именно геном, кодирующим этот белок. Изменение всего лишь одной аминокислоты влечет за собой последствия: например, если вместо глутаминовой кислоты в молекуле гемоглобина находится валин, то у человека образуется серповидноклеточная анемия. При замене глутаминовой кислоты на валин клетки гемоглобина вытягиваются и принимают форму месяца или серпа.
-
Вторичная структура — пространственная структура, которая образуется в результате взаимодействия функциональных групп пептидного остова (полипептидная цепь без атомов R-групп). Самые распространенные формы вторичной структуры — это α-спираль и β-лист. Обе структуры удерживают форму благодаря водородным связям между кислородом карбонильной группы одной аминокислоты и водородом аминогруппы другой аминокислоты.
-
Третичная структура — это пространственное строение всей молекулы белка, состоящей из единственной цепи. Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. Среди взаимодействий между R-группами, формирующими третичную структуру, встречаются водородные, ионные и диполь-дипольные связи, а также дисперсионные силы.
-
Четвертичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
Подробнее об основных функциях белков и их химических свойствах можно узнать из другой нашей статьи. А чтобы убедиться, что вы запомнили характеристику белков, их строение, структуру и функции, приходите на онлайн-курсы химии в школу Skysmart. Здесь вас ждут интересные факты из мира химии, интерактивные задания и опытные преподаватели, которые всегда помогут и поддержат.
Пищевая ценность белков животного и растительного происхождения
В зависимости от пищевой ценности различают:
- полноценные белки;
- частично дефектные белки;
- дефектные белки.
Полноценные белки
Полноценные белки включают те, которые содержат все необходимые (экзогенные) аминокислоты в пропорциях, обеспечивающих их максимальное использование для синтеза белков собственного тела для роста молодых организмов и поддержания баланса азота у взрослых.
Это белки животного происхождения, такие как:
- молоко и продукты из него;
- мясо животных и продукты из них;
- рыба;
- птица и яйца (кроме желатина и фибрина – белков, бедных триптофаном).
Белки животного происхождения
Частично дефектные белки
Частично дефектные белки – это те, которые могут даже содержать все незаменимые аминокислоты, но некоторые из них находятся в недостаточном количестве, и поэтому их достаточно для поддержания жизни, но не для роста организма. Например, зерновые белки со слишком низким содержанием лизина.
Дефектные белки
Большинство растительных белков менее питательны, поскольку содержат меньше лизина, триптофана, метионина и валина. Дефектные белки растительного происхождения, содержат очень мало незаменимых аминокислот или вообще не содержат хотя бы одну незаменимую аминокислоту, не полностью используются для синтеза белков организма и не обеспечивают оптимальный рост молодых организмов или поддержание азотистого баланса у взрослых, часто даже не достаточного для поддержания жизни (например, желатин).
Только белок соевых бобов и других бобовых, а также орехов имеет относительно высокую пищевую ценность, но они не могут заменить 100% полезного животного белка, например, молочного белка. Однако степень биологической ценности растительных белков очень разнообразна. Биологическая ценность диетического белка измеряется содержанием в нем экзогенной аминокислоты, которое является самым низким; содержание этой аминокислоты определяет правильный синтез белка в организме.
Важность белка для здоровья человека: дефицит белка
Дефицит белка вызывает квашиоркор (угнетение роста и созревания, гипоальбуминемия, апатия, анорексия, изменения кожи, напоминающие пеллагру, жировая инфильтрация печени).
Дефицит белков особенно опасен для детей (они вызывают задержку роста и умственного развития, похудание) и беременных женщин (белок необходим для правильного роста и развития плода, для выработки большего количества крови для матери и ребенка).
Недополучение белков в утробе матери и у младенцев тормозит физическое и умственное развитие и повышает восприимчивость к инфекционным заболеваниям. Во время грудного вскармливания белок составляет основу увеличения производства молока.
В случае дефицита белка в пище подавляются или нарушаются многие обменные процессы, анемия, иммуносупрессия, атрофия мышечной ткани, дегенеративные изменения органов, общая слабость, апатия и потеря работоспособности.
Дефицит белка может быть следствием не только его недостатка или недостаточного поступления в пищу, но также его неправильного усвоения и усвоения (например, при заболеваниях печени и почек, хронической диарее).
Белки функции. Ферменты
Стоит сказать кратко о каталитической функции белков. Ферменты или энзимы выделяют в особую группу белков. Они осуществляют катализ – ускорение протекания химической реакции.В соответствии со строением ферменты могут быть:
- простыми – содержат только аминокислотные остатки;
- сложными – помимо белкового мономерного остатка включают небелковые структуры, которые называются кофактором (витамины, катионы, анионы).
Молекулы ферментов имеют активную часть (активный центр), связывающую белок с веществом – субстратом. Каждый фермент «узнаёт» определённый субстрат и связывается именно с ним. Активный центр обычно представляет собой «карман», в который попадает субстрат.
Связывание активного центра и субстрата описывается моделью индуцированного соответствия (модель «рука-перчатка»). Модель показывает, что фермент «подстраивается» под субстрат. Благодаря изменению структуры снижаются энергия и сопротивление субстрата, что помогает ферменту легче перенести его на продукт.
Рис. 3. Модель «рука-перчатка».
Активность ферментов зависит от нескольких факторов:
- температуры;
- концентрации фермента и субстрата;
- кислотности.
Различают 6 классов ферментов, каждый из которых взаимодействует с определёнными веществами. Например, трансферазы переносят фосфатную группу от одного вещества к другому.
Ферменты могут ускорять реакцию в 1000 раз.
Что мы узнали?
Выяснили, какие функции выполняют белки в клетке, как они устроены и как синтезируются. Белки представляют собой полимерные цепочки, состоящие из аминокислот. Всего известно 200 аминокислот, но белки могут образовывать только 20. Белковые полимеры синтезируются на рибосомах. Белки выполняют важные функции в организме: переносят вещества, ускоряют биохимические реакции, контролируют процессы, происходящие в организме. Ферменты связывают субстрат и целенаправленно переносят его на вещества, ускоряя реакции в 100-1000 раз.
Польза
- Относительно низкая калорийность .
Возьмите за правило питаться белковой пищей — мясом нежирных сортов птицы и животных: индейка, курица, постная говядина, телятина, кролик. Не обязательно есть только куриную грудку без соли, от сочных, куриных ножек вас не разнесет, уж поверьте, если вы сварите или запечете в духовке без масла. Так вы будете получать незаменимые аминокислоты и удовольствие от пищи.
Таблица белков продуктах
Низкий гликемический индекс.
При употреблении пищи, богатой белками, резкий подъем сахара в крови и выброса большого количества инсулина не происходит. Хотя в очередной раз напоминаем, что для похудения это не имеет никакого значения (подробно читайте в статье «Гибкая диета или резиновая? Сложные и простые углеводы»
Чувство сытости.
Белки перевариваются дольше, чем углеводы, поэтому вы дольше ощущаете себя сытым.
Вред сушек
Диетологи всегда подчеркивают: не следует воспринимать сушку как один из вариантов похудения, подходящих большинству людей. Эту диету применяют «спортсмены» (извините, не поднимается рука бодибилдеров и фитнес бикини спортсменами называть), которые зачастую победу ставят выше собственного нормального самочувствия.
При этом нарушения хорошего самочувствия в процессе сушки — вовсе не редкость. Из-за недостаточного употребления углеводов организм ослаблен и истощен, у человека не хватает энергии на выполнение простых повседневных занятий, а длительные изматывающие тренировки забирают у него последние силы. Ограничение потребления жиров может привести к ломкости ногтей, выпадению волос и сухости кожи.
Все эти белковые диеты, сушки, диеты Аткинса — полный бред. Не вздумайте сидеть на них и портить свое здоровье! Подробнее о вреде таких диет читайте в статье «Что можно, а что нельзя есть»
Сушки и прочие супер белковые детоксы и диеты – это огромный вред для вашего организма, а те тренера, что вам их советуют – настоящие преступники ! Постоянно можно встретить на форумах вопросы от неопытных девчонок в стиле «начала худеть, пропали месячные», которые начитались про сушку у всяких фитнес бикини и решили стать как Усманова.
Так вот говорим еще раз и еще столько же раз скажем: если вы новичок в спорте, то сушить вам НЕЧЕГО .
Если вы занимаетесь дома фитнесом, зумбой, бодифлексом, йогой, по программе Джиллиан Майклс и т.д., сушить вам НЕЧЕГО.
Вам нужно сбрасывать вес, худеть, подкачиваться, все, что угодно, но только не сушиться. Сушка – удел профессиональных спортсменов бодибилдинга, нормальному, адекватному человеку это издевательство над организмом и здоровьем не нужно.
Но стоит отметить один важный нюанс. Очень редко можно встретить человека, который переедает белка (это касается всех, кто хочет похудеть или набрать мышечную массу). Как показывает практика, большинство не наоборот не получают необходимую норму белка для их организма. Как мы уже говорили, обычному человеку, не ведущему активный образ жизни необходимо 1- 1,2 гр. белка на кг веса, спортсмену 1,5 — 2гр. и более, в зависимости от вида спорта.
При эти учитывается чисто усваиваемый белок, а так как у разных белков резная усвояемость, можно сделать вывод, чтв большинства из нас не дополучают необходимую норму протеина.
Роль белков в организме человека
Белки в организме играют очень важную и незаменимую роль.
- Они используются для построения новых и восстановления изношенных клеток и тканей (без их участия рост, развитие организма, обновление тканей, устойчивость к заболеваниям, заживление ран невозможны).
- Являются основным компонентом крови, лимфы и молока.
- Являются частью иммунных тел, ферментов, катализирующих биохимические изменения, и жидкостей организма.
- Участвуют в регулировании артериального давления и поддержании кислотно-щелочного баланса.
- Действуют как переносчики некоторых витаминов и минералов.
- Сжигаясь, они снабжают организм энергией (1 г белка = 4 ккал).
Белки биохимия. Амфотерность
Так как белки содержат кислые и основные аминокислоты, то в их составе всегда имеются свободные кислые (СОО–) и основные (NH3+) группы.
Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении рН, и отрицательно при его увеличении. Если рН раствора соответствует изоэлектрической точке белка, то заряд белка равен 0.
Если в пептиде или белке преобладают основные аминокислоты (лизин и аргинин), то при нейтральных рН заряд белка положительный, т.к. обусловлен положительным зарядом радикала этих аминокислот.
Если в белке преобладают кислые аминокислоты (глутамат и аспартат), то белок кислый, при нейтральных рН заряд белка отрицательный и изоэлектрическая точка находится в кислой среде. Для большинства природных белков изоэлектрическая точка находится в диапазоне рН 4,8-5,4, что свидетельствует о преобладании в их составе глутаминовой и аспарагиновой аминокислот.
Амфотерность имеет значение для выполнения белками некоторых функций. Например,белков, т.е. способность поддерживать стабильность рН крови , основаны на способности присоединять ионы Н+при закислении среды или отдавать их при защелачивании.
С практической стороны наличие амфотерности позволяет разделять белки по заряду ( электрофорез ) или использовать изменение величины рН раствора для осаждения какого-либо известного белка. Наличие как положительных, так и отрицательных зарядов в белке обусловливает их способность к, что удобно для выделения белков в нативной (живой) конформации.
Что такое белок. Химический состав и образование белков
Белки — это высокомолекулярные органические соединения, которые состоят из аминокислотных остатков, соединенных между собой пептидной связью
Важно уточнить, что в состав белков входит только 20 альфа-аминокислот, тогда как всего ученым известно около 500 аминокислот. Общая формула белков выглядит следующим образом:

Греческая приставка «альфа-» в названиях альфа-аминокислот взялась из систематической номенклатуры. По ее правилам, следующий после карбоксильной группы углерод получает название первой буквы греческого алфавита — альфа, затем идет буква бета и так далее. В названии аминокислоты указывается греческая буква того углерода, у которого есть заместитель, в данном случае — аминогруппа.
Рассмотрим пример образования молекулы белка. Для этого познакомимся сначала с представителем альфа-аминокислот — альфа-аминопропановой кислотой.
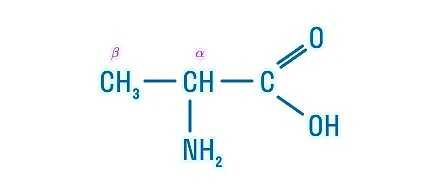
Рассматривая строение молекулы, можно увидеть две конкурирующие по свойствам группы: карбоксильную, которая отвечает за кислотные свойства, и аминогруппу, которая отвечает за оснóвные свойства. Две молекулы аминокислот и более могут вступать в реакцию между собой, реагируя по разным функциональным группам. Именно таким образом получается пептид:

Соединение, которое образуется в результате взаимодействия двух аминокислот, называется дипептидом. Благодаря наличию двух свободных функциональных групп (карбоксильной и аминогруппы) дипептид может взаимодействовать с другими аминокислотами, увеличивая свое строение и превращаясь в полипептид.
Какие бывают белки
По строению
По строению белки делятся на простые (протеины) и сложные (протеиды):
-
составными частями простых белков являются в большинстве 20 различных остатков α–аминокислот;
-
сложные белки могут содержать ионы металлов или образовывать комплексные соединения с углеводами, липидами и др.
По форме молекулы
По форме молекулы белки подразделяются на глобулярные и фибриллярные:
-
форма молекулы глобулярных белков — глобула (сфера или эллипс). Например, альбумин (яичный белок), казеин (молочный белок). Такие белки растворимы в воде;
-
форма молекулы фибриллярных белков — фибрилла (нити или волокна). Например, кератин (волосы, ногти, перья), коллаген (мускулы, сухожилия). Эти белки в воде не растворяются.
По аминокислотному составу
Как мы уже знаем, существуют незаменимые аминокислоты. Так вот, исходя из их наличия, белки бывают либо полноценные, либо неполноценные:
-
к полноценным относятся белки животного происхождения, также полноценные белки содержат некоторые растения: картофель, бобовые и другие;
-
к неполноценным относятся желатин и белки преимущественно растительного происхождения.
По растворимости
Растворимость белков зависит от их структуры, величины рН, солевого состава раствора, температуры и определяется природой тех групп, которые находятся на поверхности белковой молекулы.
Так, существуют белки (глобулины), которые растворяются только в растворах солей и не растворяются в чистой воде, а противоположные им альбумины хорошо растворимы в чистой воде.
К нерастворимым белкам относятся кератин (волосы, ногти, перья), коллаген (сухожилия), фиброин (шелк, паутина).
Чтобы запомнить классификацию белков было проще, показали ее на картинке:

Белок в вегетарианской диете
Знание аминокислотного состава отдельных белков позволяет разрабатывать комбинации белков чисто растительного происхождения или растительных продуктов с небольшими добавками животного белка (яйца, молоко), питательная ценность которых становится высокой.
Правильная комбинация, по крайней мере, двух типов растительного белка в пище может дополнить недостающие или недостаточные аминокислоты в одном белке теми же аминокислотами, которые в больших количествах содержатся в других белках, например, бобовые содержат много лизина, но мало метионина. а в злаках не хватает лизина и триптофана. Его дополняют почти все овощи, богатые лизином и триптофаном.
Составляя состав дневного рациона, не забывайте максимально пополнять белки (максимум с интервалом 4–6 часов). Во время более длительных перерывов между приемами пищи недостающие аминокислоты не восполняются, а часть белка расходуется на энергетические цели.
Можно ли получить достаточно полноценного белка на вегетарианской или веганской диете?
Многие считают, что из-за низкого содержания в вегетарианской и веганской диете белков животного происхождения им часто не хватает «полноценного» белка. Однако, это случается очень редко.
В настоящее время нет никаких доказательств белковой недостаточности среди вегетарианцев или веганов, за исключением, возможно, небольшого процента тех, кто потребляет слишком мало калорий или придерживается однообразных или ограниченных схем питания, таких как фруктовые диеты или диеты на основе картофеля ().
Тем не менее белок, содержащийся в растениях, может быть немного сложнее для усваивания вашим организмом по сравнению с белком из мяса и других продуктов животного происхождения.
Вот почему вегетарианцам и веганам иногда рекомендуется есть немного больше белка, чем мясоедам, то есть около 0,5 грамма на фунт (1 грамм на кг) в день ().
Тем не менее, текущие данные свидетельствуют о том, что эта разница в абсорбции, вероятно, минимальна, чтобы вегетарианцы или веганы получали недостаточное количество незаменимых аминокислот из своего рациона ().
Короче говоря, до тех пор, пока растительная диета остается достаточно калорийной и предлагает большое разнообразие источников белка, нет особых причин беспокоиться о том, что вы получите слишком мало «полноценного» белка на вегетарианской или веганской диете.
Вывод: вегетарианцам и веганам не составит труда получить достаточное количество «полноценного» белка из своего рациона, пока он остается разнообразным и достаточно калорийным.
Белки животного и растительного происхождения
При правильном питании взрослого человека половину необходимого количества белка должны составлять животные белки, а другая половина – белок, полученный из растительной пищи. В питании детей и подростков, а также беременных и кормящих женщин белки животного происхождения должны составлять 2/3 необходимого количества белка во всем дневном рационе.
Комбинируя продукты растительного и животного происхождения в одном приеме пищи, вы получаете ценные по аминокислотному составу продукты. Белки цельного молока прекрасно дополняют, например, неполные белки из зерновых продуктов, бедных лизином, треонином и триптофаном. Например, хлопья с молоком или молочный суп с лапшой, манная крупа в молоке.
В молочных продуктах (например, твороге и сычужных сырах) содержание серных аминокислот (метионина и цистеина) несколько ниже. Гораздо сложнее получить высокую биологическую ценность протеина (т.е.возможность использовать его для синтеза протеина тела) в веганской или вегетарианской диете, где необходимо правильно комбинировать растительные продукты.
Белок в молочных продуктах






























