Химические свойства сероводорода
Горение
На воздухе сероводород горит голубым пламенем. Процесс может протекать в двух направлениях:
-
Полное горение. Продукты реакции — диоксид серы и вода:
2H2S + 3O2 → 2SO2 + 2H2O.
-
Если внести в пламя сероводорода холодный предмет, например фарфоровую чашку, температура пламени значительно снизится и сероводород окислится до свободной серы, оседающей на чашке в виде желтого налета:
2H2S + O2 → 2S + 2H2O.
Растворимость в воде
Сероводород растворим в воде. Его раствор называют сероводородной водой или сероводородной кислотой. Формула сероводородной кислоты — H2S. Если кислота долго находится на воздухе и особенно на свету, она мутнеет, т. к. сера окисляется.
Сероводородная кислота — это слабая кислота, она диссоциирует ступенчато, в основном диссоциация протекает по первой ступени:
-
H2S ⇄ H+ + HS−.
-
HS− ⇄ H+ + S2−.
Свойства кислот
Так как раствор сероводорода является кислотой, то для него характерны свойства кислот:
-
изменение цвета индикатора — лакмус становится розовым в растворе сероводорода;
-
взаимодействие с активными металлами:
H2S + Mg → MgS + H2;
-
раствор сероводорода реагирует с :
H2S + BaO → BaS + H2O;
-
взаимодействие со щелочами:
H2S + NaOH → NaHS + H2O;
H2S + 2NaOH → Na2S + 2H2O;
-
сероводородная кислота может вступать в реакции обмена с солями, если одним из продуктов реакции будет нерастворимый сульфид:
H2S + CuCl2 → CuS↓ + 2HCl.
Раствор сероводородной кислоты взаимодействует с :
H2S + 2NH3 → (NH4)2S.
Сероводород может окислять малоактивные металлы в присутствии кислорода:
4Ag + 2H2S + O2 → 2Ag2S + 2H2O.
Сероводород вступает в реакции с галогенами:
H2S + Cl2 → S + 2HCl.
Качественные реакции
Качественная реакция на сероводород — бумага, смоченная раствором нитрата свинца (II), чернеет в присутствии сероводорода:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3.
Восстановительные свойства
В молекуле сероводорода сера имеет низшую степень окисления, следовательно, сероводород проявляет свойства сильного восстановителя. При взаимодействии с сильнейшими окислителями он окисляется до серы, оксида серы (IV) или серной кислоты. Полнота окисления зависит от условий протекания химической реакции: температуры, pH раствора и концентрации окислителя:
-
в реакции с бромной водой наблюдается обесцвечивание раствора:
H2S + 4Br2 + 4H2O → H2SO4 + 8HBr;
-
окисление сероводорода подкисленным раствором перманганата калия:
5H2S + 2KMnO4 + 3H2SO4 → 5S + K2SO4 + 2MnSO4 + 8H2O;
-
сероводород в кислой среде реагирует с дихроматом калия:
3H2S + K2Cr2O7 + 4H2SO4 → K2SO4 + Cr2(SO4)3 + 3S + 7H2O;
-
взаимодействие с кислотами-окислителями (HNO3, H2SO4):
3H2S + 8HNO3 (разб) → 3H2SO4 + 8NO + 4H2O;
H2S + 8HNO3 (конц) → H2SO4 + 8NO2 + 4H2O;
H2S + H2SO4 (конц) → S + SO2 + 2H2O.
Сероводород
Строение молекулы и физические свойства
Сероводород H2S – это бинарное соединение водорода с серой, относится к летучим водородным соединениям. Следовательно, сероводород бесцветный ядовитый газ, с запахом тухлых яиц. Образуется при гниении. В твердом состоянии имеет молекулярную кристаллическую решетку.
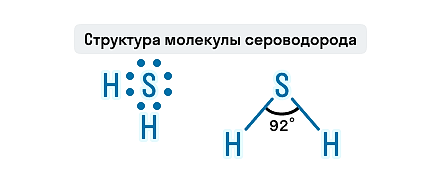
Геометрическая форма молекулы сероводорода похожа на структуру воды — уголковая молекула. Но валентный угол H-S-H меньше, чем угол H-O-H в воде и составляет 92,1 о .
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Источник
Сероводород в природе и жизнедеятельности человека
Сероводород входит в состав вулканических газов, природного газа и газов, сопутствующих месторождениям нефти. Много его и в природных минеральных водах, например, в Черном море он залегает на глубине от 150 метров и ниже.
Сероводород применяют:
- в медицине (лечение сероводородными ваннами и минеральными водами);
- в промышленности (получение серы, серной кислоты и сульфидов);
- в аналитической химии (для осаждения сульфидов тяжелых металлов, которые обычно нерастворимы);
- в органическом синтезе (для получения сернистых аналогов органических спиртов (меркаптанов) и тиофена (серосодержащего ароматического углеводорода).Еще одно из недавно появившихся направлений в науке — сероводородная энергетика. Всерьез изучается получение энергии из залежей сероводорода со дна Черного моря.
Химические свойства сероводорода.
Сероводород H2S – ковалентное соединение, не образующее водородных связей, как молекула Н2О. (Разница в том, что атом серы больший по размеру и более электроотрицательный, чем атом кислорода. Поэтому плотность заряда у серы меньше. И из-за отсутствия водородных связей температура кипения у H2S выше, чем у кислорода. Также H2S плохо растворим в воде, что также указывает на отсутствие водородных связей).
2. Сероводород H2S – очень слабая кислота, в растворе ступенчато диссоциирует:
3. Взаимодействует с сильными окислителями:
4. Реагирует с основаниями, основными оксидами и солями, при этом образуя кислые и средние соли (гидросульфиды и сульфиды):
Эту реакцию используют для обнаружения сероводорода или сульфид-ионов. PbS – осадок черного цвета.
Сероводород — что это за вещество
В районе некоторых минеральных источников, например, пятигорских или в районе Мацесты, отчетливо ощущается запах тухлых яиц. Объясняется это содержанием опасного вещества – сероводорода. В концентрациях 0,2 – 0,3 мг/л он может вызвать отравление человека, а в более высоких концентрациях – даже смерть.
Сероводород – это газ, имеющий химическую формулу Он не имеет цвета, но характеризуется резким неприятным запахом. В воде растворяется плохо, термически устойчив в температурном диапазоне до 400оС.
Вступая в реакцию с металлами, особенно во влажной среде, провоцирует коррозийные процессы, а в смеси с воздухом в концентрации 4 – 45% об взрывоопасен.
Сероводородом богаты вулканические газы, а также подземные сероводородные источники. Образуется в результате гниения остатков органических веществ. Особенно много его выделяется при гниении белков. В их состав могут входить остатки метионина и цистеина, аминокислот, содержащих серу.
Сероводород присутствует в сточных водах, содержимом выгребных ям и прочих аналогичных образованиях. Однако накопления в воздухе его не происходит, поскольку, вступая в реакцию с кислородом воздуха, он окисляется. Нередко этот газ обнаруживается в составе сланцевых газов, а также в нефти, в т.ч. сланцевой.
В морях, например, в Черном, сероводород обнаруживается на глубине 150 – 200 м. Здесь он присутствует в растворенном состоянии в концентрациях 14 мл/л
Биологическая роль
Сероводород может образовываться и в организме человека, правда, в незначительных количествах. При помощи специальных ферментов он синтезируется из цистеина и обладает спазмолитическими свойствами. Расслабляя гладкую мускулатуру, он может снимать боль и лечить воспалительные процессы, вызванные сосудистой патологией.
В клеточных митохондриях происходит его окисление до сульфит-ионов и сульфат-ионов, которые выделяются из организма с мочой.
С медицинской точки зрения сероводород эндогенного происхождения – хорошее профилактическое средство от заболеваний сердечно-сосудистой системы. Он способен расширять мелкие кровеносные сосуды и оказывать цитопротективное действие.
В то же время даже небольшое содержание его в воздухе способно вызвать головную, боль, тошноту, головокружение. При увеличении концентрации развивается кома, отек легких, судороги и даже смерть. При вдыхании воздуха с высокой концентрацией , обонятельный нерв может полностью парализоваться. Тогда ощущение неприятного запаха отсутствует и вдыхаемая концентрация может вырасти до смертельной.
Пороговым нормативом для сероводорода в воздухе является .
Реактивность и опасности
H2S считается стабильным соединением, хотя он легко воспламеняется и чрезвычайно токсичен.
Смесь тяжелее воздуха и может перемещаться на значительное расстояние от источника возгорания и обратно. Может образовывать взрывоопасные смеси с воздухом в широком диапазоне.
Он также вступает в взрывную реакцию с пентафторидом брома, трифторидом хлора, трийодидом азота, трихлоридом азота, дифторидом кислорода и хлоридом фенилдиазония.
При нагревании до разложения он выделяет высокотоксичные пары оксидов серы. Несовместим со многими материалами, включая сильные окислители, металлы, сильную азотную кислоту, пентафторид брома, трифторид хлора, трийодид азота, трихлорид азота, дифторид кислорода и хлорид фенилдиазония.
Сероводород (H2S) несет ответственность за многие случаи профессионального токсического воздействия, особенно в нефтяной промышленности. Клинические эффекты Н2S зависит от его концентрации и продолжительности воздействия.
H2S немедленно приводит к смертельному исходу, когда концентрации превышают 500-1000 частей на миллион (ppm), но воздействие более низких концентраций, таких как 10-500 ppm, может вызывать различные респираторные симптомы, начиная от ринита до острой дыхательной недостаточности..
H2S также может поражать несколько органов, вызывая временные или постоянные нарушения в нервной, сердечно-сосудистой, почечной, печеночной и гематологической системах..
Представлен случай профессионального воздействия H2Это приводит к поражению нескольких органов, острой дыхательной недостаточности, организации пневмонии и шока, сходных с острым сепсисом. В этом случае у пациента также развилось легкое обструктивное и рестриктивное заболевание легких и периферическая невропатия (Al-Tawfiq, 2010).
ингаляция
В случае вдыхания выносите его на улицу и держите в покое в удобном для дыхания положении. Если не дышите, примените искусственное дыхание. Если дыхание затруднено, обученный персонал должен дать кислород.
Контакт с кожей
При попадании на кожу ее следует промыть большим количеством воды. Жидкость под давлением может вызвать обморожение. В случае воздействия жидкости под давлением зону замораживания следует немедленно нагреть теплой водой, не превышающей 41 ° C..
Температура воды должна быть терпимой к нормальной коже. Прогревание кожи следует поддерживать в течение не менее 15 минут или до тех пор, пока в пораженный участок не вернется нормальная окраска и ощущение. В случае массивного воздействия одежду снимают во время душа теплой водой.
Зрительный контакт
В случае попадания в глаза тщательно промыть глаза водой не менее 15 минут. Держите веки открытыми и подальше от глазных яблок, чтобы убедиться, что все поверхности тщательно промыты..
Проглатывание не считается возможным путем воздействия. Во всех остальных случаях требуется немедленная медицинская помощь (Praxair, 2016).
Вопросы для самопроверки
-
Охарактеризуйте физические свойства сульфида водорода.
-
Перечислите свойства сероводородной кислоты. От чего зависит образование сульфидов и гидросульфидов?
-
Схеме превращений S−2 → S+4 соответствует уравнение:
-
2H2S + O2 → S + 2H2O
-
H2SO3 + H2O2 → H2SO4 + H2O
-
PbS + 4H2O2 → PbSO4 + 4H2O
-
2H2S + 3O2 → 2SO2 + 2H2O
-
-
Составьте уравнения четырех реакций, которые могут протекать между NaOH, H2S, CuCl2.
-
Верны ли следующие суждения?
А. Сероводород при взаимодействии со щелочами образует два вида солей: средние и кислые.
Б. Сероводород — восстановитель.
-
Верно только А
-
Верно только Б
-
Оба верны
-
Оба неверны
-
Сероводород, формула, молекула, строение, состав, вещество:
Сероводород (сернистый водород, сульфид водорода, дигидросульфид) – бесцветный газ со сладковатым вкусом с характерным неприятным тяжёлым запахом тухлых яиц (тухлого мяса).
Сероводород – бинарное химическое соединение водорода и серы, имеющее формулу H2S.
Химическая формула сероводорода H2S.
Строение молекулы сероводорода, структурная формула сероводорода:
Сероводород – наиболее активное из серосодержащих соединений.
Сероводород тяжелее воздуха. Его плотность составляет 1,539 кг/м 3 , по отношении к воздуху – 1,19. Поэтому скапливается в низких непроветриваемых местах.
Сероводород плохо растворяется в воде. Раствор сероводорода в воде – очень слабая сероводородная кислота. Хорошо растворим в бензоле, этаноле, бромэтане, гексане, додекане, октане, толуоле, трихлорэтилен, хлорбензоле.
Термически устойчив при температурах менее 400 °C. При температурах более 400 °C разлагается на составляющие – простые вещества: водород и серу.
В отличие от воды, в сероводороде не образуются водородные связи, поэтому сероводород в обычных условиях не сжижается.
Сероводород является сверхпроводником при температуре 203 К (-70 °C) и давлении 150 ГПа.
Сероводород коррозионно активен, поэтому предъявляются дополнительные требования при разработке нефтяных, газовых и газоконденсатных месторождений, содержащий сероводород.
Чрезвычайно огнеопасен. Смеси сероводорода и воздуха взрывоопасны. Возможно возгорание на расстоянии. Горит синим пламенем.
Соли сероводородной кислоты (раствор сероводорода в воде) называют сульфидами. В воде хорошо растворимы только сульфиды щелочных металлов , аммония. Сульфиды остальных металлов практически не растворимы в воде, они выпадают в осадок в ходе химических реакций. Многие сульфиды ярко окрашены. Многие природные сульфиды в виде минералов являются ценными рудами (пирит, халькопирит, киноварь, молибденит).
Сероводород в природе встречается редко, в незначительных количествах в составе природного газа, попутного нефтяного газа, сланцевого газа, а также в вулканических газах, в растворённом виде – в нефти , сланцевой нефти и в природных водах. Например, в Чёрном море слои воды, расположенные глубже 150-200 м, содержат растворённый сероводород (концентрация 14 мл/л).
Образуется при гниении белков, которые содержат в составе серосодержащие аминокислоты метионин и (или) цистеин. Небольшое количество сероводорода содержится в кишечных газах человека и животных.
Сероводород высокотоксичен и ядовит. Предельно допустимая концентрация (ПДК) сероводорода в воздухе населенных пунктов в России – 0,008 мг/м 3 , в России – 0,007 мг/м 3 .
Порог ощутимости запаха составляет 0,012-0,03 мг/м 3 . При вдыхании воздуха с небольшими концентрациями у человека довольно быстро возникает адаптация к неприятному запаху «тухлых яиц» и он перестаёт ощущаться. Во рту возникает сладковатый металлический привкус. При вдыхании воздуха с большой концентрацией из-за паралича обонятельного нерва запах сероводорода почти сразу перестаёт ощущаться.
При острых отравлениях возникает жжение и боль в горле при глотании, конъюнктивит, одышка, головная боль, головокружение, слабость, рвота, тахикардия, возможны судороги. Смертельная концентрация составляет 830 мг/м 3 в течение 30 минут или 1100 мг/м 3 в течение 5 минут.
При высокой концентрации сероводорода однократное вдыхание может вызвать мгновенную смерть.
приложений
1- Производство серы
Установка извлечения серы Claus состоит из печи сгорания, котла-утилизатора, конденсатора серы и ряда каталитических ступеней, каждая из которых использует подогрев, слой катализатора и конденсатор серы. Обычно используются две или три каталитические стадии.
Процесс Клауса превращает сероводород в элементарную серу посредством двухстадийной реакции.
Первая стадия включает контролируемое сгорание исходного газа для превращения приблизительно одной трети сероводорода в диоксид серы и некаталитическую реакцию сероводорода, не сгоревшего с диоксидом серы..
На второй стадии реакции Клауса сероводород и диоксид серы реагируют на катализаторе с образованием серы и воды.
Количество воздуха для горения строго контролируется, чтобы максимизировать извлечение серы, то есть поддержание соответствующей реакционной стехиометрии от сероводорода 2: 1 до диоксида серы через последующие реакторы.
Как правило, извлечение серы может достигать 97% (Национальная медицинская библиотека США, 2011).
2- Аналитическая химия
Уже более века сероводород играет важную роль в аналитической химии, в качественном неорганическом анализе ионов металлов..
В этих анализах ионы тяжелых металлов (и неметаллов) осаждаются (например, Pb (II), Cu (II), Hg (II), As (III)) из раствора после воздействия H2S. Полученный осадок снова растворяется с некоторой селективностью и, таким образом, идентифицируется.
3- Другое использование
Это соединение также используется для отделения оксида дейтерия или тяжелой воды от обычной воды с помощью процесса сульфида Гирдлера..
Ученые из Университета Эксетера обнаружили, что клеточное воздействие небольшого количества сероводорода может предотвратить повреждение митохондрий.
Когда клетка подвергается стрессу из-за болезни, ферменты притягиваются к клетке, образуя небольшое количество сероводорода. Это исследование может иметь больше последствий в профилактике инсультов, болезней сердца и артрита (Stampler, 2014).
Сероводород может обладать антивозрастными свойствами, блокируя разрушительные химические вещества в клетке, имея свойства, подобные ресвератролу, антиоксиданту, обнаруженному в красном вине.
ссылки
- Агентство по регистрации токсичных веществ и заболеваний. (3 марта 2011 г.). Сероводород Карбонилсульфид. Получено от atsdr.cdc.gov.
- Аль-Тауфик, Б. Д. (2010). Воздействие сероводорода у взрослого мужчины. Летопись саудовской мед. 30 (1) , 76-80.
- EMBL-EBI. (2005, 13 декабря). сероводород. Восстановлено с ebi.ac.uk.
- Британская энциклопедия. (S.F.). Сероводород. Восстановлено с britannica.com.
- База данных метаболома человека. (2017, 2 марта). Сероводород . Получено с hmdb.ca.
- ВОДОРОДНЫЙ СУЛЬФИД. (2016). Получено с сайта cameochemicals.noaa.gov.
- (2016, 17 октября). Паспорт безопасности сероводорода. Восстановлено от praxair.com.
- Королевское химическое общество. (2015). Сероводород. Получено с chemspider.com.
- Стамплер Л. (2014, 11 июля). Исследование показывает, что вонючее соединение может защищать от повреждения клеток. Получено с time.com.
- С. Национальная медицинская библиотека. (2011, 22 сентября). Сера, Элементаль. Получено с toxnet.nlm.nih.gov.
Строение и физические свойства сероводорода
Сероводород — это бесцветный газ с характерным запахом тухлых яиц, сладкий на вкус, тяжелее воздуха. Малорастворим в воде, хорошо растворим в спирте. На воздухе легко воспламеняется. Очень ядовит.
Вдыхание паров сероводорода даже в малых количествах может привести к тяжелому отравлению. Признак сильного отравления парами сероводорода — потеря обоняния, перестает ощущаться характерный неприятный запах газа.
Противоядия при отравлении сероводородом — вещества-окислители. При слабом отравлении необходимо выйти на свежий воздух, то есть повысить концентрацию вдыхаемого кислорода
В случае более сильного отравления полезно очень осторожно вдохнуть пары хлора
Состав H2S представлен двумя элементами-неметаллами, атомы которых связаны ковалентной полярной связью. Молекула этого газа имеет угловое строение, этим она схожа с молекулой воды, но по сравнению с водой в молекуле сероводорода слабые водородные связи. Связи S—H образуют валентный угол, равный 92,1о, как показано на структурной формуле сероводорода.
Знание физических свойств сульфида водорода может спасти кому-то жизнь, и это не единственное применение химической теории на практике. На курсах подготовки к ОГЭ по химии в онлайн-школе Skysmart ученики не только разбирают задания экзамена, но и учатся применять полученные знания в реальной жизни.
Применение
Сероводород из-за своей токсичности находит ограниченное применение.
- В аналитической химии сероводород и сероводородная вода используются как реагенты для осаждения тяжёлых металлов, сульфиды которых очень слабо растворимы.
- В медицине — в составе природных и искусственных сероводородных ванн, а также в составе некоторых минеральных вод.
- Сероводород применяют для получения серной кислоты, элементной серы, сульфидов.
- Используют в органическом синтезе для получения тиофена и меркаптанов.
- В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического (сероводородная энергетика) и химического сырья.
Немного цифр
По степени воздействия на организм вредные вещества подразделяются на четыре класса опасности: 1-й – вещества чрезвычайно опасные; 2-й – вещества высокоопасные; 3-й – вещества умеренно опасные; 4-й – вещества малоопасные.
Сероводороду (H2S) — наиболее активному из серосодержащих соединений — присвоен второй класс опасности. По данным ВОЗ (Всемирной Организации Здравоохранения), он входит в перечень самых распространённых и наиболее опасных загрязнителей окружающей среды наряду с дихлорметаном, формальдегидом, стиролом, толуолом, мышьяком, окисью углерода, свинцом, фтором, ртутью т.п. Сероводород считается одним из самых нежелательных компонентов нефтепереработки.
В случае выброса предприятием этого отхода в окружающую среду может быть возбуждено дело, что наглядно продемонстрировал недавний случай с московским нефтеперерабатывающим заводом в Капотне, который подозревают в «обогащении» столичного воздуха сероводородом в количестве, превысившем ПДК (предельно допустимая концентрация) в 51(!) раз. Многочисленные жалобы населения на неприятный запах из окон, резь в глазах и привкус во рту и произведённые затем замеры воздуха не смогли оставить равнодушным даже видавший всякое Росприроднадзор.
Сероводород хорошо растворим в воде. Диапазон взрывоопасных концентраций в смеси его с воздухом достаточно широк и составляет от 4 до 45% об. При контакте с металлами (особенно если в газе содержится влага), сероводород вызывает сильную коррозию. Предельно допустимая концентрация сероводорода (H2S) в воздухе в рабочей зоне—10 мг/м3 (кубометр), в смеси с углеводородами —3 мг/м3.
Предельно допустимая норма сероводорода (H2S) в воздухе населенных мест—0,008 мг/м3 (миллиграмм на кубический метр)
Ощутимый запах сероводорода отмечается при концентрации 1,4—2,3 мг/м3, значительный запах —при 4 мг/м3, тяжелый запах при 7—11 мг/м3.
Бесцветный газ с неприятным запахом тухлых яиц, не только ядовит, но и коварен: при очень высоких концентрациях он уже после первых вдохов блокирует обонятельный нерв, и человек перестаёт чувствовать этот запах после того, как тот «ударил в нос». Острое отравление наступает уже при концентрациях 0,2–0,3 мг/л, а концентрация выше 1 мг/л — смертельна.
Смертельная концентрация этого газа в воздухе очень мала – всего 0,1%. Такое количество сероводорода может привести человека к летальному исходу за 10 минут. Стоит лишь немного увеличить концентрацию – и смерть наступает мгновенно, после первого же вдоха. Для примера: в канализационной системе концентрация сероводорода иногда достигает 16%.
Если речь идёт о незамкнутом помещении, сероводород не действует так резко и внезапно, не застаёт жителей врасплох. Однако, человеку свойственно привыкать к любому запаху, это некоторая защитная реакция нашего организма (например, жители мегаполисов не замечают специфический запах в метро, не замечают запах выхлопных газов, но при этом очень впечатляются свежестью приморского воздуха, будучи в отпуске). Именно с этим явлением сталкиваются периодически жители больших городов по всему миру, и в частности, Москвы, где в некоторых районах подобный запах – привычное дело.
Что касается промзон и градообразующих предприятий, известно, что люди, работающие или живущие в непосредственной близости от заводов с сероводородными (и иными) выбросами (в концентрациях от 0,02%), испытывают так называемое хроническое отравление. Выражается это, как правило, в стабильно плохом самочувствии, головных болях, потере веса, металлическом привкусе во рту (тревожный сигнал, посылаемый печенью), неприятными ощущениями в груди и даже обмороками, обострениях хронических заболеваний.
Поскольку экзогенный (вызываемый внешними причинами) сероводород попадает в организм через дыхательные пути, первый удар всегда принимает слизистая оболочка. Этот газ плохо действует и на глаза: может вызвать конъюнктивит, спровоцировать светобоязнь, раздражение слизистой оболочки глаз, снижение остроты зрения.
Химические свойства
Сероводород взаимодействует с кислородом воздуха, горит он голубоватым цветом. В случае полного сгорания продуктами реакции являются оксид серы (4) и вода. Учитывая, что печной газ является кислотным оксидом, в растворе он образует слабую сернистую кислоту, окрашивающую синюю лакмусовую бумажку в красный цвет.
В случае недостаточного количества сероводорода образуется кристаллическая сера. Данный процесс считается промышленным способом получения из сероводорода чистой серы.
У данного химического вещества выявлены и отличные восстановительные способности. Они проявляются, к примеру, при взаимодействии с солями, галогенами. Для того чтобы провести в лабораторных условиях подобную реакцию, в пробирки с хлором и бромом наливают раствор сероводорода, наблюдают обесцвечивание. В качестве продукта реакции наблюдают образование кристаллической серы.
При химической реакции сероводорода с водой происходит образование катиона гидроксония Н3О+.
Сероводород способен образовывать два вида соединений: сульфиды (средние соли) и гидросульфиды (кислые соли).
У щелочных и щелочноземельных металлов сульфиды являются бесцветными соединениями. У тяжелых металлов (меди, никеля, свинца) они имеют черный цвет. Сульфид марганца обладает розовым цветом. Многие соли не растворяются в воде.
Качественной реакцией на сульфиды считают взаимодействие с раствором сульфата меди (2). Продуктом подобного взаимодействия будет выпадение черного осадка сульфида меди (2).
Физические свойства
Дигидросульфид – бесцветный газ с запахом протухших яиц и сладковатым вкусом. Это ядовитое вещество, опасное в больших концентрациях. Благодаря молекулярному строению в обычных условиях сернистый водород не сжижается.
Общие физические свойства сернистого водорода:
- плохо растворяется в воде;
- проявляет свойства сверхпроводника при температуре -70°С и давлении 150ГПа;
- огнеопасен;
- растворяется в этаноле;
- сжижается при -60,3°С;
- превращается в твёрдое вещество при -85,6°С;
- плавится при -86°С;
- кипит при -60°С;
- разлагается на простые вещества (серу и водород) при 400°С.
При обычных условиях можно приготовить раствор сероводорода (сероводородную воду). Однако сернистый водород не вступает в реакцию с водой. На воздухе раствор быстро окисляется и мутнеет из-за выделения серы. Сероводородная вода проявляет слабые свойства кислоты.
 Рис. 2. Сероводородная вода.
Рис. 2. Сероводородная вода.

