Физические свойства
Фенолы — малорастворимы в воде, но хорошо растворяются в спирте, эфире, бензоле, с водой образуют кристаллогидраты, перегоняются с водяным паром. На воздухе сам фенол легко окисляется и темнеет. Введение в пара- положение молекулы фенола таких заместителей, как галоиды, нитрогруппы и др. значительно повышает температуру кипения и температуру плавления соединений:
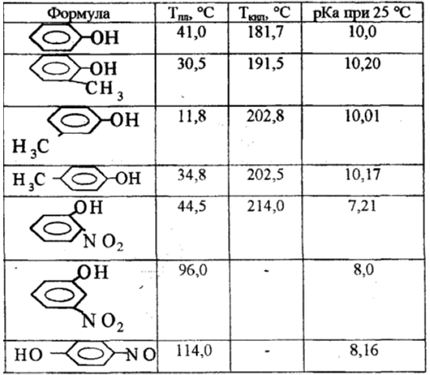 Рисунок 1.
Рисунок 1.
Фенолы — полярные вещества с дипольным моментом $\mu$ = 1,5-1,6 $D$. Значение $EI$ 8,5-8,6 эВ свидетельствует о больших донорных свойствах фенолов по сравнению с такими аренами, как бензол (9,25 эВ), толуол (8,82 эВ), этилбензол (8,76 эВ). Это связано со взаимодействием гидроксильной группы с $\pi$-связями бензольного ядра благодаря положительному $M$-эффекту $OH$-группы, преобладает ее негативный $I$ -эффект.
Реакции окисления
Спирты легко вступают в реакцию горения. При этом образуется большое количество тепла:
2СН3-ОН + 3O2 = 2CO2 + 4H2O + Q
Неполное окисление
Неполное окисление первичных спиртов может приводить к образованию альдегидов и карбоновых кислот.
В случае неполного окисления вторичных спиртов возможно образование только кетонов.
Неполное окисление спиртов возможно при действии на них различных окислителей, например, таких, как кислород воздуха в присутствии катализаторов (металлическая медь), перманганат калия, дихромат калия и т.д.
При этом из первичных спиртов могут быть получены альдегиды. Как можно заметить, окисление спиртов до альдегидов, по сути, приводит к тем же органическим продуктам, что и дегидрирование:
Следует отметить, что при использовании таких окислителей, как перманганат калия и дихромат калия в кислой среде возможно более глубокое окисление спиртов, а именно до карбоновых кислот. В частности, это проявляется при использовании избытка окислителя при нагревании. Вторичные спирты могут в этих условиях окислиться только до кетонов.
ПРЕДЕЛЬНЫЕ МНОГОАТОМНЫЕ СПИРТЫ
Замещение атомов водорода гидроксильных групп
Многоатомные спирты так же, как и одноатомные реагируют со щелочными, щелочноземельными металлами и алюминием (очищенным от пленки Al2O3); при этом может заместиться разное число атомов водорода гидроксильных групп в молекуле спирта:
2. Поскольку в молекулах многоатомных спиртов содержится несколько гидроксильных групп, они оказывают влияние друг на друга за счет отрицательного индуктивного эффекта. В частности, это приводит к ослаблению связи О-Н и повышению кислотных свойств гидроксильных групп.
Большая кислотность многоатомных спиртов проявляется в том, что многоатомные спирты, в отличие от одноатомных, реагируют с некоторым гидроксидами тяжелых металлов. Например, нужно запомнить тот факт, что свежеосажденный гидроксид меди реагирует с многоатомными спиртами с образованием ярко-синего раствора комплексного соединения.
Так, взаимодействие глицерина со свежеосажденными гидроксидом меди приводит к образованию ярко-синего раствора глицерата меди:
Данная реакция является качественной на многоатомные спирты. Для сдачи ЕГЭ достаточно знать признаки этой реакции, а само уравнение взаимодействия уметь записывать необязательно.
3. Так же, как и одноатомные спирты, многоатомные могут вступать в реакцию этерификации, т.е. реагируют с органическими и кислородсодержащими неорганическими кислотами с образованием сложных эфиров. Данная реакция катализируется сильными неорганическими кислотами и является обратимой. В связи с этим при осуществлении реакции этерификации образующийся сложный эфир отгоняют из реакционной смеси, чтобы сместить равновесие вправо по принципу Ле Шателье:
Если в реакцию с глицерином вступают карбоновые кислоты с большим числом атомов углерода в углеводородном радикале, получающиеся в результате такой реакции, сложные эфиры называют жирами.
В случае этерификации спиртов азотной кислотой используют так называемую нитрующую смесь, представляющую собой смесь концентрированных азотной и серной кислот. Реакцию проводят при постоянном охлаждении:
Сложный эфир глицерина и азотной кислоты, называемый тринитроглицерином, является взрывчатым веществом. Кроме того, 1%-ный раствор данного вещества в спирте обладает мощным сосудорасширяющим действием, что используется при медицинских показаниях для предотвращения приступа инсульта или инфаркта.
Замещение гидроксильных групп
Реакции данного типа протекают по механизму нуклеофильного замещения. К взаимодействиям такого рода относится реакция гликолей с галогеноводородами.
Так, например, реакция этиленгликоля с бромоводородом протекает с последовательным замещением гидроксильных групп на атомы галогена:
Реакции элиминирования (отщепления)
Дегидратация
Дегидратация, фактически подразумевающая отщепление молекул воды, в случае спиртов различается на межмолекулярную дегидратацию и внутримолекулярную дегидратацию.
При межмолекулярной дегидратации спиртов одна молекула воды образуется в результате отщепления атома водорода от одной молекулы спирта и гидроксильной группы — от другой молекулы.
В результате этой реакции образуются соединения, относящиеся к классу простых эфиров (R-O-R):
Внутримолекулярная дегидратация спиртов протекает таким образом, что одна молекула воды отщепляется от одной молекулы спирта. Данный тип дегидратации требует несколько более жестких условий проведения, заключающихся в необходимости использования заметно более сильного нагревания по сравнению с межмолекулярной дегидратацией. При этом из одной молекулы спирта образуется одна молекула алкена и одна молекула воды:
Поскольку молекула метанола содержит только один атом углерода, для него невозможна внутримолекулярная дегидратация. При дегидратации метанола возможно образование только простого эфира (CH3-O-CH3).
Нужно четко усвоить тот факт, что в случае дегидратации несимметричных спиртов внутримолекулярное отщепление воды будет протекать в соответствии с правилом Зайцева, т.е. водород будет отщепляться от наименее гидрированного атома углерода:
Дегидрирование спиртов
а) Дегидрирование первичных спиртов при нагревании в присутствии металлической меди приводит к образованию альдегидов:
б) В случае вторичных спиртов аналогичные условия приведут у образованию кетонов:
в) Третичные спирты в аналогичную реакцию не вступают, т.е. дегидрированию не подвергаются.
Структурная изомерия
Для спиртов характерна структурная изомерия – изомерия углеродного скелета, изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета характерна для спиртов, которые содержат не менее четырех атомов углерода.
| Например. Формуле С4Н9ОН соответствуют четыре структурных изомера, из них два различаются строением углеродного скелета |
| Бутанол-1 | 2-Метилпропанол-1 |
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С2Н6О этиловый спирт СН3–CH2–OH и диметиловый эфир CH3–O–CH3 |
| Этиловый спирт | Диметиловый эфир |
| СН3–CH2–OH | CH3–O–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Пропанол-1 и пропанол-2 |
| Пропанол-1 | Пропанол-2 |
Химические свойства спиртов
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н+ соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
Таким образом, для спиртов характерны следующие свойства:
|
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому спирты не взаимодействуют с растворами щелочей.
Многоатомные спирты также не реагируют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Спирты взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода. |
Видеоопыт взаимодействия спиртов (метанола, этанола и бутанола) с натрием можно посмотреть здесь.
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, этилат калия разлагается водой: |
|
Кислотные свойства одноатомных спиртов уменьшаются в ряду:
CH3OH > первичные спирты > вторичные спирты > третичные спирты |
Многоатомные спирты также реагируют с активными металлами:
1.3. Взаимодействие с гидроксидом меди (II)
Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи, образуя комплексные соли (качественная реакция на многоатомные спирты).
| Например, при взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) образуется ярко-синий раствор гликолята меди: |
Процесс — окисление — фенол
Процесс окисления фенолов, идущий с поглощением кисло ] да, протекает неравномерно. Естественно, и подача возд в аэрационный бассейн также осуществляется неравномерно: бо шее его количество подается в начало бассейна, где особер высока скорость окисления фенолов.
|
Влияние рН на расход озона. |
Процесс окисления фенолов может быть ускорен при повышении температуры воды до 40 С.
В процессе окисления орто-замещенных фенолов заместители проявляют в основном электронные эффекты ( индуктивные и резонансные), а ролью стеричвских факторов можно пренебречь.
В процессе окисления орто-замещенных фенолов заместители проявляют в основном электронные эффекты ( индуктивные и резонансные), а ролью стерических факторов можно пренебречь.
Однако для процесса окисления фенола, который имеет д 6, применение в 2 раза меньшей концентрации означает, что это время увеличится в 26 64 раза.
В ряде случаев процесс окисления фенола оказывается весьма сложным, протекающим с образованием радикалов. В этих случаях первой стадией является образование стабилизированного резонансом феноксшгыюго радикала.
Повышение температуры также значительно ускоряет процесс окисления фенолов активным хлором. Однако повышать температуру выше 45 не следует, так как при этом гипохлориты переходят в хлораты, которые обладают меньшей окислительной способностью и замедляют реакцию окисления. Оптимальной температурой окисления является 40 С. При этой температуре скорость реакции увеличивается в 2 — 3 раза по сравнению со скоростью реакции при комнатной температуре.
В конечном счете при всех гемолитических процессах окисления фенолов и ароматических аминов образуется сложная смесь.
|
Зависимость содержания фенола от продолжительности контакта и количества двуокиси марганца ( в % от теоретически необходимого количества. |
Окись марганца в дальнейшем является основным источником получения кислорода и процесс окисления фенола в этом случае протекает по уравнению, приведенному выше.
К этому же типу реакций относится открытие Си11 по каталитическому ускорению процесса окисления фенолов ( тимола, резорцина, гидрохинона) и n — фенетидина перекисью водорода.
О характере образующихся при реакции ( 16) продуктов можно делать определенные выводы по данным, полученным при изучении процесса окисления фенолов.
Необходимо отметить, что если баланс по цианистому водороду и сероводороду, определенный по воде и газовой фазе, сходится удовлетворительно, то количество фенолов в воздухе после градирни значительно меньше, чем в воде, что свидетельствует о процессах окисления фенолов, происходящих на градирне.
|
Кинетика окисления фенола пероксидом водорода. |
Свойства фенола
Свежеперегнанный фенол представляет собой бесцветные игольчатые кристаллы с температурой плавления 41 °С и температурой кипения 182 °С. При хранении, особенно во влажной атмосфере и в присутствии небольших количеств солей железа и меди, он быстро приобретает красную окраску. Фенол смешивается в любых соотношениях со спиртом, водой (при нагревании свыше 60 °С), хорошо растворим в эфире, хлороформе, глицерине, сероуглероде.
Из-за наличия -OH гидроксильной группы, фенол имеет химические свойства характерные для спиртов, так и ароматических углеводородов.
По гидроксильной группе фенол вступает в следующие реакции:
Так как фенол обладает немного более сильными кислотными свойствами, чем у спирты, то под воздействием щелочей он образует соли — феноляты (к примеру, фенолят натрия — C6H5ONa):
C6H5OH + NaOH -> C6H5ONa + H2O
В результате взаимодействия фенола с металлическим натрием также получается фенолят натрия:
2C6H5OH + 2Na -> 2C6H5ONa + H2
Фенол непосредственно не этерифицируется карбоновыми кислотами, получение эфиров осуществляют путем взаимодействия фенолятов с ангидридами или галогенангидридами кислот:
C6H5OH + CH3COOH -> C6H5OCOCH3 + NaCl
При перегонке фенола с цинковой пылью идет реакция замещения гидроксильной группы водородом:
C6H5OH + Zn -> C6H6 + ZnO
Реакции фенола по ароматическому кольцу:
Фенол вступает в реакции электрофильного замещения по ароматическому кольцу. Группа ОН, являясь одной из самых сильных донорных групп (вследствие уменьшении электронной плотности на функциональной группе), увеличивает реакционную способность кольца к этим реакциям и направляет замещение в орто- и пара-положения. Фенол легко алкилируется, ацилируется, галогенируется, нитруется и сульфируется.
Реакция Кольбе — Шмитта служит для синтеза салициловой кислоты и её производных (ацетилсалициловой кислоты и других).
C6H5OH + CO2 –NaOH-> C6H4OH(COONa)
C6H4OH(COONa) –H2SO4-> C6H4OH(COOH)
Качественные реакции на фенол:
В результате взаимодействия с бромной водой:
C6H5OH + 3Br2 -> C6H2Br3OH +3HBr
- образуется 2,4,6-трибромфенол — твёрдое вещество белого цвета.
С концентрированной азотной кислотой:
C6H5OH + 3HNO3 -> C6H2(NO2)3OH + 3H2O
С хлоридом железа(III) (качественная реакция на фенол):
C6H5OH + FeCl3 -> ⌈Fe(C6H5OH)6⌉Cl3
Реакция присоединения
Гидрированием фенола в присутствии металлических катализаторов Pt/Pd, Pd/Ni, получают циклогексиловый спирт:
C6H5OH -> C6H11OH
Окисление фенола
Вследствие наличия гидроксильной группы в молекуле фенола, устойчивость к окислению много ниже нежели, чем у бензола. В зависимости от природы окислителя и условия проведения реакции получаются различные продукты.
Так под действием перекиси водорода в присутствии железного катализатора образуется небольшое количество двухатомного фенола — пирокатехина:
C6H5OH + 2H2O2 – Fe> C6H4(OH)2
При взаимодействии более сильных окислителей (хромовая смесь, диоксид марганца в кислой среде) образуется пара-хинон.
Окисление фенолов до хинонов
Бензол и алкилбензолы невозможно окислять в соответствующие хиноны с препаративными выходами. Введение в ароматическое кольцо электронодонорных заместителей приводит к облегчению реакций окисления. Окисление бензол-1,2- и бензол-1,4-диолов, аминофенолов, ароматических диаминов является общим методом получения хинонов.
Как окислители используют:
- триоксида хрома в уксусной или серной кислоте;
- хлорат натрия в смеси уксусной и серной кислот;
- бихромат натрия в серной кислоте с тетрахлорометаном;
- йодатную кислоту;
- гипойодатную кислоту;
- пероксид водорода в уксусной кислоте;
- хроматную кислоту;
- кислород воздуха в присутствии пентаоксида ванадия.
Считают, что эти реакции происходят по радикальному механизму.
Образование пapa-бензохинона происходит по механизму аутоокисления кислородом воздуха в присутствии пентаоксида ванадия:
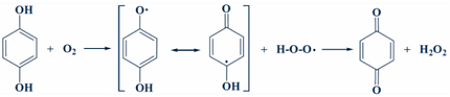 Рисунок 11.
Рисунок 11.
Незамещенный пара-бензохинон получают также окислением анилина:
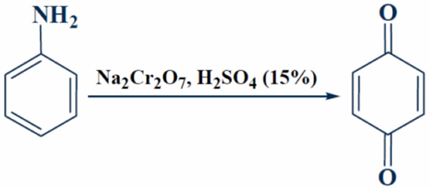 Рисунок 12.
Рисунок 12.
Незамещенный орто-бензохинон — нестойкое соединение, но его можно получить, если проводить реакцию с пероксидом свинца при низкой температуре:
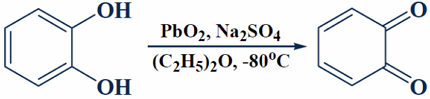 Рисунок 13.
Рисунок 13.
Синтез алкил-орто-бензохинона не вызывает затруднений. Окисление происходит при действии оксида серебра или пероксида свинца в инертных растворителях. Для получения хинонов, содержащих электроноакцепторные заместители используют более жесткий окислитель — азотную кислоту.
Механизм окисления фенола
Окисление фенола характеризуется сложным характером и происходит преимущественно по радикальному механизму. При этом в результате перехода электрона к окислителю возникает катион-радикал, который после отщепления протона превращается в феноксильний радикал:
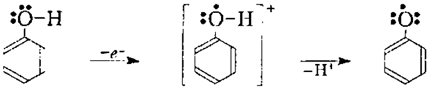 Рисунок 3.
Рисунок 3.
Феноксил-радикал может легко образовываться также при окислении фенолят-аниона:
 Рисунок 4.
Рисунок 4.
В феноксильних радикалах неспаренный электрон в значительной степени делокализованных системой $\pi$-связей ароматического ядра, можно показать набором резонансных структур:
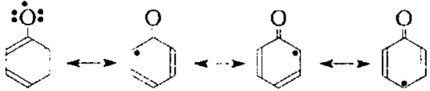 Рисунок 5.
Рисунок 5.
Феноксильний радикал способен к реакциям рекомбинации или других преобразований:
![]() Рисунок 6.
Рисунок 6.
В случае размещения в ядре объемных заместителей возможно образование устойчивых феноксильных радикалов. Стабильность таких радикалов объясняется не столько рассредоточением исспареного электрона в ароматическом ядре, сколько экранированием алкильными группами в о- положениях реакционного центра на атоме кислорода, то есть кинетической стабильностью. Например, при окислении 4-метил-2,6-ди-трет-бутилфенол (ионола) образуется стабильный радикал, который может значительное время существовать в свободном состоянии:
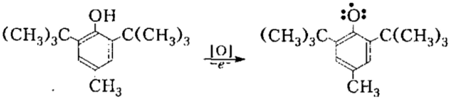 Рисунок 7.
Рисунок 7.
На этом основано применение таких соединений, как антиоксиданты, или ингибиторов, радикально-цепных реакций, которые обрывают реакционные цепи.
Спектральные характеристики фенолов
Максимум поглощения в УФ-части спектра для фенола смещен в сторону более длинных волн примерно на 15 нм по сравнению с бензолом (батохромное смещение) благодаря участию $\pi$-электронов кислорода в сопряжении с бензольным ядром и проявляется при 275 нм с тонкой структурой.
В ИК-спектрах для фенолов, как и для спиртов, характерны интенсивные полосы $v_{OH}$ в области 3200-3600 см$^{-1}$ и 3600-3615 см$^{-1}$ для сильно разведенных растворов, но для $v_{c\_D}$ фенолов прослеживается полоса около 1230 см$^{-1}$ в отличие от 1220-1125 см$^{-1}$ для спиртов.
В ПМР-спектрах сигнал протона $OH$-группы фенолов проявляется в широком диапазоне (4,0-12,0 м.ч.) по сравнению со спиртами в зависимости от природы и концентрации растворителя, температуры, наличия меж- или внутримолекулярных водородных связей. Часто сигнал протона $OH$-группы регистрируют при 8,5-9,5 м.ч. в диметилсульфоксиде или при 4,0-7,5 м.ч, в $CCl_4$.
В масс-спектре фенола основным направлением фрагментации является элиминирования частиц $HCO$ и $CO$:
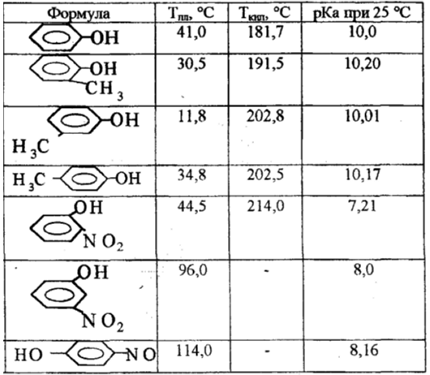 Рисунок 2.
Рисунок 2.
Если в молекуле фенола присутствуют алкильные радикалы, первичным процессом будет бензильное расщепление.
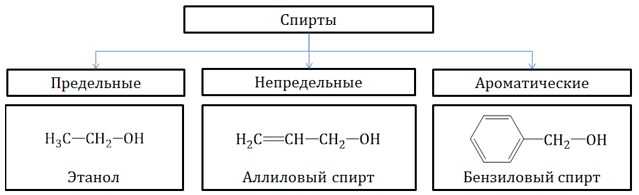
Классификация по строению углеводородного радикала
- Предельные спирты – группа ОН соединена с предельным радикалом. Например, пропанол-1: СН3–СН2–СН2–ОН.
- Непредельные спирты – группа ОН соединена с непредельным радикалом. Например, алкенолы: СН2=СН–СН2–ОН.
Непредельные спирты, в которых гидроксильная группа соединена с атомом углерода при двойной связи (алкенолы), неустойчивы и изомеризуются в соответствующие карбонильные соединения.
- Ароматические спирты – содержат в радикале ароматическое кольцо, не связанное непосредственно с группой ОН. Например, бензиловый спирт.
Строение спиртов и фенолов
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp3-гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp3-гибридные орбитали, а еще две 2sp3-гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108о.
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения метанола +64,5оС). Температуры кипения многоатомных спиртов и фенолов значительно выше.
Таблица. Температуры кипения некоторых спиртов и фенола.
| Название вещества | Температура кипения |
| Метанол | 64 |
| Этанол | 78 |
| Пропанол-1 | 92 |
| Бутанол-1 | 118 |
| Этиленгликоль | 196 |
| Фенол | 181,8 |
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Номенклатура спиртов
По систематической номенклатуре к названию углеводорода добавляют суффикс «-ОЛ» и цифру, указывающую номер атома углерода, к которому присоединена гидроксильная группа.
Нумерация ведется от ближайшего к ОН-группе конца цепи.
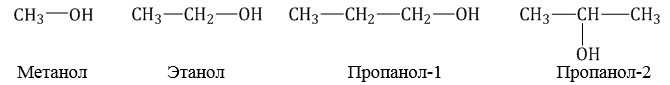
По радикально-функциональной номенклатуре названия спиртов составляют от названий углеводородных радикалов, соединенных с группой ОН, с добавлением слова «спирт».
Например: СН3ОН – метиловый спирт, С2Н5ОН – этиловый спирт и т.д.
В названиях многоатомных спиртов количество групп ОН указывают суффиксами -диол в при наличии двух ОН-групп, -триол при наличии трех ОН-групп и т.д. После этого добавляют номера атомов углерода, связанных с гидроксильными группами.
Например, пропандиол-1,2 (пропиленгликоль):





























