Содержание
- Первый закон
- Второй закон
- Что мы узнали?
Бонус
- Гидролиз солей
- Гидролиз
- Электролиз
- Классификация химических реакций
- Электролиз расплавов
- Электролиз воды Закон Фарадея для электролиза
- 1. Юрий Острогов 617
- 2. Капитан Немо 476
- 3. Игорь Проскуренко 135
- 4. Филипп Барышников 115
- 5. Павел Никитин 108
- 6. Валерия Кириллова 103
- 7. андрей медведский 97
- 8. Влад Чиж 90
- 9. Вера Акбарова 79
- 10. Ten Chittaponlichaia 64
- 1. Игорь Проскуренко 23,691
- 2. Кристина Волосочева 19,120
- 3. Ekaterina 18,721
- 4. Юлия Бронникова 18,580
- 5. Darth Vader 17,856
- 6. Алина Сайбель 16,787
- 7. Мария Николаевна 15,775
- 8. Лариса Самодурова 15,735
- 9. Liza 15,165
- 10. TorkMen 14,876
Самые активные участники недели:
- 1. Виктория Нойманн — подарочная карта книжного магазина на 500 рублей.
- 2. Bulat Sadykov — подарочная карта книжного магазина на 500 рублей.
- 3. Дарья Волкова — подарочная карта книжного магазина на 500 рублей.
Три счастливчика, которые прошли хотя бы 1 тест:
- 1. Наталья Старостина — подарочная карта книжного магазина на 500 рублей.
- 2. Николай З — подарочная карта книжного магазина на 500 рублей.
- 3. Давид Мельников — подарочная карта книжного магазина на 500 рублей.
Карты электронные(код), они будут отправлены в ближайшие дни сообщением Вконтакте или электронным письмом.
Источник
Кажущиеся случаи отклонения от законов Фарадея
I закон Фарадея, базирующийся на атомистической природе вещества и электричества, является точным законом природы. Отклонений от него быть не может. Если на практике при расчетах наблюдаются отклонения от этого закона, то они всегда обусловлены неполным учетом процессов, сопутствующих основной электрохимической реакции. Например, при электролизе водного раствора NaCl в системе с платиновыми электродами и разделенными пористой диафрагмой анодным и катодным пространствами на катоде протекает реакция:
2H2O + 2ē = H2 + 2OH-
а на аноде: 2Cl- — 2ē = Cl2
Количество образующегося газообразного хлора всегда меньше, чем это следует по закону Фарадея из-за того, что Cl2растворяется в электролите и вступает в реакцию гидролиза:
Cl2+ H2O → HCl+ HClO
Если учесть массу хлора, прореагировавшего с водой, получим результат, соответствующий рассчитанному по закону Фарадея.
Или при анодном растворении многих металлов параллельно идут два процесса – образование ионов нормальной валентности и так называемых субионов – т.е. ионов низшей валентности, например: Cu0 — 2ē → Cu2+ и Cu- 1ē → Cu+.
Поэтому расчет по закону Фарадея в предположении, что образуются только ионы высшей валентности, оказывается неправильным.
Часто на электроде протекает не одна электрохимическая реакция, а несколько самостоятельных параллельных реакций. Например, при выделении Zn из кислого раствора ZnSO4наряду с разрядом ионов Zn:
Zn2+ +2ē →Zn
протекает реакция восстановления ионов гидроксония: 2Н3О+ +2ē → Н2 + 2H2O.
Если на электроде протекает несколько параллельных электрохимических реакций, то I закон Фарадея будет справедлив для каждой из них.
Законы электролиза Фарадея представляют собой количественные соотношения, основанные на электрохимических исследованиях Майкла Фарадея, которые он опубликовал в 1836 году.
Данные законы определяют связь между количеством веществ, выделяющихся при электролизе и количеством электричества, которое прошло при этом через электролит. Законов Фарадея два. В научной литературе и в учебниках встречаются различные формулировки данных законов.
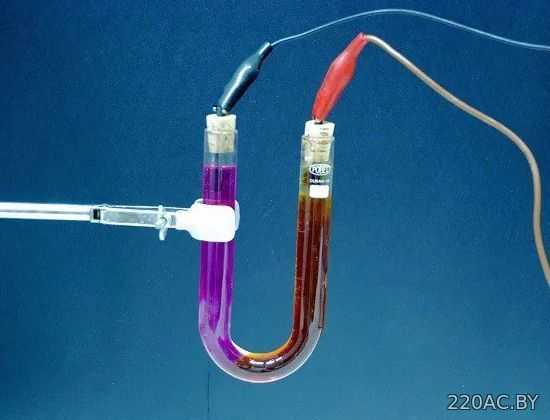
Электролиз
— выделение из электролита входящих в его состав веществ при прохождении электрического тока. Так, например, при пропускании электрического тока через слегка подкисленную воду вода разлагается на составные части — газы (кислород и водород).
Количество выделившегося из электролита вещества пропорционально количеству протекшего через электролит электричества, т. е. произведению из силы тока на время, в течение которого этот ток протекал. Поэтому явление электролиза может служить для измерения силы тока и определения единицы силы тока.
Электролит
— раствор и вообще сложная жидкость, проводящая электрический ток. В аккумуляторах электролитом служит раствор серной кислоты (в свинцовых) или раствор едкого калия, либо едкого натра (в железоникелевых). В гальванических элементах электролитом служат также растворы каких-либо химических соединений (нашатыря, медного купороса и т. п.).
Предыдущая
РазноеСбережения и рост: как работает сложный процент на депозитах и счетах
Следующая
РазноеКак откалибровать акселерометр?
Электролиз и законы Фарадея
Майкл Фарадей – английский физик-экспериментатор, совершивший несколько важных открытий, касающихся электромагнитных явлений. Электрохимические исследования природы реакций, опубликованные ученым в 1836 году, позволили ему сформулировать законы электролиза. Они формулируют связь между количеством вещества, полученного в процессе электрохимической реакции, и объемом электроэнергии, повлиявшей на электролит.
Первый закон
В общем виде первое правило электролиза Фарадея звучит так: масса вещества, присоединившаяся к электроду при реакции прямо пропорциональна объему электричества, прошедшего через электролит с помощью электродов. Формула реакции:
m = kq = k*I*t
(значения переменных: q – заряд, k –электрохимический эквивалент (коэффициент) вещества, I – сила тока, влияющего на электролит, t – время прохождения электричества).

Второй закон
Этим термином обозначают молярную массу, деленную на целое число, определяющееся реакцией химии, в которой элемент участвует. В другой формулировке закон выглядит так: равное количество электроэнергии ведет к выделению на электродах в течение электролиза эквивалентных масс разных элементов.
Эта константа стала называться числом Фарадея. Самая простая формулировка закона гласит: электрохимический эквивалент каждого элемента прямо пропорционален его молярной массе и обратно пропорционален валентности этого же элемента. Формула:
m = Q/F*A/z
(значения переменных: m – искомая масса полученного вещества, Q – количество полного заряда, прошедшего через электроды, F – число Фарадея, А- молярная масса, z – химическая валентность элемента). Соединяя вместе все значения, описанные в обоих законах, можно вывести общую формулу, определяющую массу собранного на электродах вещества: m = A*I*t/(n*F) (n – заряд иона или количество электронов, участвующих в реакции электролиза).

Что такое электролиз
Ток, как известно, представляет собой упорядоченное движение зарядов. Он может протекать не только по проводам, но и через другие вещества. Для этого необходимо, чтобы вещество имело носители зарядов.
В качестве проводника может выступать жидкость, в которой происходят окислительно-восстановительные реакции. В ней имеется большое количество ионов. При пропускании через такой раствор электрического тока происходит оседание вещества на электродах. На практике этим можно воспользоваться, например, для получения металлов с высокой степенью чистоты.
При электролизе на катоде будет проходить процесс восстановления, а на аноде — окисления. Продукты реакций иногда откладываются на электродах, а в некоторых случаях продолжают вступать во вторичные реакции.
Если раствор содержит соли металлов, то последний будет откладываться на катоде, а на аноде образуется газ. Это можно продемонстрировать на электролизе поваренной соли (NaCl). Чистый натрий будет оседать на катоде, а хлор — на аноде.
Растворы веществ, обеспечивающих высокое содержание ионов в жидкости, называются электролитами. Этот термин ввёл в употребление Фарадей. Согласно его определению, речь идёт о тех жидкостях, способных пропускать электроток.
Протекание электролитических реакций возможно при выполнении следующих условий:
В электролите не должно быть пространственной электрической однородности. В нем должна присутствовать объёмная неравномерность по уровню потенциала. Как пример можно привести ситуацию, когда в аккумуляторах происходит выработка электрического тока. Под его воздействием происходит неравномерное объёмное распределение зарядов в электролитах. Электроток обязательно должен быть постоянным.
Чтобы можно было говорить о прохождении тока, в растворе должны присутствовать носители электрозарядов
При этом важно, чтобы они могли свободно перемещаться под действием приложенного к ним электрического поля.
На практике к электролитам относят растворимые соли, а также кислоты и щёлочи. При прохождении электротока через металлический проводник в качестве носителей заряда выступают только электроны. В электролитах присутствует ещё одна их разновидность — ионы.
Обычно атомы водорода или металлов теряют электроны и становятся положительными ионами. Отрицательно заряженные ионы —это гидроксильные группы или кислотные молекулярные остатки. При воздействии электрополя на раствор ионы с отрицательным зарядом начинают притягиваться к аноду, а с положительным — к катоду. Электрический ток в жидкостях практически представляет собой одновременное перемещение носителей заряда противоположных знаков.
В результате отрицательные ионы отдают лишние электроны положительному электроду. Соответственно, положительные ионы восполняют недостающие электроны за счёт частиц, которые получают у отрицательного электрода. После восстановления электрической нейтральности эти вещества выделяются из раствора, осаждаясь или выделяясь в виде газа.
Здесь рассмотрена ситуация, когда происходит только одна электролитическая реакция. На практике получившиеся вещества могут участвовать в других реакциях. В результате процесс электролиза становится более сложным. Таких реакций может быть 2, 3 или больше.
Особенности процессов, происходящих на катоде и аноде
Электроды – стержни, сделанные из материалов с высокой электропроводностью. Их можно разделить на две категории – активные электроды, которые, окисляясь, участвуют в обмене ионами, и инертные – из графита, угля или платины, исполняющие только функцию проводников.
Чтобы правильно рассчитывать формулы и получать ожидаемый результат электролиза – будь то в рамках школьной подготовки к ЕГЭ, экзаменам или в процессе работы предприятия – необходимо понимать, как именно участвуют электроды разной полярности в течении реакции. К электроду, имеющему отрицательный заряд, – катоду – притягиваются ионы с противоположным зарядом «+», например, металлы: натрий (Na+), калий (K+), медь (Cu2+), железо (Fe3+), серебро (Ag+) и прочие.
Определить фактор поможет его позиция в ряду электрохимической активности металлов:
- Сильно активный металл (литий, натрий, калий), взаимодействуя с катодом, вместо себя восстанавливает молекулы воды, из которых, в свою очередь, выделяется водород.
- Средняя активность металла (хрома, железа, кадмия) способствует образованию на катоде и воды, и молекул вещества.
- Малая активность металла (меди, серебра) позволяет получить молекулы вещества в чистом виде.

Чистое вещество помогает получить электролиз AlCl3 (хлорида алюминия) и других металлов высокой активности в безводном расплаве – исходная смесь распадается на составные части, например, AlCl3 → Al + Cl2.
К положительно заряженному аноду стремятся анионы с «+», а к отрицательно заряженному катоду катионы с «-«.
Анионы разных элементов также различаются по степени активности. Такой процесс, как окисление, имеет особенности, зависящие от дополнительных составляющих анионов:
- Молекулы, содержащие кислород – сульфаты, фосфорные кислоты – при электролизе окисляют молекулы воды, выделяя из них кислород.
- Бескислородные анионы, взаимодействуя с анодом, выделяют определенные галогены: как примеры, из сульфидов выделяется сера, из хлоридов — хлор. Все неметаллы проще окисляются, чем кислород. Исключение – фтор, который, как самое электроотрицательное вещество, в результате реакции окисляет молекулы воды в растворе до кислорода.
- Органический элемент окисляется на аноде так: присоединенный к карбоксильной группе радикал удваивается, а сама группа принимает форму газа (CO2).
Энергетические затраты
Электролиз требует больших энергетических затрат. Процесс будет иметь практическую ценность при достаточной величине анодного тока, а для этого необходимо приложить значительный постоянный ток от источника электроэнергии. Кроме того, при его проведении возникают побочные потери напряжения – анодное и катодное перенапряжение, потери в электролите за счет его сопротивления. Эффективность работы установки определяется путем отнесения мощности энергозатрат к единице полезной массы полученного вещества.
Электролиз давно и с высокой эффективностью используется в промышленности. Анодированные и гальванические покрытия стали обычным явлением в повседневной жизни, а добыча и обогащение материалов помогает добывать многие металлы из руды. Процесс можно запланировать и рассчитать, зная основные его закономерности.
Что такое анод и катод?
Что такое генератор водорода и как его сделать своими руками
Какие существуют виды источников электрического тока?
Что такое электрический ток простыми словами
История открытия электричества
В чём отличие проводников от диэлектриков, их свойства и сфера применения
ЭДС индукции. Закон электромагнитной индукции
Выше рассмотренные опыты показали, что в замкнутом контуре возникает индукционный ток при изменении магнитного потока, пронизывающего поверхность, ограниченную контуром. Как известно, ток в проводнике возникает в том случае, если на свободные заряды проводника действуют сторонние силы. Работу этих сил при перемещении единичного заряда вдоль замкнутого проводника называют электродвижущей силой. Следовательно, при изменении магнитного потока через поверхность, ограниченную контуром, в нем появляются сторонние силы (природу их выясним ниже: ЭДС индукции в движущихся проводниках), действие которых характеризуется ЭДС, называемой ЭДС индукции
Как показывает опыт, значение индукционного тока (а значит, и \(~\varepsilon_i\)) не зависит от причины изменения магнитного потока (изменяется ли площадь, ограниченная контуром, или его ориентация в пространстве, изменяется ли индукция магнитного поля при перемещении его источников или за счет изменения среды и т.д.). Существенное
значение имеет лишьскорость изменения магнитного потока \(~\frac {\Delta \Phi}{\Delta t}\) (так, стрелка гальванометра в опытах Фарадея отклоняется тем больше, чем быстрее вдвигается магнит в катушку). \(~ \mathcal h \varepsilon_i \mathcal i = -\frac {\Delta \Phi}{\Delta t}. \qquad (1)\) Эта формула выражает закон Фарадея для электромагнитной индукции:
среднее значение ЭДС индукции в проводящем контуре пропорционально скорости изменения магнитного потока через поверхность, ограничен ную контуром. Мгновенное значение ЭДС индукции равно взятой с противоположным знаком первой производной от магнитного потока по времени, т.е.
\(~\mathcal h \varepsilon_i \mathcal i = {\Phi}'(t)\).
Советуем изучить Переполюсовка
Знак «-» учитывает правило Ленца, согласно которому при увеличении магнитного потока \(~(\frac {\Delta \Phi}{\Delta t} > 0)\) ЭДС индукции отрицательная \(~(\varepsilon_i 0)\).
Сила индукционного тока в замкнутом контуре рассчитывается по закону Ома\ где R
— сопротивление контура.
Индукционный ток возникает не только в линейных проводниках, но и в массивных сплошных проводниках, помещенных в переменное магнитное поле. В соответствии с законом электромагнитной индукции любые изменения магнитного потока, пронизывающего проводящее тело, сопровождаются возникновением в нем индукционных токов. Эти токи оказываются замкнутыми в толще проводника и поэтому называются вихревыми (а также токами Фуко)
. Токи Фуко, как и индукционные токи в линейных проводниках, подчиняются правилу Ленца: их магнитное поле направлено так, чтобы противодействовать изменению магнитного потока, индуцирующего вихревые токи. Токи Фуко можно обнаружить на опыте с маятником (проводящей пластиной), колеблющемся в зазоре между полюсами электромагнита. До включения маятник совершает практически незатухающие колебания. При пропускании тока через катушку электромагнита маятник испытывает сильное торможение и очень быстро останавливается. Торможение маятника объясняется действием магнитного поля на индукционные токи, возникающие в пластине при ее движении в магнитном поле. Если в пластине сделать разрезы, то вихревые токи ослабляются и торможение почти отсутствует. Этот факт торможения используется для успокоения подвижных частей различных приборов.
Токи Фуко вызывают нагревание проводников (якоря генераторов и сердечников трансформаторов), выделяемая токами Фуко теплота используется в индукционных металлургических печах и в других случаях.
По закону Фарадея (1) определяется ЭДС индукции, возникающая и в движущемся проводнике, и в неподвижном (см. опыты, описанные в разделе Электромагнитная индукция). Но механизм происхождения ЭДС индукции в этих случаях различен.
Постоянная Фарадея
Произведение элементарного заряда (заряда электрона) е на постоянную Авогадро NA носит название постоянной Фарадея: F = eNA. Введя постоянную Фарадея в формулу (3.5.4), для массы вещества, выделившегося при электролизе на электроде, получим:
Согласно этой формуле постоянная Фарадея F численно равна заряду, который надо пропустить через раствор электролита, чтобы выделить на электроде один моль одновалентного вещества. Постоянная Фарадея, найденная из опыта, равна F = 9,65 • 104 Кл/моль. Для выделения на электроде одного моля n-валентного вещества через раствор электролита необходимо пропустить заряд, численно равный произведению nF.
Где применяется электролиз?
Электролиз применяется во многих сферах. Можно выделить несколько основных направлений использования для получения практических результатов.
Гальваническое покрытие
Тонкое, прочное гальваническое покрытие из металла можно наложить путем электролиза. Покрываемое изделие устанавливается в ванну в виде катода, а электролит содержит соль нужного металла. Так можно покрыть сталь цинком, хромом или оловом.

Электроочистка — рафинирование меди
Примером электроочистки может служить такой вариант: катод – чистая медь, анод – медь с примесями, электролит – водный раствор медного сульфата. Медь из анода переходит в ионы и оседает в катоде уже без примесей.

Добыча металлов
Для получения металлов из солей они переводятся в расплав, а затем обеспечивается электролиз в нем. Достаточно эффективен такой способ для получения алюминия из бокситов, натрия и калия.
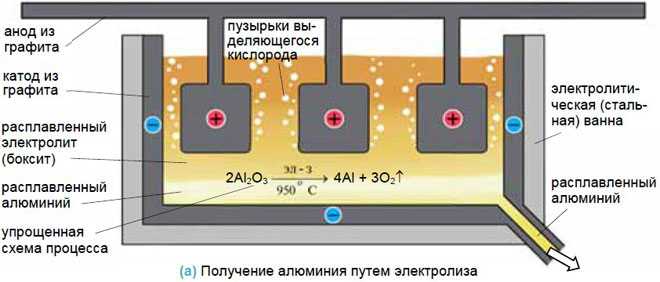
Анодирование
При этом процессе покрытие выполняется из неметаллических соединений. Классический пример – анодирование алюминия. Алюминиевая деталь устанавливается, как анод. Электролит – раствор серной кислоты. В результате электролиза на аноде оседает слой из оксида алюминия, обладающего защитными и декоративными свойствами. Указанные технологии широко используются в различных отраслях промышленности. Можно осуществить процессы и своими руками с соблюдением техники безопасности.
Суть процесса электролиза
Электролизом называются процессы окислительно-восстановительных реакций, протекающие под принудительным воздействием электрического тока. Для его выполнения используется специальная емкость с электролитическим раствором, куда погружаются металлические штыри, соединенные с наружным источником питания.

Электрод, соединенный с полюсом отрицательного значения источника тока, считается катодом. Именно в данном месте частицы электролита восстанавливаются. Другой электрод подключается к плюсовому полюсу и носит название анода. На этом участке вещество электрода или частицы электролита окисляются. Химические реакции на этом участке происходят по-разному, в зависимости от материала анода и состава электролитического раствора. Поэтому, как утверждает химия, электроды по отношению к электролиту могут быть инертными или растворимыми.
К категории инертных относятся аноды, изготовленные из материала, не окисляющегося во время электролиза. В качестве примера можно привести графитовые или платиновые электроды. Растворимыми являются практически все остальные виды металлических анодов, подверженных окислению в ходе электролитической реакции.
Факторы, влияющие на электролиз
Формулы описывают прохождение реакции в идеальной среде, без учета множества сопутствующих факторов, способных изменить ожидаемый результат. Кроме учтенного в законах комплекса составляющих, на суммарное составляющие реакции влияют:
- Состав электролита. На ход реакции и ее результат влияют посторонние примеси, попавшие в электролит. Их разделяют на катионные, анионные и органические. Посторонние молекулы имеют более или менее отрицательный потенциал, чем основное соединение, а это сильно мешает процессу. У концентрации органических загрязнений (это могут быть ПАВ или масла) есть конечное допустимое значение.
- Плотность электричества. Законы Фарадея утверждают, что, чем мощнее сила тока, тем больше количество вещества, которое осядет на электродах. На практике увеличение силы тока часто становится причиной неблагоприятных явлений – интенсивный нагрев электролита, концентрированная поляризация электродов, чрезмерное напряжение тока. Чтобы получить ожидаемый от электролиза результат, следует соблюдать оптимальные для каждой ситуации значения плотности энергии.
- Температура электролита. Ее действие неоднозначно. С одной стороны, с ее увеличением растет интенсивность реакции, с другой – повышается активность посторонних примесей. Поэтому необходимо следить, чтобы температура жидкости находилась в оптимальных пределах для конкретного случая, обычно это 38-45 градусов.
- Кислотно-щелочной баланс электролита. Оптимальное значение pH среды зависит от определенного вещества. Возможно контролировать скорость протекания электролиза и его результат, доводя его до оптимального, если верно сочетать влияние имеющихся факторов. Для каждого вида реакции опытным путем выработаны нужные режимы работы, которых необходимо придерживаться.

Закон электромагнитной индукции
М. Фарадей провел многочисленные опыты, записывая результаты, и из этих опытных таблиц электромагнитной индукции установил, что ток в проводящем контуре возникает только при изменении магнитного поля, пронизывающего этот контур.
Для количественного описания этого явления используется понятие магнитного потока. Если индукция характеризует силу магнитного поля в точке, то магнитный поток характеризует плотность линий магнитной индукции. Магнитный поток через контур площадью S равен произведению модуля индукции B на площадь S и на косинус угла между вектором индукции и нормалью к контуру:
$$Ф=BScosα$$
Рис. 3. Ф=BScosa.
Явление электромагнитной индукции состоит в том, что при изменении за время Δt магнитного потока через контур на величину ΔФ, в нем возникают сторонние силы, создающие разность потенциалов, называемую ЭДС (электродвижущей силой):
$$ε= -{ΔФ\over Δt}$$
Знак минус в данной формуле электромагнитной индукции означает, что возникающая ЭДС, в соответствии с правилом Э.Ленца, направлена так, чтобы создавать ток, противодействующий создавшей его причине.
Законы Майкла Фарадея

В результате проведения многих исследований в 1834 году английский физикохимик Майкл Фарадей (в его честь названа единица измерения электрической емкости — фарада) вывел два закона, которые способны количественно описать процесс электролиза. Хотя сам факт разложения соединений под действием проходящего электричества через их растворы был открыт задолго до Фарадея. В 1800 году другой английский ученый Уильям Николсон установил экспериментально этот факт.
Заслуги Фарадея в исследовании электролиза огромны. Он ввел в физикохимию основные термины, которые до сих пор используются для описания этого процесса. Два закона ученого в современной формулировке представляются следующим образом:
- Масса вещества, которая оседает на электроде в процессе электролиза, прямо пропорциональна количеству электричества, проходящему через рассматриваемый электрод. Под количеством электричества понимается заряд, который в системе СИ измеряется в кулонах.
- Для постоянного количества электричества масса химического соединения, которая образуется в ходе электролиза на электроде, является прямо пропорциональной величиной эквиваленту этого вещества. Под эквивалентом полагается отношение молярной массы к количеству молей электронов, участвующих в реакции. Это число совпадает с валентностью элемента, например, для Al3+ оно равно 3, а для H+ составляет 1.
Математическая формула
Оба закона получены Фарадеем экспериментальным путем. Их словесные формулировки можно легко объединить и перевести на математический язык. Общее уравнение, которое удобно использовать при решении любых практических задач, принимает следующую форму:
m = (Q/F)*(M/z).
Здесь m — масса образующегося вещества на электроде, Q — заряд, прошедший через электрод в процессе реакции, F — коэффициент пропорциональности, который называют постоянной Фарадея, M — молярная масса вещества, участвующего в химической реакции, z — его валентность (безразмерное число).
Первый множитель этого уравнения математически отражает сформулированный первый закон Фарадея, соответственно, второй множитель является выражением пропорциональности массы вещества его эквиваленту (M/z).

Эту формулу можно преобразовать, если вспомнить из курса общей физики, что заряд вычисляется по формуле:
Q = I*t.
Здесь I — электрический ток в амперах, t — время его прохождения через электролит. Подставив это выражение в математический закон Фарадея, и преобразуя его, можно получить следующие формулы:
m = kIt = (I*t/F)*(M/z) ==>
n*z*F = I*t.
Значение постоянной F
Численное значение постоянной Фарадея составляет приблизительно 96500 Кл/моль. Физический смысл этой величины заключается в том, что она говорит, какое количество электричества необходимо пропустить через раствор, чтобы выделилось на электроде 1 моль одновалентного вещества.
Величина F тесно связана с постоянной Авогадро NA и с элементарным зарядом электрона e следующим выражением:
F = NA*e.
Эта формула в XIX веке была использована учеными для точного определения числа NA. Сам Фарадей определил постоянную, носящую его фамилию, благодаря изучению процесса электролиза серебряного раствора.
В настоящее время проводятся эксперименты с целью точного определения величины F (а значит, NA), чтобы ее использовать для переопределения единицы измерения массы — килограмма.
Пример решения задачи

Рассмотрим электролиз хлорида кальция в водном растворе. Химическая формула соединения CaCl2. В воде оно хорошо растворяется с образованием ионов Ca2+ и Cl-. Пусть через этот раствор пропустили постоянный ток 5 ампер в течение 2 часов. Необходимо определить массы газообразного хлора и твердого кальция, которые выделятся на аноде и катоде, соответственно.
Известные данные задачи позволяют без проведения промежуточных вычислений провести расчет по современной формуле Фарадея:
- Для анода получается: 2*Cl- — 2*e = Cl2. m (Cl2) = (I*t/F)*(M/z) = (5*7200/96500)*(0,0355/1) = 13,2 грамма.
- Для катода получается: Ca2+ + 2*e = Ca. m (Ca) = (I*t/F)*(M/z) = (5*7200/96500)*(0,040/2) = 7,5 грамма.
Для проведения расчетов использовались молярные массы химических элементов Ca и Cl из таблицы Д. И. Менделеева.
Таким образом, законы Майкла Фарадея являются универсальными для их практического применения к любым химическим веществам, которые участвуют в процессах электролиза. Они позволяют количественно выразить результаты реакций на электродах.
Вывод закона Фарадея[править | править код]
m=miNim = m_i N_i \,\!(1)
mi=μNAm_i = \frac{\mu}{N_A}(2)
Ni=ΔqqiN_i = \frac{\Delta q}{q_i}(3)
Δq=IΔt\Delta q = I \Delta t \,\!(4)
qi=ez,q_i = e z \,\!,
где z — валентность атома (иона) вещества, e — заряд электрона (5)
Подставляя (2) — (5) в (1), получим
m=μzeNAIΔtm = \frac{\mu}{z e N_A} I \Delta tm=μzFIΔtm=\frac{\mu}{z F} I \Delta t
где F=eNA~F=e N_A — постоянная Фарадея.
k=μFzk = \frac{\mu}{F z}m=kIΔtm = kI \Delta t \,\!
Второй закон Фарадеяправить | править код
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты.
Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
k = 1F⋅Azk \ = \ { 1 \over F } \cdot { A \over z }
где F — постоянная Фарадея.
Первый закон Фарадея записывается в следующем виде:
m=M⋅I⋅Δtn⋅F~m=\frac{M{\cdot}I{\cdot}{\Delta}t}{n{\cdot}F}
где M — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, I — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), Δt — время, в течение которого проводился электролиз, F — постоянная Фарадея (96 485,3383(83) Кл·моль−1), n — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Изменение электролизом веществправить | править код
Не все вещества будут участвовать в реакциях при пропускании электрического тока. Существуют некоторые закономерности и правила.
| Катионы активных металлов | Катионы менее активных металлов | Катионы неактивных металлов |
|---|---|---|
| Li+, Cs+, Rb+, K+, Ba2+, Sr2+, Ca2+, Na+, Mg2+, Be2+, Al3+ | Mn2+, Cr3+, Zn2+, Ga3+, Fe2+, Cd2+, In3+, Tl+, Co2+, Ni2+, Mo4+, Sn2+, Pb2+ | Bi3+, Cu2+, Ag+, Hg2+, Pd3+, Pt2+, Au3+ |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода | В водном растворе восстанавливаются металл (при малой концентрации катионов в растворе — металл и водород) | Легко разряжаются и восстанавливается только металл |
| Анионы кислородсодержащих кислот | Гидроксид-ионы; анионы бескислородных кислот (кроме F-) |
|---|---|
| PO43-, CO32-, SO42-, NO3-, NO2-, ClO4— | OH-, Cl-, Br-, I-, S2- |
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода | Легко разряжаются |





























